一个高效的合成异香豆素类化合物通过崔催化串联反应过程
- 格式:pdf
- 大小:235.60 KB
- 文档页数:6
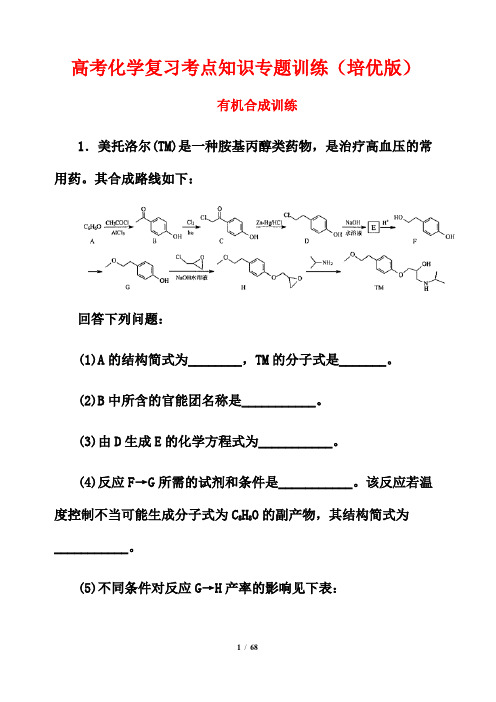
高考化学复习考点知识专题训练(培优版)有机合成训练1.美托洛尔(TM)是一种胺基丙醇类药物,是治疗高血压的常用药。
其合成路线如下:回答下列问题:(1)A的结构简式为________,TM的分子式是_______。
(2)B中所含的官能团名称是___________。
(3)由D生成E的化学方程式为___________。
(4)反应F→G所需的试剂和条件是___________。
该反应若温度控制不当可能生成分子式为C8H8O的副产物,其结构简式为___________。
(5)不同条件对反应G→H产率的影响见下表:注:表中1.2eq。
表示环氧氯丙烷与另一反应物的物质的量之比为1.2:1。
上述实验探究了哪些因素对反应产率的影响___________________。
(6)满足下列条件的D的同分异构体有___________种。
a.芳香族化合物b.苯环上只有两个取代基c. 能够发生消去反应2.据报道,磷酸氯喹()对治疗新冠肺炎具有一定疗效。
氯喹(J)是制备磷酸氯喹的重要中间产物,其合成路线如下图所示:回答下列问题:(1)A的化学名称为___________。
(2)反应①的反应类型为___________。
(3)H中含氧官能团名称为___________。
(4)写出一定条件下反应⑥的化学方程式__________。
(5)写出A在一定条件下反应生成高分子聚合物的反应方程式:__________(6)L是B的同分异构体,与A互为同系物的结构有___________种,其中核磁共振氢谱有三组峰,且峰面积比为6:2:1的结构简式为___________。
(7)根据已有知识并结合题中相关信息,设计由苯和丙酮为原料制备的合成路线(合成路线流程图示例参考本题题干)。
___________3.化合物H是一种治疗失眠症的药物,其一种合成路线如下:易被氧化;已知:①—NH2②;(1)化合物H中所含官能团的名称为___________。

《天然药物化学》练习题解释下列名词:1.正相层析、反相层析 2.有效成分、无效成分 3.单体、有效部位 4.生源的异戊二烯法则 5. 萜类化合物 6. 一级苷、二级苷、次级苷 7. 皂苷 8. 生物碱 9. R f值 10. UV、IR、NMR、MS、FAB-MS、HR-MS 、CD、ORD 11. Smith降解 12. Molish反应 13. 二次代谢产物 14.DCCC 15.苷化位移 16.单糖链皂苷和双糖链皂苷 17. C1和1C构象式第一章总论一、问答题1. 溶剂提取法选择溶剂的依据是什么?水、乙醇、苯各属于什么溶剂,优缺点是什么?2. 水蒸气蒸馏法主要用于哪些成分的提取?二、填空题1. 层析法按其基本原理分为①________ ②_________ ③_________ ④__________。
2. 不经加热进行的提取方法有_____和_____;利用加热进行提取的方法有____和______,在用水作溶剂时常利用______,用乙醇等有机溶剂作提取溶剂时常利用_____。
3. 硅胶吸附层析适于分离__ __成分,极性大的化合物R f____;极性小的化合物R f______。
4. 利用萃取法或分配层析法进行分离的原理主要是利用____________。
5. 测定中草药成分的结构常用的四大波谱是指______、______、______和_______,另外ORD谱主要用于____ _,X衍射主要用于____ __。
三、判断正误1. 蛋白质皆易溶于水而不溶于乙醇。
( )2. 苦味质就是植物中一类味苦的成分的统称。
( )3. 在硝酸银络合薄层层析中,顺式双键化合物与硝酸银络合较反式的易于进行。
( )4. 化合物乙酰化得不到乙酰化物说明结构中无羟基。
( )5. 植物有效成分的含量不随生长环境的变化而变化。
( )6. 同一化合物用不同溶剂重结晶,其结晶的熔点可能有差距。
( )7. 某结晶物质经硅胶薄层层析,用一种展开剂展开,呈单一斑点,所以该晶体为一单体。

最新-全国高中化学竞赛模拟试题卷26附参考答案最新-全国高中化学竞赛模拟试题二十六第一题、以下为某一核素(半衰期为t1/2=0.18c )的几个核反应方程式已知x,y,z 为稳定的微粒,B的原子序数为A原子序数的两倍 1-1、写出方程式(1)(2)(3)(4)(5)1-2、计算1秒种内1mg 有多少个原子发生了衰变第二题、2-1.-5℃时,高氙酸钠(Na 4XeO 6)能跟浓硫酸反应生成XeO 4气体。
XeO 4极不稳定,固体在-40℃时也可能发生爆炸生成氙气和氧气。
请写出这两个反应的化学方程式。
2-2.Xe 的原子序数为54,Xe 核外M 层和N 层的电子数分别 为 和。
2-3.高氙酸钠(Na 4XeO 6)用于分析锰、铈和铬等元素,显示有突出的优越性,例如高氙酸钠在酸性溶液中能将Mn 2+氧化成MnO 4-,生成XeO 3。
高氙酸钠在水溶液中已发生了如下反应:Na 4XeO 6 + H 2O = NaOH + Na 3HXeO 6请写出高氙酸钠溶液和硫酸锰的硫酸溶液反应的离子方程式: ,若有1 mol Na 4XeO 6参加反应,转移电子 mol 。
第三题、写出下列方程式3-1.H 3BO 3作为一元弱酸与碱反应时本身无化学键断裂,写出H 3BO 3溶于液氨的方程式3-2、用浓氨水和碘片反应可生成一种不溶于水的炸药—碘化氮晶体(NI 3·NH 3),写出该炸药合成与爆炸的方程式。
3-3、试写出在氯化亚硝酰非水溶剂中,(NO)AlCl 4与[(CH 3)4N]Cl 反应的方程式第四题、 已知在水溶液中,Cu 的电位图为 Cu V Cu V Cu 521.0 153.0 2++4-1、Cu +在水溶液中能稳定存在吗?如果不能应该怎么才能使一价铜存在于水溶液中?4-2、在乙腈非水介质中却为 Cu V Cu Cu 0.118 V 0.1242 2-++,解释这种差别。
第五题、铂的配合物{Pt(CH 3NH 2)(NH 3)[CH 2(COO)2]}是一种抗癌新药,药效高而毒副作用小,其合成路线如下:K 2PtCl 4 I A (棕色溶液) II B (黄色晶体) III C (红棕色固体) I VD (金黄色晶体) VE (淡黄色晶体) (I )加入过量KI ,反应温度70o C ;(II )加入CH 3NH 2;A 与CH 3NH 2的反应摩尔比=1:2;(I I I )加入HClO 4和乙醇;红外光谱显示C 中有两种不同振动频率的Pt —I 键,而且C 分子呈中心对称,经测定,C 的相对分子质量为B 的1.88倍;(I V )加入适量的氨水得到极性化合物D ;(V )加入Ag 2CO 3和丙二酸,滤液经减压蒸馏得到E 。
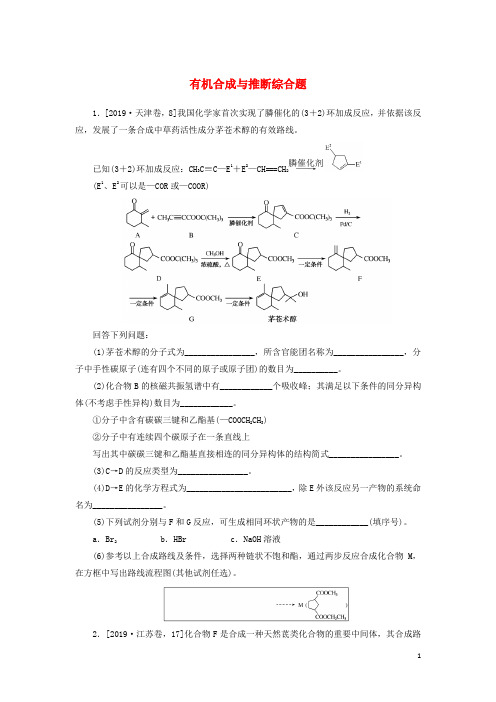
有机合成与推断综合题1.[2019·天津卷,8]我国化学家首次实现了膦催化的(3+2)环加成反应,并依据该反应,发展了一条合成中草药活性成分茅苍术醇的有效路线。
膦催化剂已知(3+2)环加成反应:CH3C≡C—E1+E2—CH===CH2――→(E1、E2可以是—COR或—COOR)回答下列问题:(1)茅苍术醇的分子式为________________,所含官能团名称为________________,分子中手性碳原子(连有四个不同的原子或原子团)的数目为__________。
(2)化合物B的核磁共振氢谱中有____________个吸收峰;其满足以下条件的同分异构体(不考虑手性异构)数目为____________。
①分子中含有碳碳三键和乙酯基(—COOCH2CH3)②分子中有连续四个碳原子在一条直线上写出其中碳碳三键和乙酯基直接相连的同分异构体的结构简式________________。
(3)C→D的反应类型为________________。
(4)D→E的化学方程式为________________________,除E外该反应另一产物的系统命名为________________。
(5)下列试剂分别与F和G反应,可生成相同环状产物的是____________(填序号)。
a.Br2b.HBr c.NaOH溶液(6)参考以上合成路线及条件,选择两种链状不饱和酯,通过两步反应合成化合物M,在方框中写出路线流程图(其他试剂任选)。
2.[2019·江苏卷,17]化合物F是合成一种天然茋类化合物的重要中间体,其合成路线如下:(1)A中含氧官能团的名称为________和________。
(2)A→B的反应类型为________。
(3)C→D的反应中有副产物X(分子式为C12H15O6Br)生成,写出X的结构简式:____________。
(4)C的一种同分异构体同时满足下列条件,写出该同分异构体的结构简式:______________。

天然药物化学试题 (1)一、指出下列各物质的成分类别(每题1分,共10分)1、纤维素2、酶3、淀粉4、桔霉素5、咖啡酸6、芦丁7、紫杉醇8、齐墩果酸9、乌头碱 10、单糖 二、名词解释(每题2分,共20分)1、天然药物化学2、异戊二烯法则3、单体4、有效成分5、HR —MS6、液滴逆流分配法7、UV8、盐析9、透析 10、萃取法 三、判断题(正确的在括号内划“√”,错的划“X ” 每题1分,共10分) ( )1.13C-NMR 全氢去偶谱中,化合物分子中有几个碳就出现几个峰。
( )2.多羟基化合物与硼酸络合后,原来中性的可以变成酸性,因此可进行酸碱中和滴定。
( )3.D-甘露糖苷,可以用1H-NMR 中偶合常数的大小确定苷键构型。
( )4.反相柱层析分离皂苷,以甲醇—水为洗脱剂时,甲醇的比例增大,洗脱能力增强。
( )5.蒽醌类化合物的红外光谱中均有两个羰基吸收峰.( )6.挥发油系指能被水蒸气蒸馏出来,具有香味液体的总称。
( )7.卓酚酮类成分的特点是属中性物、无酸碱性、不能与金属离子络合,多有毒性。
( )8.判断一个化合物的纯度,一般可采用检查有无均匀一致的晶形,有无明确、尖锐的熔点及选择一种适当的展开系统,在TLC 或PC 上样品呈现单一斑点时,即可确认为单一化合物.( )9.有少数生物碱如麻黄碱与生物碱沉淀试剂不反应。
( )10.三萜皂苷与甾醇形成的分子复合物不及甾体皂苷稳定。
四.选择题(将正确答案的代号填在题中的括号内,每小题1分,共10分)1. 糖的端基碳原子的化学位移一般为( ).A δppm 〈50 B δppm60~90 C δppm90~110 D δppm120~160 E δppm>160 2. 紫外灯下常呈蓝色荧光的化合物是( )。
A 黄酮苷 B 酚性生物碱 C 萜类 D 7-羟基香豆素3.除去水提取液中的碱性成分和无机离子常用( )。
A 沉淀法 B 透析法 C 水蒸气蒸馏法 D 离子交换树脂法 4.中药的水提液中有效成分是亲水性物质,应选用的萃取溶剂是( ). A 丙酮 B 乙醇 C 正丁醇 D 氯仿 5.黄酮类化合物中酸性最强的是( )黄酮。

专题二十五有机化学基础高考帮·备考方向导航1.[2020全国卷Ⅰ,8,6分]紫花前胡醇()可从中药材当归和白芷中提取得到,能提高人体免疫力。
有关该化合物,下列叙述错误的是( )A.分子式为C14H14O4B.不能使酸性重铬酸钾溶液变色C.能够发生水解反应D.能够发生消去反应生成双键2.[2020山东,19,12分]化合物F是合成吲哚-2-酮类药物的一种中间体,其合成路线如下:A B()C DE F(C10H9NO2)已知:Ⅰ.Ⅱ.Ⅲ.Ar—X+Ar为芳基;X=Cl,Br;Z或Z'=COR,CONHR,COOR等。
回答下列问题:(1)实验室制备A的化学方程式为,提高A产率的方法是;A的某同分异构体只有一种化学环境的碳原子,其结构简式为。
(2)C→D的反应类型为;E中含氧官能团的名称为。
(3)C的结构简式为,F的结构简式为。
(4)Br2和的反应与Br2和苯酚的反应类似,以和为原料合成,写出能获得更多目标产物的较优合成路线(其他试剂任选)。
3.[2020浙江7月选考,31,12分]某研究小组以邻硝基甲苯为起始原料,按下列路线合成利尿药美托拉宗。
已知:+请回答:(1)下列说法正确的是。
A.反应Ⅰ的试剂和条件是Cl2和光照B.化合物C能发生水解反应C.反应Ⅱ涉及到加成反应、取代反应D.美托拉宗的分子式是C16H14ClN3O3S(2)写出化合物D的结构简式。
(3)写出B+E F的化学方程式。
(4)设计以A和乙烯为原料合成C的路线(用流程图表示,无机试剂任选) 。
(5)写出化合物A同时符合下列条件的同分异构体的结构简式。
1H-NMR谱和IR谱检测表明:①分子中共有4种氢原子,其中苯环上的有2种;②有碳氧双键,无氮氧键和—CHO。
4.[2020天津,14,18分]天然产物H具有抗肿瘤、镇痉等生物活性,可通过以下路线合成。
已知:+(Z=—COOR、—COOH等)回答下列问题:(1)A的链状同分异构体可发生银镜反应,写出这些同分异构体所有可能的结构: 。
北京市西城区2022届高三第二次模拟测试化学试题一、单选题1.将氧化还原反应拆解为氧化反应和还原反应的分析过程,蕴含的化学学科的思想方法是()A.分与合相结合B.量变与质变相结合C.化学与社会和谐发展D.物质变化是有条件的2.下列图示正确的是()A.3p电子的电子云轮廓图:B.SO3的VSEPR模型:C.As的原子结构示意图:D.HCl的形成过程:3.下列事实不能直接从原子结构角度解释的是()A.化合物ICl中I为+1价B.第一电离能:B>AlC.沸点:CS2>CO2D.热稳定性:NH3>PH34.我国拥有独立知识产权的抗高血压药物左旋氨氯地平的分子具有手性,其结构简式如图。
下列关于左旋氨氯地平的说法错误的是()A.分子中含有酯基B.酸性条件下的所有水解产物均能与NaHCO3溶液反应C.能与H2发生加成反应D.有手性异构体5.向含HCN的废水中加入铁粉和K2CO3可制备K4[Fe(CN)6],反应如下:6HCN+Fe+2K2CO3=K4[Fe(CN)6]+H2↑+2CO2↑+2H2O。
下列说法错误的是()A.依据反应可知:K a(HCN)>K a1(H2CO3)B.HCN的结构式是H—C≡NC.反应中每1molFe转移2mol电子D.[Fe(CN)6]4-中Fe2+的配位数是66.下列实验方案能达到相应实验目的的是()A.A B.B C.C D.D7.工业合成乙醇的反应:C2H4(g)+H2O(g) ⇌C2H5OH(g) ΔH<0,在催化剂、260-290℃。
和约7MPa 的条件下进行。
下列说法错误的是()A.循环使用乙烯是为了提高乙烯的利用率B.原理分析表明合成时压强越大越好,但实际生产中还要考虑安全、成本等因素C.其他条件不变时,投料比n(H2O)∶n(C2H4)越小,乙烯的平衡转化率越大D.寻找高活性的催化剂是研究该反应的重要方向8.在卤水精制中,纳滤膜对Ca2+、Mg2+有很高的脱除率。
第一章测试1.下列原子核中,能够产生核磁共振信号的是()。
答案:D2.以下方法可用于确定苷键构型的是()。
A:可以根据某些糖端基氢的偶合常数B:某些单糖还可借助IR谱进行分析C:可根据端基碳的化学位移值来进行判定D:可根据糖端基碳氢的偶合常数判定E:利用Klyne经验公式计算答案:ACDE3.能区分碳的类型的谱学方法是()谱。
A:HMBCB:BBDC:HMQCD:NOEE:DEPTF:OFR答案:CEF4.下列论述正确的是()。
A:紫外光谱只用于决定结构中共轭体系的存在与否,不能用于解决立体化学问题。
B:强心苷类化合物,因C-10,13位的甲基的化学位移值与C-5,14的构型有关,因此在某种条件下,可根据甲基化学位移值的大小来判定环的稠合方式。
C:红外光谱除用于推定结构中官能团的有无外,还能应用其研究立体结构。
D:齐墩果烷类化合物的UV光谱中,若242nm处有最大吸收,则H-18为α取向。
E:因质子之间的偶合常数与其形成的二面角大小有关,因此可利用此参数来判定质子的相对立体取向。
答案:BCDE5.能区分碳的类型的谱学方法是()谱。
A:COMB:DEPTC:OFRD:HMQCE:MSF:HMBC答案:BCD6.下列论述正确的是()。
A:互为反式的双键上两个质子的偶合常数要大于其顺式的偶合常数。
B:强心苷类化合物,因C-10,13位的甲基的化学位移值与C-5,14的构型有关,因此在某种条件下,可根据甲基化学位移值的大小来判定环的稠合方式。
C:因质子之间的偶合常数与其形成的二面角大小有关,因此可利用此参数来判定质子的相对立体取向。
D:因红外光谱只用于推定结构中官能团的有无外,因此不能应用其研究立体结构。
E:紫外光谱不仅可用于判定结构中共轭体系的存在与否,还可用于立体构型和构象的判定。
答案:ABCDE7.影响碳信号化学位移的因素有()。
A:诱导效应的影响B:碳核周围的电子云密度C:碳原子的杂化方式D:共轭效应的影响E:立体效应的影响答案:ABCD8.碳信号的化学位移因受碳的杂化方式影响,故sp3杂化的碳信号比sp2杂化的碳处于低场,化学位移值大。
一、选择题1.顺-1,4-聚异戊二烯,又称“天然橡胶”。
合成顺式聚异戊二烯的部分流程如图。
下列说法正确的是23Al O ①Δ−−−→N 催化剂Δ−−−−−→顺式聚异戊二烯 A .N 是顺式异戊二烯 B .M 存在顺反异构体C .N 分子中最多有10个原子共平面D .顺式聚异戊二烯的结构简式为答案:D解析:A .N 发生缩聚反应生成顺式聚异戊二烯,则N 为异戊二烯,不存在顺反异构,故A 错误;B .双键上存在同一碳原子连接2个氢原子,则M 不存在顺反异构体,故B 错误;C .N 为异戊二烯,碳碳双键为平面结构,旋转碳碳单键可以使碳碳双键形成的2个平面重合,甲基是四面体结构,可以使甲基中1个氢原子处于平面内,因此分子中最多有11个原子共面,故C 错误;D .两个相同原子或基团在双键同一侧的为顺式异构体,故顺式聚异戊二烯的结构简式为,故D 正确;故选D 。
2.化学与生产、生活密切相关,下列说法不正确...的是 A .工业上铝、铁、铜等一般通过热还原法冶炼 B .FeCl 3溶液可用于蚀刻铜制电路板 C .地沟油经过加工处理后可用来制生物柴油 D .加热能杀死流感病毒是因为蛋白质受热变性答案:A解析:A .铝为活泼金属,常用电解法冶炼,A 项错误;B .3+2+2+2Fe +Cu=2Fe +Cu ,铁离子的氧化性大于铜离子,可以用于刻蚀电路板,B 项正确;C .地沟油与甲醇在催化剂的作用下进行酯交换用于制作柴油,C 项正确;D .蛋白质易受热变性,故可以通过加热来进行杀菌,D 项正确; 答案选A 。
3.按如图路线制聚氯乙烯,未发生的反应类型是C2H5Br→ CH2=CH2→ CH2Cl-CH2Cl→CH2=CHCl→A.取代反应B.消去反应C.加成反应D.加聚反应答案:A解析:C2H5Br→ CH2=CH2发生消去反应,CH2=CH2→ CH2Cl-CH2Cl发生加成反应,CH2Cl-CH2Cl→CH2=CHCl发生消去反应,而CH2=CHCl→发生加聚反应,整个合成路线中未发生取代反应,故答案为A。
技术资料精细有机单元反应习题集精细有机单元反应教材编写组2007,6第一章绪论一、填空题1、所谓“精细化率”是指。
2、精细化学品是经加工的,具有或最终使用性的,品种、产量小、附加高的一大类化工产品。
3、我国原化学工业部上个世纪八十年代颁布的《关于精细化工产品的分类的暂行规定和有关事项的通知》中明确规定,中国精细化工产品包括个产品类别。
4、有机精细化学品的合成是由若干个基本反应组成。
这些基本反应我们称之单元反应。
重要的单元反应有。
5、在新的合成路线设计和选择时,要优先考虑、污染环境不大且容易治理的工艺路线。
6、天然气的主要成分是。
根据甲烷含量的不同,天然气可分为两种。
7、煤通过方法提供化工原料。
8、催化重整是得到三种重要芳烃原料的方法。
二、判断题1、氧化锌类感光材料、铁酸盐类磁性材料、精细陶瓷产品、包括导电陶瓷、透光陶瓷等一般均属有机精细化学品。
2、在合成路线设计中,反应的排列方式也直接影响总收率。
一般来说,在反应步数相同的情况下,线性法的总收率高于收敛法,因此,尽可能采用线性法。
3、碳水化合物是由碳、氢、氧三种元素组成,它们的分子组成一般可表示为Cx(H2O)y, 如葡萄糖C6H12O6=C6(H2O)6,蔗糖C12H22O11=C12(H2O)11,所以说碳水化合物是由碳和水组成的化合物。
4、在进行合成路线设计和选择时,应尽量少用或不用易燃、易爆和有剧毒原料和试剂。
5、合成路线中反应步数和反应总收率是评价合成路线的最直接、最主要的标准。
三、简答题1、为什么说合成路线中反应步数和反应总收率是评价合成路线的最直接、最主要的标准。
2、简述精细化学品合成的原料来源。
3、在设计精细有机合成路线时,需要考虑哪些主要问题?4、写出以下基本化工原料主要来自哪种资源:(1)甲烷;(2)一氧化碳;(3)乙炔;(4)乙烯;(5)C18~C30直链烷烃;(6)C12~C18直链脂肪烃;(7)苯;(8)萘。
5、对精细化学品的定义进行释义。
Science in China Series B: Chemistry© 2009 SCIENCE IN CHINA PRESSSpringer An efficient synthesis of isocoumarins via a CuI catalyzed cascade reaction processWANG LeiLei 1, ZHANG XiaoJing 1, JIANG YongWen 2† & MA DaWei 2†1 Shenyang Pharmaceutical University, Shenyang 110016, China;2State Key Laboratory of Bioorganic Chemistry and Natural Products, Shanghai Institute of Organic Chemistry, Chinese Academy of Sciences, Shanghai 200032, China3-Alkyl isocoumarins are provided by CuI/amino acid-catalyzed Sonogashira coupling reaction of o -bromo benzoic acids and terminal alkynes and the subsequent additive cyclization. This cascade process allows synthesis of diverse isocoumarins by varying both coupling partners bearing a wide range of functional groups.coupling, cascade reaction, copper iodide, isocoumarins1 IntroductionIsocoumarins exist in many naturally occurring lactoneswith various biological activities, such as antifungal,antibacterial, and anti-diabetic effects [1―7]. For example,compound 185322 is a novel inhibitor of microtubule assembly that induces mitotic phase arrest and apoptosis of human multiple myeloma cells [8], and bacilosarcin Bisolated from the marine-derived bacterium Bacillussubtilis shows growth inhibition against barnyard mil-let (Figure 1)[9].Figure 1Early studies have indicated that simple isocoumarins could be synthesized from 2-bromobenzoate and ethyl- ene via a Pd-catalyzed Heck reaction and subsequent transformation [10]. A Pd-catalyzed domino Sonogashira coupling/cyclization process of o -halobenzoic acid and1-alkynes was then developed for the same purpose [11―17].In this process, selectivity for 5-exo and 6-endo cycliza-tion is a problem, which relies on Pd catalyst [11―15], sub-strates [16] and solvent [17].On the basis of CuI/amino acid-promoted Ullmann type coupling reactions, our group has developed a se-ries of methods for the assembly of heterocycles under mild reaction conditions [18―21; 22―30]. For example, 2-sub- stituted indoles could be elaborated via a CuI/L-prolinecatalyzed domino Sonogashira coupling/cyclizationprocess [26,31]. Stimulated by this result, we investigated the coupling of 2-halobenzoic acid with terminal alkynes under the catalysis of CuI, and found that 3-alkyl sub- stituted isocoumarins could be obtained regioselectively. Both iodides and bromides are available for this domino process, thereby providing an inexpensive and practical approach for the assembly of isocoumarins. 2 Experiments2.1 ExperimentalAll solvents were purified and dried prior to use. 1HReceived July 20, 2009; accepted July 23, 2009 doi: 10.1007/s11426-009-0197-6 †Corresponding author (email: madw@ )Supported by the National Natural Science Foundation of China (Grant Nos. 20621062 & 20872156),Sci China Ser B-Chem | Oct. 2009 | vol. 52 | no. 10 | 1616-1621NMR spectra were recorded at Bruker Avance 300 MHz, and 13C NMR spectra were recorded at Bruker Avance 400 MHz, and assigned in parts per million (δ). Low-resolution mass spectra were recorded on a GILENT5973 instrument (EI) and a LCMS-2010EV instrument (ESI). High-resolution mass spectra were recorded on an IonSpec 4.7 Tesla FTMS instrument. Silica gel plate GF254 was used for thin layer chroma-tography (TLC) and silica gel H or 300―400 meshes were used for flash column chromatography.2.2 General procedure of synthesisAn oven-dried Schlenk tube was charged with CuI (0.20 mmol), trans-4-hydroxy-L-proline (26 mg, 0.20 mmol) and K2CO3 (276 mg, 2 mmol), and 2-bromobenzoic acid1 (1.0 mmol). The tube was evacuated and backfilled with argon (3 times), and then alkyne2 (1.5 mmol) and DMSO (2.0 mL) were added. The reaction mixture was stirred at 70℃ until the 2-bromobenzoic acid 1 disap-peared (monitored by TLC). After cooling, 30 mL ethyl acetate was added. The organic layer was separated, washed with water and brine, and dried over Na2SO4. After removal of the solvent in vacuo, the residue was purified by silica gel chromatography to give the desired isocoumarin 3.(1) 3-Pentyl-1H-isochromen-1-one (3a). 1H NMR (300 MHz, CDCl3) δ 8.24 (d, J=8.1 Hz, 1 H), 7.66 (t, J=7.5 Hz, 1 H), 7.43 (t, J=8.1 Hz, 1 H), 7.35 (d, J= 7.8 Hz, 1 H), 6.25 (s, 1 H, CH=C), 2.51 (t, J=7.8 Hz,2 H, CH2), 1.73―1.68 (m, 2 H, CH2), 1.37―1.34 (m, 4 H, 2CH2), 0.90 (t, J=6.3 Hz, 3 H, CH3). EI-MS m/z 216 (M+).(2) 3-(2-Hydroxypropan-2-yl)-1H-isochromen-1-one (3b). 1H NMR (300 MHz, CDCl3) δ 8.25 (d, J=8.1 Hz, 1 H), 7.69 (t, J=7.2 Hz, 1 H), 7.47 (t, J=7.8 Hz, 1 H), 7.41 (d,J=7.8 Hz, 1 H), 6.64 (s, 1 H, CH=C), 2.82 (bs, 1 H, OH), 1.60 (s, 6 H, 2CH3). EI-MS m/z 204 (M+).(3) Ethyl-5-(1-oxo-1H-isochromen-3-yl)pentanoate (3c). 1H NMR (300 MHz, CDCl3) δ 8.24 (d, J=7.8 Hz, 1 H), 7.67 (t, J=7.5 Hz, 1 H), 7.45 (t, J=8.1 Hz, 1 H), 7.35 (d,J=7.5 Hz, 1 H), 6.28 (s, 1 H, CH=C), 4.13 (q, J=7.2 Hz,2 H), 2.55 (t, J=6.9 Hz, 2 H, CH2), 2.35 (t, J=6.6 Hz,2 H, CH2), 1.74―1.72 (m, 4 H, 2CH2), 1.25 (t, J=7.2 Hz,3 H, CH3). EI-MS m/z 274 (M+).(4) 3-Butyl-1H-isochromen-1-one (3d).1H NMR (300 MHz, CDCl3) δ 8.23 (d, J=7.8 Hz, 1 H), 7.66 (t, J=7.8 Hz, 1 H), 7.43 (t, J=8.1 Hz, 1 H), 7.34 (d, J= 7.8 Hz, 1 H), 6.25 (s, 1 H, CH=C), 2.52 (t, J=7.5 Hz, 2 H, CH2), 1.74―1.64 (m, 2 H, CH2), 1.46―1.34 (m, 2 H, CH2), 0.94 (t, J=7.2 Hz, 3 H, CH3). EI-MS m/z 202 (M+).(5) 3-(Hydroxymethyl)-1H-isochromen-1-one (3e). 1H NMR (300 MHz, CDCl3) δ 8.28 (d, J=8.1 Hz, 1 H), 7.72 (t, J=7.2 Hz, 1 H), 7.51 (t, J=7.8 Hz, 1 H), 7.43 (d, J=7.8 Hz, 1 H), 6.56 (s, 1 H, CH=C), 4.50 (s, 2 H, CH2), 1.83 (bs, 1 H, OH). EI-MS m/z 176 (M+).(6) 3-(Benzyloxymethyl)-1H-isochromen-1-one (3f). l H NMR (300 MHz, CDC13) δ 8.24 (d, J=8.1 Hz, 1 H), 7.67 (t, J=7.2 Hz, l H), 7.46 (t, J=7.5 Hz, l H ), 7.39―7.29 (m, 6 H), 6.55 (s, l H, CH=C), 4.65 (s, 2 H, OCH2), 4.34 (s, 2 H, OCH2). 13C NMR (100 MHz, CDCl3) δ162.2, 153.6, 137.2, 136.7, 134.8, 129.6, 128.5 (2C), 128.2, 127.9, 127.8 (2C), 125.6, 120.6, 103.9, 73.1, 67.9. EI-MS m/z 266 (M+).(7) Methyl-(1-oxo-1H-isochromen-3-yl)methylc-arbamate (3g). l H NMR (300 MHz, CDC13) δ 8.23 (d, J=7.8 Hz, 1 H), 7.69 (t, J=7.5 Hz, l H), 7.48 (t, J=7.8 Hz, l H), 7.39 (d, J=7.5 Hz, 1 H), 6.49 (s, l H, CH=C), 5.53 (s, 1 H, NH), 4.21 (d, J=6.3 Hz, 2 H, CH2), 3.70 (s, 3 H, COOCH3). 13C NMR (100 MHz, CDCl3) δ 162.2, 156.8, 153.1, 136.6, 134.8, 129.4, 128.2, 125.5, 120.2, 103.5, 52.3, 42.3. EI-MS m/z 233 (M+).(8) 3-(1-Hydroxypropyl)-1H-isochromen-1-one (3h). l H NMR (300 MHz, CDC13) δ 8.22 (d, J=7.8 Hz, 1 H), 7.68 (t, J=7.8 Hz, l H), 7.47 (t, J=7.8 Hz, l H), 7.39 (d, J=7.5 Hz, 1 H), 6.56 (s, l H, CH=C), 4.41 (t, J=7.2 Hz, l H), 2.81 (bs, 1 H, OH), 2.04―1.77 (m, 2 H, CH2), 1.00 (t, 3 H, J=7.5 Hz, CH3). EI-MS m/z 204 (M+).(9) 3-(1-Hydroxyhexyl)-1H-isochromen-1-one (3i). l H NMR (300 MHz, CDC13) δ 8.25 (d, J=8.1 Hz, 1 H), 7.70 (t, J=7.8 Hz, l H), 7.49 (t, J=7.8 Hz, l H), 7.41 (d, J=8.1 Hz, 1 H), 6.55 (s, l H, CH=C),4.48―4.44 (m, l H), 2.20 (bs, 1 H, OH), 1.96―1.72 (m, 2 H, CH2), 1.49―1.25 (m, 6 H, 3CH2), 0.88 (t, 3H, J.=6.6 Hz, CH3). 13C NMR (100 MHz, CDCl3) δ 162.5, 158.4, 136.9, 134.8, 129.4, 128.0, 125.7, 120.3, 102.0, 70.9, 34.9, 31.4, 24.9, 22.4, 13.9. EI-MS m/z 246 (M+).(10) 3-Benzyl-1H-isochromen-1-one (3j). l H NMR (300 MHz, CDC13) δ 8.24 (d, J=7.8 Hz, 1 H) ,7.62 (t, J=7.8 Hz, l H), 7.44 (t, J=7.8 Hz, l H), 7.38―7.29 (m,WANG LeiLei et al. Sci China Ser B-Chem | Oct. 2009 | vol. 52 | no. 10 | 1616-162116176 H), 6.16 (s, l H, CH=C), 3.84 (s, 2 H, CH2). 13C NMR (100 MHz, CDCl3) δ 162.7, 156.9, 137.2, 135.6, 134.6, 129.4, 129.2, 128.7, 127.7, 127.1, 125.2, 120.0, 103.8, 39.7. EI-MS m/z 236 (M+).(11) 3-Butyl-7-methoxy-1H-isochromen-1-one (3l). 1H NMR (300 MHz, CDCl3) δ 7.66 (s, 1 H), 7.28-7.27 (m, 2 H), 6.22 (s, 1 H, CH=C), 3.89 (s, 3 H, CH3O), 2.51 (t,J=7.5 Hz, 2 H, CH2), 1.73―1.63 (m, 2 H, CH2), 1.46―1.33 (m, 2 H, CH2), 0.94 (t, J=7.2 Hz, 3 H, CH3). EI-MS m/z 232 (M+).(12) 3-(2-Hydroxypropan-2-yl)-7-methoxy-1H-isochromen-1-one (3m). 1H NMR (300 MHz, CDCl3) δ 7.68 (d, J= 2.7 Hz, 1 H), 7.37 (d, J=8.7 Hz, 1 H), 7.30 (dd, J=2.7, 8.4 Hz, 1 H), 6.58 (s, 1 H, CH=C), 3.90 (s, 3 H, CH3O), 2.25 (bs, 1 H, OH), 1.60 (s, 6 H, 2CH3). EI-MS m/z 234 (M+).(13) Methy-5-(7-methoxy-1-oxo-1H-isochromen-3-yl)pen- tanoate (3n). 1H NMR (300 MHz, CDCl3) δ 7.66 (s, 1 H), 7.28―7.26 (m, 2 H), 6.24 (s, 1 H, CH=C), 4.13 (q, J= 7.2 Hz, 2 H), 3.89 (s, 3 H, CH3O), 2.54 (t, J=6.6 Hz, 2 H, CH2), 2.34 (t, J=6.2 Hz, 2 H, CH2), 1.74―1.71 (m, 4 H,2CH2), 1.25 (t, J=7.2 Hz, 3 H, CH3). 13C NMR (100 MHz, CDCl3) δ 173.3, 163.1, 159.0, 155.3, 131.1, 126.6, 124.4, 121.1, 109.8, 102.7, 60.2, 55.6, 33.9, 32.9, 26.3, 24.2, 14.2. EI-MS m/z 304 (M+).(14) N-(3-butyl-1-oxo-1H-isochromen-7-yl)acetamide (3o). 1H NMR (300 MHz, CD3OD) δ 8.39 (d, J=1.8 Hz, 1 H), 7.92 (dd, J=1.8, 8.4 Hz, 1 H), 7.44 (d, J=8.7 Hz, 1 H), 6.43 (s, 1 H, CH=C), 2.54 (t, J=7.2 Hz, 2 H, CH2), 2.15 (s, 3 H, CH3CO), 1.73―1.62 (m, 2 H, CH2), 1.47―1.35 (m, 2 H, CH2), 0.96 (t, J=7.2 Hz, 3 H, CH3). EI-MS m/z 259 (M+).(15) N-(3-(2-hydroxypropan-2-yl)-1-oxo-1H-isochromen-7-yl)acetamide (3p). 1H NMR (300 MHz, (CD3)2SO) δ10.31 (s, 1 H, NH), 8.47 (s, 1 H), 7.90 (dd, J=1.2, 8.1 Hz,1 H), 7.61 (d, J=8.1 Hz, 1 H), 6.73 (s, 1 H, CH=C), 5.47 (bs, 1 H, OH), 2.08 (s, 3 H, COCH3), 1.41 (s, 6 H, 2CH3). 13C NMR (100 MHz, CDCl3) δ 169.0, 162.1, 161.9, 139.4, 132.6, 127.2, 126.6, 120.0, 117.4, 99.5, 69.7, 28.6 (2C), 24.4. EI-MS m/z 261 (M+).(16) 3-Butyl-6-methyl-1H-isochromen-1-one (3q). 1H NMR (300 MHz, CDCl3) δ 8.09 (d, J=8.1 Hz, 1 H), 7.22 (d, J=8.4 Hz, 1 H), 7.11 (s, 1 H), 6.16 (s, 1 H, CH=C), 2.48 (t, J=7.2 Hz, 2 H, CH2), 2.42 (s, 3 H, CH3), 1.71―1.61 (m, 2 H, CH2), 1.43―1.31 (m, 2 H, CH2), 0.92 (t, J=7.2 Hz, 3 H, CH3). EI-MS m/z 216 (M+).(17) 6-Chloro-3-(2-hydroxypropan-2-yl)-1H-isochromen- 1-one (3r). 1H NMR (300 MHz, CDCl3) δ 8.23 (d, J= 1.5 Hz,1 H), 7.65 (dd, J=2.1, 8.4 Hz, 1 H), 7.38 (d, J= 8.1 Hz, 1 H), 6.63 (s, 1 H, CH=C), 2.23 (bs, 1 H, OH), 1.60 (s, 6 H, 2CH3). EI-MS m/z 238 (M+).(18) 3-butyl-6-chloro-1H-isochromen-1-one (3s). 1H NMR (300 MHz, CDCl3) δ 8.22 (d, J=1.2 Hz, 1 H), 7.61 (dd, J=2.4, 8.4 Hz, 1 H), 7.31 (d, J=8.4 Hz, 1 H), 6.24 (s, 1 H, CH=C), 2.53 (t, J=7.5 Hz, 2 H, CH2), 1.74―1.64 (m, 2 H, CH2), 1.46―1.34 (m, 2 H, CH2), 0.95 (t, J=7.2 Hz, 3 H, CH3). EI-MS m/z 236 (M+). (19) 3-(2-Hydroxypropan-2-yl)-7-nitro-1H-isochromen- 1-one (3t). 1H NMR (300 MHz, CDCl3) δ 9.18 (d, J= 1.5 Hz, 1 H), 8.51 (dd, J=2.4, 9.0 Hz, 1 H), 7.60 (d, J= 8.4 Hz, 1 H), 6.79 (s, 1 H, CH=C), 2.14 (bs, 1 H, OH), 1.62 (s, 6 H, 2CH3). EI-MS m/z 249 (M+).(20)7,8-Dimethoxy-3-pentyl-1H-isochromen-1-one (3u). 1H NMR (300 MHz, CDCl3) δ 7.24 (d, J=8.4 Hz, 1 H), 7.00 (d, J=8.4 Hz, 1 H), 6.06 (s, 1 H, CH=C), 3.90 (s, 3 H, CH3O), 3.86 (s, 3 H, CH3O), 2.39 (t, J=7.5 Hz, 2 H, CH2), 1.64―1.59 (m, 2 H, CH2), 1.28―1.27 (m, 4 H, 2CH2), 0.84 (t, J=6.3 Hz, 3 H, CH3). 13C NMR (100 MHz, CDCl3) δ 159.6, 156.0, 152.0, 150.7, 132.2, 120.7, 120.5, 114.5, 102.2, 61.4, 56.5, 33.0, 31.1, 26.4, 22.3, 13.9. EI-MS m/z 276 (M+).(21) 3-Hexylidene-6,7-dimethoxy-3H-isobenzofuran- 1-one (4u). 1H NMR (300 MHz, CDCl3) δ 7.28 (d, J= 8.4 Hz, 1 H), 7.23 (d, J=8.1 Hz, 1 H), 5.46 (t, J=7.8 Hz,1 H), 4.12 (s,3 H, CH3O), 3.93 (s, 3 H, CH3O), 2.38―2.45 (m, 2 H, CH2), 1.47―1.51 (m, 2 H, CH2), 1.33―1.36 (m, 4 H, 2CH2), 0.89 (t, J=6.9 Hz, 3 H, CH3). EI-MS m/z 276 (M+).3 Results and discussionInitially, we tested the reaction of 2-iodobenzoic acid (1a) with 1-heptyne (2a) under the catalysis of CuI/ trans-4-hydroxy-L-proline by using K2CO3 as base and DMSO as solvent at 90℃(Scheme 1). Desired isocou- marin 3a was isolated in 55% yield. Further attempts indicated that a better yield (70%) could be obtained in the absence of the ligand. In this case other solvents1618WANG LeiLei et al. Sci China Ser B-Chem | Oct. 2009 | vol. 52 | no. 10 | 1616-1621WANG LeiLei et al. Sci China Ser B-Chem | Oct. 2009 | vol. 52 | no. 10 | 1616-1621 1619cyclization products (Table 1, entry 1). The ratio is about 1:0.42 in favor to 6-endo cyclization product. Decre- asing the reaction temperature gave a higher yield while still providing a mixture in a ratio of 1:0.32 (entry 2). Dramatically, when trans -4-hydroxy-L-proline was in- troduced into the reaction system, single isocoumarin 3bwas obtained at different reaction temperatures, although the yields (entries 3―5) decreased to 60%―78%. This reaction process took place even at room temperature(entry 6). In this case low conversion was observed and a mixture of 5-exo and 6-endo cyclization products in aratio of 2.14:1 was obtained. These results demonstrated that substrates, ligands, and reaction temperature havegreat influence on the reaction process.Scheme 1 such as DMF, toluene, EtOH, and dioxane or base (Cs 2CO 3) lead to low yields. It is notable that only 6-endo cyclization product 3a was detected.When we used the optimized reaction conditions to explore the reaction scope, we found that 3-methyl bu-tynyl-2-ol (2b ) gave a mixture of 5-exo and 6-endo Table 1 Effect of reaction conditions on the CuI/ligand-catalyzed cou-pling reaction of 2-halobenzoic acid with terminal alkyne a)When 2-bromobenzoic acid (1b ) was used as a sub-strate, the reaction proceeded smoothly under the cata- lytic system of CuI/trans -4-hydroxy-L-proline, affording single isocoumarin 3b in 79% yield (entry 7). However, in the absence of ligands this reaction gave a mixture of 5-exo and 6-endo cyclization products in low combination yield (entry 8). For additives examined, other amino ac-ids such as L-proline, piperidine-2- carboxylic acid, and picolinic acid gave the similar results (entries 9―11), while β-keto ester E gave a low yield (entry 12). At-tempts to increase or decrease the catalytic loadings failed to improve the results (entries 13 and 14). On thebasis of these studies, we chose to use 20 mol % CuI, 20mol % trans -4-hydroxy-L-proline, K 2CO 3 as base, andDMSO as solvent to run the coupling reaction with2-bromobenzoic acids.Entry X Additive Temp.(℃)Yield (%) b) 1 I ― 90 80(1:0.42) c)2 I ― 70 91(1:0.32) c)3 I A 90 604 I A 70 785 I A 50 626 I A r.t. 24(1:2.14) c)7 Br A 70 798 Br ― 70 13(1:0.35) c)9 Br B 70 7510 Br C 70 8311 Br D 70 7312 Br E 70 23(1:0.21) c)13dBr A 70 65 14e Br A 70 66 The optimized reaction conditions were then tested byvarying aryl bromides and 1-alkynes, and the results were summarized in Table 2. Various alkynes (2b ―2j ) with functional groups were available for this reaction process, leading to the corresponding isocoumarins in good yields (Table 2, entries 1―9). It was notable that dihydroartemidin 3d from 1-butyne could be convertedinto a series of natural isocoumarins via simple trans-formations (entry 3)[32]. In the case of phenylacetyleneas a substrate, the reaction gave a mixture of 3k and 4k(entry 10). This phenomenon is similar to that reportedby Pal [11]. Other 2-bromo benzoic acids with differentsubstituted groups provided isocoumarins in moderate to good yields (entries 11―18). However, 2-bromo-5-nitro benzoic acid and 6-bromo-2,3-dimethoxy benzoic acid tynyl-2-ol (1.5 mmol), CuI (20 mol%), additve (20 mol%), K 2CO 3 (2 mmol),DMSO (1 mL); b) isolated yield; c) the ratio of 3 and 4; d) 10 mol% ofCuI was used; e) 40 mol% of A was used.Table 2 The assembly of isocoumarins via the CuI/ligand-catalyzed cascade processa)Entry 2-Bromo benzoic acidRProduct Yield (%) b)2 3 4 5 6 7 8 9101b511C 4H 8COOEt (2c ) C 4H 9 (2d ) CH 2OH (2e ) CH 2OBn (2f )CH 2NHCOOMe (2g ) CH(OH)C 2H 5 (2h ) CH(OH)C 5H 11 (2i ) CH 2Ph (2j ) Ph (2k ) 3c 3d 3e 3f 3g 3h 3i 3j 3k + 4k82 85 68 66 78 73 68 7154 (1:0.48) c)11 12 131c 2d 2b 2c 3l 3m 3n 85 75 8214 151d2d 2b 3o 3p 73 7216 171e 2d3q69181f2b 2d 3r 3s 7766191g 2b3t 13201h 2d3u23(14 d))Reaction conditions: a) 2-bromo benzoic acid 1 (1.0 mmol), alkyne 2 (1.5 mmol), CuI (20 mol %), trans -4-hydroxy-L-proline (20 mol %), K 2CO 3 (2 mmol), DMSO (1 mL), 70℃, 12h; b) isolated yield; c) the ratio of 3k and 4k ; d) 4u was isolated.gave low yields (entries 19 and 20).4 ConclusionsIn conclusion, we have developed a simple and inexpen- sive method to assemble substituted isocoumarins. It is possible to introduce diverse functional groups by using substituted aryl bromides and 1-alkynes. Thus, this method may find applications in organic synthesis.1 Engelmeier D, Hadacek F, Hofer O, Lutz-Kutschera G , Nagl M, WurzG , Greger H. Antifungal 3-butylisocoumarins from asteraceae-an- themideae. J Nat Prod, 2004, 67: 19―25 [DOI]2 Zhang W, Krohn K, Draeger S, Schulz B. Bioactive isocoumarinsisolated from the endophytic fungus Microdochium bolleyi . J Nat Prod, 2008, 71: 1078―1081[DOI]3 Kurume A, Kamata Y , Yamashita M, Wang Q, Matsuda H, YoshikawaM, Kawasaki I, Ohta S. Synthesis of 3-substituted isocoumarins and their inhibitory effects on degranulation of RBL-2H3 cells induced by antigen. Chem Pharm Bull, 2008, 56: 1264―1269[DOI]4 Sappapan R, Sommit D, Ngamrojanavanich N, Pengpreecha S, Wi-yakrutta S, Sriubolmas N, Pudhom K. 11-Hydroxymonocerin from the plant endophytic fungus Exserohilum rostratum . J Nat Prod, 2008, 71: 1657―1659[DOI]5 Zhang H, Matsuda H, Kumahara A, Ito Y , Nakamura S, YoshikawaM. New type of anti-diabetic compounds from the processed leaves of Hydrangea macrophylla var thunbergii (hydrangeae dulcis folium). Bioorg Med Chem Lett, 2007, 17: 4972―4976[DOI]6 Shibano M, Naito H, Taniguchi M, Wang N H, Baba K. Two iso-coumarins from pleurospermum angelicoide s . Chem Pharm Bull, 2006, 54: 717―718. [DOI]7 Angelis M D, Stossi F, Waibel M, Katzenellenbogen B S, Katzenel-1620 WANG LeiLei et al. Sci China Ser B-Chem | Oct. 2009 | vol. 52 | no. 10 | 1616-1621lenbogen J A. Isocoumarins as estrogen receptor beta selective ligands: Isomers of isoflavone phytoestrogens and their metabolites.Bioorg Med Chem, 2005, 13: 6529―6542[DOI]8 Kawano T, Agata N, Kharbanda S, Avigan D, Kufe D. Cancerchemother. Pharmacol, 2007, 59: 329―335. [DOI]9 Azumi M, Ogawa K, Fujita T, Takeshita M, Yoshida R, Furumai T,Igarashi Y. Bacilosarcins A and B, novel bioactive isocoumarins with unusual heterocyclic cores from the marine-derived bacterium Ba-cillus subtilis. Tetrahedron, 2008, 64: 6420―6425[DOI]10 Izumi T, Nishimoto Y, Kohei K, Kasahara A. Palladium-catalyzedsynthesis of isocoumarin and 1-isoquinolinone derivatives. J Heterocyclic Chem, 1990, 27: 1419―1424[DOI]11 Subramanian V, Batchu V R, Barange D, Pal M. Synthesis of iso-coumarins via Pd/C-mediated reactions of o-iodobenzoic acid with terminal alkynes. J Org Chem, 2005, 70: 4778―4783[DOI]12 Liao H Y, Cheng C H. Synthesis of isocoumarins from o-iodobenzoicacid and terminal acetylenes mediated by palladium complexes and zinc chloride. J Org Chem, 1995, 60: 3711―3716[DOI]13 Mereyala H B, Pathuri G. Synthesis of 3-(glycosyloxymethyl) iso-coumarins and (S)-3-(glycosyloxymethyl)-3,4-dihydroisocoumarins by coupling of propargyl glycosides with 2-iodobenzoic acid medi-ated by palladium complex and zinc chloride. Synthesis, 2006, 17: 2944―2950[DOI]14 Kundu N G, Pal M. Synthesis of phthalides through palladium-cata-lysed heteroannulation of acetylenic compounds. J Chem Soc Chem Commun, 1993, 86―8815 Kundu N G, Pal M, Nandi B. Palladium-catalysed heteroannulationwith terminal alkynes: Synthesis of phthalides. J Chem Soc Pekin Trans 1, 1998, 561―56816 Woon E C Y, Dhami A, Mahon M F, Threadgill M D. 5-Nitroiso-coumarins from tandem Castro-Stephens coupling-6-endo-dig cy- clisation of 2-iodo-3-nitrobenzoic acid and arylethynes and ring- closure of methyl 2-alkynyl-3-nitrobenzoates with electrophiles.Tetrahedron, 2006, 62: 4829―4837[DOI]17 Zhou L, Jiang H F. Synthesis of phthalides via Pd/CNTs-catalyzed reac-tion of terminal alkynes and o-iodobenzoic acid under copper and ligand-free conditions. Tetrahedron Lett, 2007, 48: 8449―8452[DOI]18 Beletskaya I P, Cheprakov A V. Copper in cross-coupling reactions - Thepost-Ullmann chemistry. Coord Chem Rev, 2004, 248, 2337―2364[DOI] 19 Monnier F, Taillefer M. Catalytic C―C, C―N, and C―O Ull-mann-type coupling reactions: Copper makes a difference. AngewChem Int Ed, 2008, 47, 3096―3099 [DOI]20 Evano G, Blanchard N, Toumi M. Copper-mediated coupling reactionsand their applications in natural products and designed biomolecules synthesis. Chem Rev, 2008, 108, 3054―3131[DOI]21 Ma D. Cai Q. Copper/Amino Acid catalyzed cross-couplings of aryland vinyl halides with nucleophiles.Acc Chem Res, 2008, 41: 1450―1460 [DOI]22 Lu B, Ma D. Assembly of 3-acyloxindoles via CuI/L-proline-catalyzedintramolecular arylation of β-keto amides. Org Lett, 2006, 8: 6115―6118[DOI]23 Lu B, Wang B, Zhang Y, Ma D. CuI-catalyzed domino process to2,3-disubstituted benzofurans from 1-bromo-2-iodobenzenes and β-keto esters. J Org Chem, 2007, 72: 5337―5341[DOI]24 Zou B, Yuan Q, Ma D. Synthesis of 1,2-disubstituted benzimidazolesby a Cu-catalyzed cascade aryl amination/condensation process Angew. Chem., Int. Ed. 2007, 46: 2598―2601[DOI]25 Zou B, Yuan Q, Ma D. Cascade coupling/cyclization process toN-substituted 1,3-dihydrobenzimidazol-2-ones. Org Lett, 2007, 9: 4291―4294[DOI]26 Liu F, Ma D. Assembly of conjugated enynes and substituted in-doles via CuI/amino acid-catalyzed coupling of 1-alkynes with vinyl iodides and 2-bromotrifluoroacetanilides. J Org Chem, 2007, 72: 4844―4850[DOI]27 Chen Y, Xie X, Ma D. Facile access to polysubstituted indoles via acascade Cu-catalyzed arylation-Condensation process. J Org Chem, 2007, 72: 9329―9334[DOI]28 Chen Y, Wang Y, Sun Z, Ma D. Elaboration of 2-(trifluoromethyl)indoles via a cascade coupling/condensation/deacylation Process. Org Lett, 2008, 10: 625―628[DOI]29 Wang B, Lu B, Jiang Y, Zhang Y, Ma D. Assembly of isoquinolinesvia CuI-catalyzed coupling of β-keto esters and 2-halobenzylamines.Org. Lett. 2008, 10: 2761―2763 [DOI]30 Yuan Q, Ma D. A One-Pot Coupling/hydrolysis/condensation processto pyrrolo[1,2-a]quinoxaline. J Org Chem, 2008, 73: 5159―5162[DOI] 31 Ma D, Liu F.CuI-catalyzed coupling reaction of aryl halides withterminal alkynes in the absence of palladium and phosphine.Chem Comm, 2004, 1934―193532 Lutz-Kutschera G, Engelmeier D, Hadacek F, Werner A, Greger H,Hofer O. Synthesis of side chain substituted 3-butylisocoumarins and absolute configurations of natural isocoumarins from Artemisia.dracunculus. Mon Chem, 2003, 134: 1195―1206WANG LeiLei et al. Sci China Ser B-Chem | Oct. 2009 | vol. 52 | no. 10 | 1616-16211621。