人教版高中化学学案选修三2.3分子的性质学案2完美版
- 格式:pdf
- 大小:47.81 KB
- 文档页数:5


普通高中课程标准实验教科书—化学选修3人教版]第二课时复习]分子的极性判断标准,分子间作用力对物质性质的影响。
过渡]今天我们利用已学过的分子结构理论,继续研究物质的其它性质。
板书]四、溶解性讲述]物质相互溶解的性质十分复杂,有许多制约因素,如温度、压强等。
从分子结构的角度,存在“相似相溶”的规律。
蔗糖和氨易溶于水,难溶于四氯化碳;而萘和碘却易溶于四氯化碳,难溶于水。
如果分析溶质和溶剂的结构就可以知道原因了:蔗糖、氨、水是极性分子,而萘、碘、四氯化碳是非极性分子。
通过对许多实验的观察和研究,人们得出了一个经验性的“相似相溶”的规律:非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
板书]1、“相似相溶”的规律:非极性溶质一般能溶于非极性溶剂,极性溶质一般能溶于极性溶剂。
讲述]水是极性溶剂,根据“相似相溶”,极性溶质比非极性溶质在水中的溶解度大。
如果存在氢键,则溶剂和溶质之间的氢键作用力越大,溶解性越好。
相反,无氢键相互作用的溶质在有氢键的水中的溶解度就比较小。
板书]2、溶解度影响因素:溶剂的极性、溶剂和溶质之间的氢键作用、讲述]此外,“相似相溶”还适用于分子结构的相似性。
例如,乙醇的化学式为CH3CH20H,其中的一OH与水分子的一OH相近,因而乙醇能与水互溶;而戊醇CH3CH2CH2CH2CH20H中的烃基较大,其中的一OH跟水分子的一OH的相似因素小得多了,因而它在水中的溶解度明显减小。
板书] 分子结构的相似性。
强调]另外,如果遇到溶质与水发生化学反应的情况,如SO2与水发生反应生成亚硫酸,后者可溶于水,因此,将增加SO2的溶解度。
思考练习]1、比较NH3和CH4在水中的溶解度。
怎样用相似相溶规律理解它们的溶解度不同?2.为什么在日常生活中用有机溶剂(如乙酸乙酯等)溶解油漆而不用水?3、在一个小试管里放入一小粒碘晶体,加入约5mL蒸馏水,观察碘在水中的溶解性(若有不溶的碘,可将碘水溶液倾倒在另一个试管里继续下面的实验)。

第三节分子的性质【学习目标】1.认识并学会判断共价分子的极性和非极性。
知道“相似相溶”规则的实际应用。
2.知道分子间作用力的涵义、影响大小的因素及其对物质的状态等方面的影响。
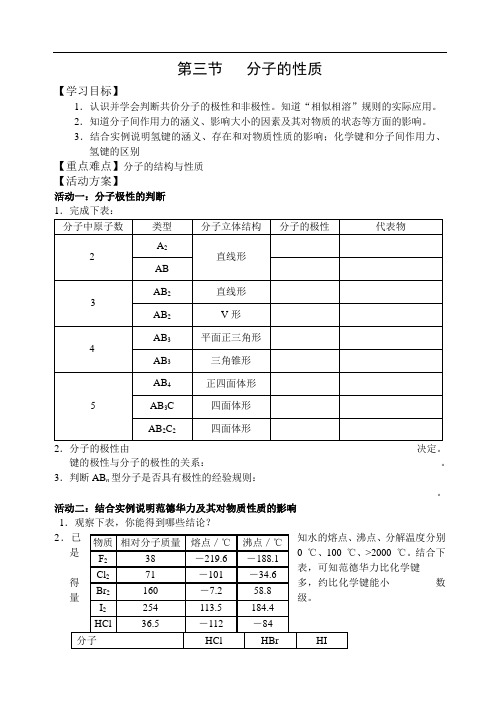
3.结合实例说明氢键的涵义、存在和对物质性质的影响;化学键和分子间作用力、氢键的区别【重点难点】分子的结构与性质【活动方案】活动一:分子极性的判断键的极性与分子的极性的关系:______________________________________________。
3.判断AB n型分子是否具有极性的经验规则:___________________________________ _________________________________________________________________________。
活动二:结合实例说明范德华力及其对物质性质的影响1.观察下表,你能得到哪些结论?2沸点、分解温度分别>2000 ℃。
结合下______________数范德华力(kJ/mol)21.14 23.11 26.00共价键的键能(kJ/mol)431.8 366 298.7观察下列给出的信息,结合你所获得的有关知识回答下列问题。
1.氢键⑴氢键是一种既可以存在于_________又可以存在于_____________作用力。
当H原子与_________________________ X以共价键结合时,X原子与H原子之间的共用电子对强烈_________________,使H原子几乎成了___________________。
这样的H原子能够跟另一______________________之间形成氢键。
能形成氢键的物质较多,如_____________________________________________________________________________________等。
⑵表示形式:通常用____________表示氢键(其中,X、Y为N、O、F等电负性很大半径.......较小..的原子)。

高考化学第二课时教学目标1、范德华力、氢键及其对物质性质的影响2、能举例说明化学键和分子间作用力的区别3、例举含有氢键的物质4、采用图表、比较、讨论、归纳、综合的方法进行教学5、培养学生分析、归纳、综合的能力教学重点分子间作用力、氢键及其对物质性质的影响教学难点分子间作用力、氢键及其对物质性质的影响教学过程[创设问题情景]气体在加压或降温时为什么会变成液体或固体?学生联系实际生活中的水的结冰、气体的液化,讨论、交流。
[结论]表明分子间存在着分子间作用力,且这种分子间作用力称为范德华力。
[思考与讨论]仔细观察教科书中表2-4,结合分子结构的特点和数据,能得出什么结论?[小结]分子的极性越大,范德华力越大。
[思考与交流]完成“学与问”,得出什么结论?[结论]结构相似时,相对分子质量越大,范德华力越大。
[过渡]你是否知道,常见的物质中,水是熔、沸点较高的液体之一?冰的密度比液态的水小?为了解释水的这些奇特性质,人们提出了氢键的概念。
[阅读、思考与归纳]学生阅读“三、氢键及其对物质性质的影响”,思考,归纳氢键的概念、本质及其对物质性质的影响。
[小结]氢键是除范德华力之外的另一种分子间作用力。
氢键是由已经与电负性很强的原子(如水分子中的氢)与另一个分子中电负性很强的原子(如水分子中的氧)之间的作用力。
氢键的存在大大加强了水分子之间的作用力,使水的熔、沸点教高。
[讲解]氢键不仅存在于分子之间,还存在于分子之内。
一个分子的X-H键与另一个分子的Y相结合而成的氢键,称为分子间氢键,如图2-34 一个分子的X-H键与它的内部的Y相结合而成的氢键称为分子内氢键,如图2-33 [阅读资料卡片]总结、归纳含有氢键的物质,了解各氢键的键能、键长。
[小结]本节主要是分子间作用力及其对物质性质的影响,氢键及其对物质性质的影响。
1.下列各组物质的晶体中,化学键类型相同,熔化时所克服的作用力也完全相同的是A.CO2和SiO2B.NaCl和HClC.(NH4)2CO3和CO(NH2)2D.NaH和KCl2.你认为下列说法不正确的是A.氢键存在于分子之间,不存在于分子之内B.对于组成和结构相似的分子,其范德华力随着相对分子质量的增大而增大C.NH3极易溶于水而CH4难溶于水的原因只是NH3是极性分子,CH4是非极性分子D.冰熔化时只破坏分子间作用力3.沸腾时只需克服范德华力的液体物质是A.水B.酒精C.溴D.水银4.下列物质中分子间能形成氢键的是A.N2 B.HBr C.NH3 D.H2S5.以下说法哪些是不正确的?(1) 氢键是化学键(2) 甲烷可与水形成氢键(3) 乙醇分子跟水分子之间存在范德华力⑷碘化氢的沸点比氯化氢的沸点高是由于碘化氢分子之间存在氢键6.乙醇(C2H5OH)和二甲醚(CH3OCH3)的化学组成均为C2H6O,但乙醇的沸点为78.5℃,而二甲醚的沸点为-23℃,为何原因?7.你认为水的哪些物理性质与氢键有关?试把你的结论与同学讨论交流。

分子的性质(第二课时)【学习目标叙写】1、范德华力、氢键及其对物质性质的影响2、能举例说明化学键和分子间作用力的区别3、例举含有氢键的物质【预习案】预习47页50页“二、三”,完成以下问题:一、范德华力及其对物质性质的影响1、概念:分子间作用力,分子之间存在着_________________,称为范德华力。
2、影响范德华力大小的因素(1) 结构相似的分子,相对分子质量越大,范德华力越_______。
(2) 分子的极性越大,范德华力越_____。
(3) 范德华力很弱,约比化学键小1~2数量级。
3、范德华力对物质性质的影响范德华力主要影响物质的物理性质,如熔、沸点。
范德华力越大,物质的熔、沸点越_______。
实验:(1)范德华力大小分子HCl HBr HI CO Ar范德华力21.14 23.11 26.00 8.75 8.50(kJ/mol)共价键键能431.8 366 298.7 745(kJ/mol)结论1:。
实验(2)范德华力与相对分子质量的关系:表格①分子HCl HBr HI相对分子质量范德华力21.14 23.11 26.00(kJ/mol)熔点/ºC -114.8 -98.5 -50.8沸点/ºC -84.9 -67 -35.4表格②结论2: 。
实验(3)范德华力与分子的极性的关系:分子 相对分子质量分子的极性熔点/ºC 沸点/ºC CO 28 -205.05 -191.49 N 228-210.00-195.81结论3: 。
二、氢键及其对物质性质的影响如图,非金属元素的氢化物在固态时是分子晶体,其熔沸点和其分子量有关.对于同一主族非金属元素而言,从上到下,分子量逐渐增大,熔沸点应逐渐升高.而HF 、H2O 、NH3却出现反常,为什么? 说明在HF 、H 2O 、NH 3分子间还存在除分子间作力之外其他作用.这种作用就是氢键。
1、概念:氢键是一种除范德华力外的另一种________________,它是由已经与电负性很________的原子(如N 、O 、F)形成共价键的_________,与另一个分子中电负性很__________的原子(如N 、O 、F)之间的作用单质 相对分子质量熔点/ºC 沸点/ºC F 2 -219.6 -188.1 Cl 2 -101.0 -34.6 Br 2 -7.2 58.8 I 2113.5184.4力。
第三课时教学目标1、从分子结构的角度,认识“相似相溶”规律。
2、了解“手性分子”在生命科学等方面的应用。
3、能用分子结构的知识解释无机含氧酸分子的酸性。
4、培养学生分析、归纳、综合的能力5、采用比较、讨论、归纳、总结的方法进行教学教学重点、难点手性分子和无机含氧酸分子的酸性教学过程[复习过渡]复习极性键非极性键,极性分子和非极性分子并举出常见的极性分子和非极性分子。
通过前面的学习我们知道碘易溶于四氯化碳而不易溶于水,氨和氯化氢易溶于水,这是为什么呢?[指导阅读]课本P52,让学生说出从分子结构的角度,物质相互溶解有那些规律?[学生得出结论]1、“相似相溶”规律:非极性物质一般易溶于非极性溶剂,极性溶质一般易溶于极性溶剂。
2、若存在氢键,溶质和溶剂之间的氢键作用力越大,溶解性越好。
3、若溶质遇水能反应将增加其在水中的溶解度[巩固练习]完成思考与交流[指导阅读]课本P53~54,了解什么叫手性异构体,什么叫手性分子,以及“手性分子在生命科学等方面的应用。
[设问]如何判断一个分子是手性分子呢?[学生思考并回答]有碳原子上连有四个不同的原子或基团。
[教师补充]我们把连有四个不同的原子或基团的碳原子叫手性碳原子[过渡]通过前面的学习,我们都知道硫酸的酸性强于亚硫酸,硝酸的酸性强于亚硝酸,这是为什么呢?[讲述]从表面上来看,对于同一种元素的含氧酸来说,该元素的化合价越高,其含氧酸的酸性越强,这与他们的结构有关含氧酸的通式(HO)m RO n,如果成酸元素R相同,则n越大,R的正电性越高,导致R-O-H中的O原子向R偏移,因而在水分子的作用下,也就容易电离出氢离子,即酸性越强。
如硫酸中n为2,亚硫酸中n为1,所以硫酸的酸性强于亚硫酸。
[巩固练习]1、把下列液体分别装在酸式滴定管中,并使其以细流流下,当用带有静点的玻璃棒接近液体细流时,细流可能发生偏转的是A 、四氯化碳B、乙醇 C 、二硫化碳D、苯2、根据“相似相溶”规律,你认为下列物质在水中溶解度较大的是A 、乙烯B 、二氧化碳C、二氧化硫D、氢气3、下列氯元素含氧酸酸性最强的是A、HClOB、HClO2C、HClO3 D、HClO44、下列物质中溶解度最小的是A、LiFB、NaFC、KFD、CsF5、模块学习评价(时间:90分钟分值:100分)一、选择题(每小题3分,共54分)1.下列叙述正确的是()A.容量瓶、滴定管、蒸馏烧瓶、量筒等仪器上都具体标明了使用温度B.冷浓硫酸保存在敞口的铅制的容器中C.为了使过滤速率加快,可用玻璃棒在过滤器中轻轻搅拌,加速液体流动D.KNO3晶体中含有少量NaCl,可利用重结晶的方法提纯【解析】蒸馏烧瓶没有规定使用温度;铅不能被冷浓硫酸钝化,铅制容器不能用来盛放浓硫酸;过滤时不能用玻璃棒搅拌。
优质资料---欢迎下载第二章分子结构与性质第三节分子的性质第1课时主备人:【学习目标】1.了解极性共价键和非极性共价键2.掌握判断分子的极性,并知道分子极性对物质性质的影响【教学过程】【知识点一】键的极性1.键的极性跟电负性有关———先回顾电负性(1)电负性——是描述不同元素原子对键合电子能力大小的物理量。
(2)电负性意义——电负性大小可衡量金属性、非金属性。
与性是一致的,即电负性越大,吸引电子(得电子)能力越,性越强,性越弱。
规律:同周期从左到右:金属性,非金属性,电负性;同主族自上而下:金属性,非金属性,电负性;2.共价键——原子间通过而形成的化学键。
根据共用电子对是否发生偏移,将共价键分为极性键和非极性键。
(1)极性键:在原子间形成的共价键,由于不同原子的电负性不同,共用电子对偏移,偏向于电负性大的原子一边,该原子呈电性(δ-),电负性小的原子呈电性(δ+);(2)非极性键:在原子间形成的共价键,由于相同原子的电负性相同,共用电子对偏移。
【总结】判断极性键和非极性键的方法:①同种原子间形成的共价键是非极性键,A—A型。
例如:H—H、C=C、N≡N②不同种原子间形成的共价键是极性键,A—B型。
例如:H—Cl、H—N、B—F【规律】共用电子对偏向于电负性较大的原子,显负价,且电负性相差越大,共价键的极性越强。
【马上体验】1.下列物质中,含有非极性共价键的化合物是()A.Na2O2B.Cl2 C.Na2SO4D.BF32.下列共价键中,极性最强的是()A.H-F B.H-Cl C.H-Br D.H-I【知识点二】分子的极性1.分子的“正电荷中心”、“负电荷中心”的概念(1)分子中正电荷的作用集中于一点上,是正电荷中心。
(2)分子中负电荷的作用集中于一点上,是负电荷中心。
2.极性分子和非极性分子(1)正电荷中心和负电荷中心的分子,使分子的某一个部分呈正电性(δ+),另一部分呈负电性(δ-),叫极性分子。
第二章第三节第二课时分子间作用力
学习目标:1.知道范德华力、氢键及其对物质性质的影响
2、能举例说明化学键和分子间作用力的区别,例举含有氢键的物质
重点、难点:分子间作用力、氢键及其对物质性质的影响
教学模式:“三五五”教学模式教学资源:多媒体等
Ⅰ、课前:
预案:
一、范德华力及其对物质性质的影响
1、概念:分子间作用力,分子之间存在着___________________,称为范德华力。
2、影响范德华力大小的因素
(1) 结构相似的分子,相对分子质量越大,范德华力越_______。
(2) 分子的极性越大,范德华力越_____。
(3) 范德华力很弱,约比化学键小1~2数量级。
3、范德华力对物质性质的影响
范德华力主要影响物质的物理性质,如熔、沸点。
范德华力越大,物质的熔、沸点越_______。
二、氢键及其对物质性质的影响
1、概念:氢键是一种除范德华力外的另一种________________,它是由已经与电负性很
________的原子(如N、O、F)形成共价键的_________,与另一个分子中电负性很
__________的原子(如N、O、F)之间的作用力。
2、氢键对物质性质的影响
氢键_________化学键,是一种分子间作用力。
氢键键能较小,约为________的十分之几,但比____________强。
氢键不仅存在于分子,有时也存在于分子。
(1) 分子间氢键,使物质的熔、沸点_____________。
(2) 分子内氢键,使物质的熔、沸点_____________。
3、表示方法
氢键通常用A—H…B表示,其中A、B为____、O、____原子,“—”表示_______,“…”表示_______。
4、水中的氢键对水的性质的性质
(1)水分子间形成氢键,了水分子间的作用力,使水的熔沸点比H2S
(2)氢键与水分子的性质
①水结冰时,体积,密度;
②接近沸点时形成“缔合”分子,水蒸气的相对分子质量比用化学式H2O计算出来的相对
分子质量。
疑惑记录:
Ⅱ、课中:
【学情调查情景导入】
将下列物质分类:
①H2、②O2、③HCl、④C60、⑤CO2、⑥HCN、⑦H2O、⑧NH3、⑨BF3、⑩CH4、○11CH3Cl
属于非极性分子的是___________________ ,属于极性分子的是___________________ 【问题展示合作探究】
1、范德华力与相对分子质量的关系:
单质相对分子质量熔点/oC沸点/oC
F2-219.6 -188.1
Cl2-101.0 -34.6
Br2-7.2 58.8
I2113.5 184.4 结论1:。
2、范德华力与分子的极性的关系:
分子相对分子质量分子的极性熔点/oC沸点/oC
CO 28 -205.05 -191. 49
N228 -210.00 -195. 81 结论2:。
3、氢键是否属于“化学键”?它与化学键、分子间作用力(范德华力)有什么关系?
从 4、下面这张图中你得到什么信息?怎样用学过的知识解释?
【达标检测巩固提升】
A级
1.下列物质发生变化时,所克服的粒子间相互作用属于同种类型的是()A.液溴和苯分别受热变为气体 B.干冰和氯化铵分别受热变为气体
C.二氧化硅和铁分别受热熔化 D.食盐和葡萄糖分别溶解在水中
2.干冰熔点很低是由于()。
A.CO2是非极性分子 B.C=O键的键能很小
C.CO2化学性质不活泼 D.CO2分子间的作用力较弱
3.下列物质中分子间能形成氢键的是()
A.N2 B.HBr C.NH3 D.H2S
4.下列事实与氢键有关的是( )
A.水加热到很高的温度都难以分解
B.水结成冰体积膨胀,密度变小
C.CH4、SiH4、GeH4、SnH4熔点随相对分子质量增大而升高
D.HF、HCl、HBr、HI的热稳定性依次减弱
5.你认为下列说法不正确的是()
A.氢键存在于分子之间,不存在于分子之内
B.对于组成和结构相似的分子,其范德华力随着相对分子质量的增大而增大
C.NH3极易溶于水而CH4难溶于水的原因只是NH3是极性分子,CH4是非极性分子 D.冰熔化时只破坏分子间作用力
B级
1.下列说法正确的是( )
A.含有极性键的分子一定是极性分子
B.范德华力就是分子间的万有引力
C.氢键就是氢原子和其他原子形成的化学键
D.氢键的作用力大小介于范德华力和化学键之间
2.H2O分子内的O-H键、分子间的范德华力和氢键从强到弱依次为。
3.下列物质的沸点,从高到低的顺序正确的是()
A.HI>HBr>HCl>HF B.CI4>CBr4>CCl4>CF4
C.N2> CO D.F2>Cl2>Br2>I2
C级
乙醇(C2H5OH)和二甲醚(CH3OCH3)的化学组成均为C2H6O,但乙醇的沸点为78.5℃,而二甲醚的沸点为-23℃,为何原因?
【知识梳理归纳总结】
收获
疑惑
【预习指导新课链接】
物质的溶解性、分子的手性、无机含氧酸分子的酸性有哪些规律?
Ⅲ、课后:
1.课后反思
2.预习《分子的极性与物质性之间的关系》
不论何时,都要尽可能让思考与反省预见到突发的激情,这于审慎者可轻而易举做到。
心烦意乱之时,首先要做的就是意识到这一点。
先控制住自己的情绪,下决心不再使之加剧。
有了这种
高明的防范,就能很快终止怒气。
要懂得制怒之法,且止息于当止之时:奔跑时停下来最难;狂怒时保持头脑清醒也一样难。
过分激动,不论程度高低,都会影响理智。
一旦对发怒有了这种
警醒,就不会使你因怒气而失控,也不会使你损害良好的辨别力。
谨慎地驾驭情绪,就能很好地控制它。
你将是马背上第一个理智的人。
智者最没有耐性,因为学识减少了他们的耐心。
知识渊博的人很难被取悦。
俄庀泰特斯告诉我们,生活最重要的准则在于懂得如何忍受一切。
他认为这是智慧的一半真谛。
容忍愚蠢需要极大的耐心。
有时最令我们痛苦的人正是我们最依赖的人,这帮助我们战胜自我。
耐心能带来无可估量的内心平静;而内心平静是世间的福祉。
不懂得如何容忍他人的人如果还能忍受他自己的话,就应当独处。