盐酸右美托咪定质量标准
- 格式:doc
- 大小:30.00 KB
- 文档页数:2


1.右美托咪定可否加入镇痛泵中使用?可以将术中没有用完的右美托咪定直接加到术后镇痛泵中,避免浪费,也可将200口g 右美托咪定配于50ml的镇痛泵中,0.4口g/kg/h持续泵注(成人),可持续10小时。
2.右美托咪定出现低血压怎么办?应补足血容量后再使用。
(严重心室功能不全的(III度及以上的)和严重心室功能不全的患者慎用)视情况依次:减少或停止本品输注加快静脉输液速度抬高下肢使用麻黄碱(25~50mg)或多巴胺3.右美托咪定出现心动过缓如何处理?(心率低于40)过高剂量右美托咪定或输注速度过快;可视情况依次:减少或停止本品输注加快静脉输液速度抬高下肢使用阿托品(0.5mg~1mg)4.使用右美托咪定苏醒延迟如何处理?降低麻醉剂、镇静剂、催眠剂、阿片类药物的剂量(在达到Ramsay(拉姆齐)评分三3或警觉/镇静评分OAA/SW4时,给与患者刺激,部分患者可以被唤醒并出现警觉,在没有其他临床症状下,此时并非苏醒延迟)5.在使用七氟烷艾斯康等麻醉药、肌松药时,一般减少多少量?协同作用,需减少剂量。
在达到同等镇静程度时,血药浓度为0.7ng/mL,七氟烷的MAC值下降20%左右;在达到同等镇静程度时可减少30%以上丙泊酚的剂量;术后同等疼痛评分条件下,吗啡用量减少30%左右。
6.右美托咪定在应用于不同年龄阶段的患者时,剂量有何不同?在国内正常成人患者的剂量比国外患者要低蒙古人种负荷剂量在0.6~0.8口g/kg较合适,维持剂量在0.1~0.5口g/kg/hr较合适;大于65岁的老年人,剂量减少30%~50%。
对于18岁以下的人群,其安全性和有效性尚不明确。
国内最新研究显示,在2~3岁患儿中,负荷剂量0.5口g/kg是安全有效的。
7.不给负荷剂量对药效影响是怎样的?按说明书标准用法、在需要快速起效的情况下,需给予负荷量。
如临床无快速起效的需要,可直接使用维持剂量,可减少部分敏感患者血压心率波动的发生率。

盐酸右美托咪定目录基本信息性状适应症规格用法用量不良反应禁忌注意事项编辑本段基本信息盐酸右美托嘧啶是α2-肾上腺素受体激动剂,其化学名为:(+)-4-(S)-[1-(2,3-二甲基苯基)乙基]-1H-咪唑盐酸盐。
分子式:C13H16N2?HCl 分子量:236.7 【通用名称】盐酸右美托嘧啶注射液【商品名称】艾贝宁英文名称:Dexmedetomidine Hydrochloride Injection 汉语拼音:Yansuan Youmeituomiding Zhusheye 【成份】本品主要成份为盐酸右美托嘧啶,其化学名为:(+)-4-(S)-[1-(2,3-二甲基苯基)乙基]-1H-咪唑盐酸盐。
分子式:C13H16N2?HCl 分子量:236.7 本品辅料为氯化钠。
编辑本段性状本品为无色或几乎无色的澄明液体。
编辑本段适应症用于行全身麻醉的手术患者气管插管和机械通气时的镇静。
编辑本段规格2ml?200ug(按右美托咪定计)编辑本段用法用量成人剂量:配成4ug /ml浓度以1ug/kg剂量缓慢静注,输注时间超过10分钟。
本品在给药前必须用0.9%的氯化钠溶液稀释达浓度4ug /ml,可取出2mL本品加入48ml0.9%的氯化钠注射液中形成总的50ml溶液,轻轻摇动使均匀混合。
操作过程中必须始终维持严格的无菌技术。
一般地,静脉用药前应该肉眼检查药品有无颗粒物质和颜色是否改变。
剂量调整: 由于可能的药效学相互作用,当本品与其他麻醉剂、镇静剂、安眠药或阿片类药物同时给药时可能需要减少给药剂量(见药物相互作用)。
肝、肾功能损伤的患者和老年患者可能需要考虑减少给药剂量。
药品相容性: 因为物理相容性尚不确定,本品不应与血液或血浆通过同一静脉导管同时给予。
当本品与以下药物同时给予时显示不相容:两性霉素B,地西泮。
当本品与以下静脉液体和药物同时给予时已经显示了相容性:0.9%的氯化钠水溶液,5%的葡萄糖水溶液。

盐酸右美托咪定的理化特性、药效学及临床应用(综述)摘要:盐酸右美托咪定是 2-肾上腺素受体激动剂,可作为手术患者气管插管及机械通气时的镇静药物。
临床应用中,为提升临床用药安全,发挥用药效果,需根据盐酸右美托咪定的理化特性、药效学调整药物应用,才可确保用药安全。
本文综述盐酸右美托咪定的理化特性、药效学及临床应用问题。
关键词:理化特性;临床;盐酸右美托咪定;药效学引言盐酸右美托咪定作为一种麻醉辅助药,可明显减少麻醉药和阿片类药用量,减轻气管插管及外科手术刺激的血流动力学反应,降低眼内压,减少麻醉恢复期激动和恶心,发挥临床应用价值【1-4】。
研究盐酸右美托咪定的理化特性、药效学,有助于进一步提升临床应用盐酸右美托咪定的安全性。
具体综述内容如下:1 盐酸右美托咪定药物临床中,盐酸右美托咪定作为相对选择性 2-肾上腺素受体的激动剂,可以发挥对人体的镇静、抗焦虑作用,同时也可以发挥催眠、镇痛的作用【5】。
故此,在临床疾病治疗中常将盐酸右美托咪定,用于麻醉镇静。
2 盐酸右美托咪定的理化特性对于盐酸右美托咪定药物,在理化特性研究中证实,其属异吡唑亚类的激动剂,同可乐定相似,可以完全溶解于水。
盐酸右美托咪定也是美托咪定D-对映异构体, 盐酸右美托咪定相对分子质量为236.7,化学分子式则为C13H16N2?HCI【6】。
并且,盐酸右美托咪定的酸度系数达到7.1 pKa;在pH7.4水中,盐酸右美托咪定的分配系数是2.89。
3 盐酸右美托咪定药效学3.1线性表现盐酸右美托咪定对 2-受体呈高特异性结合,可抑制去甲肾上腺素释放,削弱对血管收缩【7】。
静脉注射后,盐酸右美托咪定的药动学参数,可表现出线性变化趋势,盐酸右美托咪定具有快速分布相,药物临床半衰期是6 min,终端消除的半衰期是2 h,血浆消除速率达到39 L?h-1。
3.2生物转化在临床中,应用盐酸右美托咪定药物,几乎可以完全实现生物转化,能够直接实现葡萄糖醛酸化【8-11】。
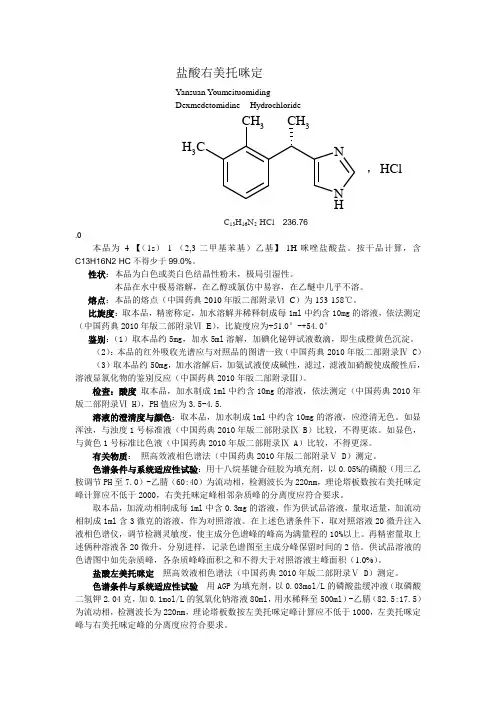
盐酸右美托咪定Yansuan YoumeituomidingDexmedetomidine HydrochlorideNH NCH 3C H 3CH 3C 13H 16N 2·HCl 236.76.0本品为4-【(1s )-1-(2,3-二甲基苯基)乙基】-1H-咪唑盐酸盐。
按干品计算,含C13H16N2·HC 不得少于99.0%。
性状:本品为白色或类白色结晶性粉末,极局引湿性。
本品在水中极易溶解,在乙醇或氯仿中易容,在乙醚中几乎不溶。
熔点:本品的熔点(中国药典2010年版二部附录Ⅵ C )为153-158℃。
比旋度:取本品,精密称定,加水溶解并稀释制成每1ml 中约含10mg 的溶液,依法测定(中国药典2010年版二部附录Ⅵ E ),比旋度应为+51.0°-+54.0°鉴别:(1)取本品约5mg ,加水5ml 溶解,加碘化铋钾试液数滴,即生成橙黄色沉淀。
(2):本品的红外吸收光谱应与对照品的图谱一致(中国药典2010年版二部附录Ⅳ C )(3)取本品约50mg ,加水溶解后,加氨试液使成碱性,滤过,滤液加硝酸使成酸性后,溶液显氯化物的鉴别反应(中国药典2010年版二部附录Ⅲ)。
检查:酸度 取本品,加水制成1ml 中约含10mg 的溶液,依法测定(中国药典2010年版二部附录Ⅵ H ),PH 值应为3.5-4.5.溶液的澄清度与颜色:取本品,加水制成1ml 中约含10mg 的溶液,应澄清无色。
如显浑浊,与浊度1号标准液(中国药典2010年版二部附录Ⅸ B )比较,不得更浓。
如显色,与黄色1号标准比色液(中国药典2010年版二部附录Ⅸ A )比较,不得更深。
有关物质: 照高效液相色谱法(中国药典2010年版二部附录Ⅴ D )测定。
色谱条件与系统适应性试验:用十八烷基键合硅胶为填充剂,以0.05%的磷酸(用三乙胺调节PH 至7.0)-乙腈(60:40)为流动相,检测波长为220nm ,理论塔板数按右美托咪定峰计算应不低于2000,右美托咪定峰相邻杂质峰的分离度应符合要求。

艾贝宁——右美托咪定详细说明书-CAL-FENGHAI.-(YICAI)-Company One1【药品名称】通用名称:盐酸右美托咪定注射液商品名称:艾贝宁英文名称:Dexmedetomidine Hydrochloride Injection汉语拼音:Yansuan Youmeituomiding Zhusheye【成份】本品主要成份为盐酸右美托咪定,其化学名为:(+)-4-(S)-[1-(2,3-二甲基苯基)乙基]-1H-咪唑盐酸盐。
分子式:C13H16N2·HCl分子量:本品辅料为氯化钠。
【性状】本品为无色或几乎无色的澄明液体。
【适应症】用于行全身麻醉的手术患者气管插管和机械通气时的镇静。
【规格】2ml∶200ug(按右美托咪定计)【用法用量】成人剂量:配成4ug /ml浓度以1ug/kg剂量缓慢静注,输注时间超过10分钟。
本品在给药前必须用%的氯化钠溶液稀释达浓度4ug /ml,可取出2mL本品加入%的氯化钠注射液中形成总的50ml溶液,轻轻摇动使均匀混合。
操作过程中必须始终维持严格的无菌技术。
一般地,静脉用药前应该肉眼检查药品有无颗粒物质和颜色是否改变。
剂量调整:由于可能的药效学相互作用,当本品与其他麻醉剂、镇静剂、安眠药或阿片类药物同时给药时可能需要减少给药剂量(见药物相互作用)。
肝、肾功能损伤的患者和老年患者可能需要考虑减少给药剂量。
药品相容性:因为物理相容性尚不确定,本品不应与血液或血浆通过同一静脉导管同时给予。
当本品与以下药物同时给予时显示不相容:两性霉素B,地西泮。
当本品与以下静脉液体和药物同时给予时已经显示了相容性:%的氯化钠水溶液,5%的葡萄糖水溶液。
已经证实一些类型的天然橡胶可能吸收本品,建议使用合成的或有涂层的橡胶垫给药装置。
【不良反应】由于临床试验是在多种不同情况下进行的,因此一种药物在临床试验中观察到的不良反应发生率不能与另一种药物进行直接比较,而且可能无法反映实际临床应用中观察到的不良反应情况。
![盐酸右美托咪定的药理作用与临床应用[1]](https://uimg.taocdn.com/e4391238b5daa58da0116c175f0e7cd184251860.webp)
盐酸右美托咪定的药理作用与临床应用裴 皓(湖北省新华医院麻醉科,武汉 430015)[摘 要] 盐酸右美托咪定是一种相对选择性α2肾上腺素能激动药,具有镇静、抗焦虑、催眠、镇痛和交感神经阻滞作用,可有效减少患者对阿片类药、苯二氮类药和丙泊酚的需要量。
该文对其理化特性、药动学、药效学以及临床应用进行了概述。
[关键词] 右美托咪定,盐酸;药理作用;临床应用[中图分类号] R971.93;R969 [文献标识码] A [文章编号] 1004-0781(2010)12-1603-05 盐酸右美托咪定是一种相对选择性α2受体激动药,有镇静、抗焦虑、催眠、镇痛和交感神经阻滞作用。
盐酸右美托咪定在1999年被美国食品药品管理局(F DA)批准用于成人重症监护病房(I CU)机械通气患者短期镇静。
目前,美国和欧洲国家已开始将盐酸右美托咪定使用到I CU以外科室,包括神经外科、儿科、心血管外科纤维支气管镜和治疗肥胖手术等。
目前此药已在我国临床使用,笔者主要就盐酸右美托咪定的药理作用和临床应用作一综述,以期为临床应用提供参考。
1 理化特性 盐酸右美托咪定是美托咪定的D2对映异构体,相对分子质量236.7,化学分子式C13H16N2·HCl。
其酸度系数(pKa)为7.1,在pH7.4的水中其分配系数为2.89。
盐酸右美托咪定属于异吡唑亚类α2受体激动药,与可乐定相似,能完全溶解于水。
2 药动学 静脉注射后,盐酸右美托咪定的药动学参数如下:有一个快速分布相,半衰期约6m in,终端消除半衰期约2h,其稳态分布容积(VSS)约118L,血浆消除速率约为39L·h21。
盐酸右美托咪定以0.2~0.7μg·kg21·h21速率静脉用药24h呈线性药动学。
盐酸右美托咪定蛋白结合率在男性和女性相似,正常健康男女受试者血浆中,蛋白结合率平均为94%。
在肝损害受试者中盐酸右美托咪定与血浆蛋白结合率较健康人群明显下降。


盐酸右美托咪定注射液的工艺质量改进研究摘要:小分子化学仿制药,这两年各家企业陆续开展一致性评价工作。
HT公司在研项目盐酸右美托米定注射液为公司重点开发项目,属于外购的老工艺产品,公司开展了该产品的一致性评价研究工作。
主要对其工艺过程质量进行变更改进研究,通过工艺及质量控制点的改进,产品生产周期明显缩短,工艺重现性明显升高,质量控制点减少,质量风险明显降低。
背景:该项目是外购的产品工艺,大致的配制流程为在浓配罐中加入药液处方总量约10%的注射用水(60℃以下);预溶盐酸右美托咪定,溶解后,药液全部转移至浓配罐中,搅拌,往上述浓配药液中加入溶液量0.01%(W/V)活性炭吸附约20分钟后,用钛棒脱炭,滤液转移至稀配罐。
在浓配罐中加入处方总量约20%的注射用水(60℃以下),加入处方量的氯化钠,搅拌≥10分钟使溶解完全,加入氯化钠溶液体积量的0.1%(W/V)活性炭吸附约20分钟后,用钛棒脱炭,滤液转移至稀配罐。
用药液处方总量约10%的注射用水洗涤,分次荡洗浓配罐,荡洗液经钛棒过滤,全部转移至稀配罐。
往稀配罐中补加注射用水至处方全量,搅拌≥10分钟。
经0.45μm的滤器对药液进行初滤,取样检测含量,符合要求后,进行除菌过滤灌封。
该老工艺的最大缺点是产品在浓配时因活性炭吸附作用差异性较大,导致定容后的含量有可能偏差过大。
但该产品在早些年按该老工艺进行了申报注册,后来收到发补回复,本人对该产品的配制和灌封工艺进行了细化,主要是为了工艺描述不清晰、批间含量均一性差和质量控制点较少的问题。
细化后的工艺为在浓配罐中加入药液处方总量约10%的注射用水(60℃以下);取适量注射用水将处方量的盐酸右美托咪定预溶,目测原料药全部溶解后,药液全部转移至浓配罐中,搅拌≥20分钟使溶解均匀。
往上述浓配药液中加入溶液量0.01%(W/V)活性炭(供注射用)(事先可用适量注射用水润湿)吸附约20分钟后,用钛棒脱炭,滤液转移至稀配罐。

盐酸右美托咪定注射液停搏。
有报道血压过低和心动过缓与本品灌输有关。
如果需要医药救治,治疗可能包括减少或停止本品输注,增加静脉液体的流速,抬高下肢,以及使用升高血压的药物。
因为本品有可能加剧迷走神经刺激引起的心动过缓,临床医生应该做好干预的准备。
应该考虑静脉给予抗胆碱能药物(例如,格隆溴铵、阿托品)来减轻迷走神经的紧张性。
在临床试验中,阿托品或格隆溴铵在治疗本品引起的大多数心动过缓事件中有效。
然而,在一些有明显的心血管功能不良的患者中,要求更进一步的急救手段。
当对有晚期心脏传导阻滞和/或严重的心室功能不全的患者给予本品时应该小心谨慎。
因为本品降低了交感神经系统活性,在血容量过低、糖尿病或慢性高血压以及老年患者中可能预期会发生更多的血压过低和/或心动过缓。
当给予其他血管扩张剂或负性频率作用药物时,同时给予本品可能有附加的药效影响,应该谨慎给药。
暂时性高血压出现暂时性高血压主要在负荷剂量期间观察到,与本品的外围血管收缩作用有关。
暂时性高血压通常不需要治疗,然而降低负荷输注速度可能是理想的。
觉醒力一些给予本品的患者当受到刺激时可观察到是觉醒的和警觉的。
在没有其他临床体征和症状的情况下,仅此一项不应该被认为是缺乏疗效的证据。
停药症状重症监护室的镇静:如果本品给药超过24小时并且突然停止,可能导致与报道的另一种α2肾上腺素药可乐定相似的停药症状。
这些症状包括紧张、激动和头疼,伴随或跟随着血压迅速的升高和血浆中儿茶酚胺浓度的升高。
程序镇静:短期输注本品(<6小时)停药后未出现停药症状。
肝脏损伤由于右美托咪定的清除率随着肝脏损伤的严重程度下降,对于肝脏功能损伤的患者应该考虑降低剂量。
依赖性右美托咪定在人体中的潜在依赖性还没有研究。
然而,由于在啮齿动物和灵长类动物中的研究已经证明右美托咪定与可乐定具有相似的药理学作用,突然中止本品可能产生可乐定样的停药症状。
【孕妇及哺乳期妇女用药】在孕妇未进行充分良好的临床研究。

新型镇痛药盐酸右美托咪啶手术中、后患者的镇静和镇痛一直是手术中的重要一环。
病人烦躁激动的发生对治疗和手术都会产生严重影响,且在重症患者中发生率高,发生的原因也很复杂,包括疾病本身、镇痛不全、环境的变化所引起的不适等。
该类患者往往夸大的抱怨疼痛,通常不能配合护理人员,血压升高,呼吸心率增快,产生缺血症状,代谢率增加导致全身的氧耗增加,热量需求增加,呼吸频率加快等。
因此,不管是手术前中后还是治疗期间,镇静都是必需的,均有利于手术的进行和术后的监护和治疗。
目前国内外常用于临床镇静药物主要包括阿片类药物、苯二氮卓类药物、氟哌定醇、异丙酚和盐酸右美托咪定。
1、盐酸右美托咪啶的药理学研究盐酸右美托咪定的化学名是(+)- 4-(S)- [1-(2,3一二甲基苯基)乙基]- 1H- 咪唑单盐酸盐。
其分子式为C13H16N2·HCl。
盐酸右美托咪定的化学结构式见图1-1。
N3图1-1 盐酸右美托咪定的化学结构式盐酸右美托咪定是一种高效、高选择性的α2-肾上腺素受体激动剂。
α2-肾上腺素受体广泛存在于中枢神经系统和外周神经、自主神经节中,经研究位于交感神经末梢的突触前α2-肾上腺素受体的兴奋,可抑制去肾上腺素的释放,中枢神经系统的α2激动剂可使突触后受体激活,降低交感活性,从而降低血压和心率。
交感神经传出作用降低,可引起麻醉药需要量减少。
盐酸右美托咪啶作为可乐定的同类药物,其α2:α1选择性比例则为1620:1,是纯的、强效α2受体激动剂,其对中枢神经系统的作用明显强于可乐定,适用于重症病人的镇静和镇痛。
可乐定镇痛和镇静的特性能减少手术中麻醉药物的用量,但是由于可乐定的半衰期较长,限制了它在手术中常规使用。
而盐酸右美托咪啶半衰期较短,且α2受体选择性高,因此在麻醉、镇静等过程中,大剂量使用盐酸右美托咪啶不会引起因激动α1受体而导致的血管反应,副作用相应减少。
另外盐酸右美托咪啶可以抑制应激刺激引起的血浆儿茶酚胺浓度升高,有利于围麻醉期血流动力学的稳定,包括抑制气管插管反应。
右美托咪定:值得期待的重症监护病房的镇静药右美托咪定(medetomidine)是一种新型肾上腺素α2受体激动药,其具有強效、高选择性的特点,不仅可以有效地保持镇定,而且兼具镇痛的作用,并且保证患者陷入昏迷、随时可被唤醒,其药物对的血流动力学可以被有效预见,且不会引起呼吸抑制。
正是因为这些显著的优点,使得右美托咪定在当今临床实践中被作为重症监护病房的首选镇静药物。
本文结合相关理论研究和临床实践,对右美托咪定的使用进行综述。
标签:右美托咪定;镇静药;重症监护病房在临床实践中,镇静药的应用十分广泛,具体到重症监护病房而言,基于其患者的特殊性,导致对于镇静剂的要求更为复杂、严格,最为理想的重症监护病房镇静药应当具有可随时唤醒、兼具镇痛和抗焦虑效果、不产生蓄积、不会影响血流动力学并无呼吸抑制现象、无恶心、呕吐等不良反应。
在长期的临床实践和医学发展中,尚无一种镇静药能够整体符合上述的要求和特点。
右美托咪定于2000年3月和2004年1月先后在美国、日本获得上市批准,获得了极为显著地效果,显现出其具备的高效、强选择性等特点,成为目前最为符合重症监护病房需要的镇静药。
1药物动力学作为美托咪定的活性右旋异构体,右美托咪定为无色、透明的等张液,是PH4.5~7.0的盐酸盐制剂。
在治疗的范围内,其清除率达到(0.53±s 0.14)L·Kg-1·h-1,分别有16%的口服生物利用率、82%的口内含化生物利用率和104%的肌肉注射生物利用率,其达峰时间分别为口内含化的1.5h和肌肉注射的1.0h。
值得注意的是,本要呈现高脂溶性,因此进行静脉注射时,其可以达到6min的快速分布半衰期,消除半衰期过程为2.0~2.5h,保持97±29的稳态分布容积[1]。
年龄和性别的差异对以上主要的药物动力学参数不会产生明显的影响,因此可以证明,不同性别、不同年龄的患者同样按照公斤体重进行药物注射后,可以得到相近的药物浓度。
盐酸右美托咪定注射液说明书【兽药名称】通用名称:盐酸右美托咪定注射液商品名称:瑞美静英文名称:Dexmedetomidine Hydrochloride Injection汉语拼音:Yansuan Youmeituomiding Zhusheye【主要成分】盐酸右美托咪定【性状】本品为无色澄明液体。
【药理作用】拟肾上腺素类药。
右美托咪定是一种高特异的α2-肾上腺素受体激动剂。
α2-肾上腺素受体的激活能在多个器官与组织中产生多种反应,其中主要是降低交感神经的活性,产生镇静和止痛作用,这些作用的深度和过程与药物浓度相关。
右美托咪定对其它中枢抑制剂(如麻醉剂)具有显著的增效作用,并能够显著降低麻醉剂的剂量。
按照推荐剂量的右美托咪定进行麻醉前给药可以减少插管法注射用药剂量的30%~60%。
按照推荐剂量的右美托咪定可以减少吸入麻醉药物的浓度40%~60%。
麻醉药物的剂量可以根据病畜的反应进行滴加。
【适应证】用作犬猫的镇静剂和止痛剂,便于帮助临床检查、临床治疗、小手术和小的牙科处理。
也可用作犬深度麻醉的麻醉前给药。
【用法与用量】用于犬的镇静和止痛:肌内注射500μg/m2或静脉注射375μg/m2,具体见下表:表1:犬的镇静/止痛剂量表:根据体重进行静脉注射(IV)和肌内注射(IM)犬体重静注右美托咪定375μg/m2肌注右美托咪定500μg/m2磅kg μg/kg ml μg/kg ml 4~7 2~3 28.1 0.12 40.0 0.15 7~9 3~4 25.0 0.15 35.0 0.20 9~11 4~5 23.0 0.20 30.0 0.30 11~22 5~10 19.6 0.29 25.0 0.40 22~29 10~13 16.8 0.38 23.0 0.50 29~33 13~15 15.7 0.44 21.0 0.60 33~44 15~20 14.6 0.51 20.0 0.70 44~55 20~25 13.4 0.60 18.0 0.80 55~66 25~30 12.6 0.69 17.0 0.90 66~73 30~33 12.0 0.75 16.0 1.00 73~81 33~37 11.6 0.81 15.0 1.10 81~99 37~45 11.0 0.90 14.5 1.20 99~110 45~50 10.5 0.99 14.0 1.30 110~121 50~55 10.1 1.06 13.5 1.40 121~132 55~60 9.8 1.13 13.0 1.50 132~143 60~65 9.5 1.19 12.8 1.60 143~154 65~70 9.3 1.26 12.5 1.70154~176 70~80 9.0 1.35 12.3 1.80 >176 >80 8.7 1.42 12.0 1.90 用于犬的麻醉前给药:肌内注射125μg/m2~375μg/m2。
盐酸右美托咪定生产工艺【摘要】盐酸右美托咪定是一种常用的药物成分,其生产工艺经过多个关键阶段。
本文从原料准备、反应工艺控制、纯化和结晶过程、干燥和成品包装以及质量控制等方面对盐酸右美托咪定的生产工艺进行了系统概述。
在原料准备阶段,需要确保原料的质量符合要求;反应工艺控制中,控制温度、压力和反应时间至关重要;纯化和结晶过程需要进行多次结晶以提高纯度;干燥和包装过程则需要保证成品的稳定性和卫生安全;质量控制环节则是保证产品质量稳定和可靠的重要环节。
通过全面分析各个环节的工艺流程,盐酸右美托咪定生产工艺可得到有效优化和提升。
盐酸右美托咪定生产工艺在不断完善中不断发展,为生产更高质量的药物产品提供了重要支撑。
【关键词】盐酸右美托咪定、生产工艺、原料准备、反应工艺控制、纯化、结晶过程、干燥、成品包装、质量控制、总结。
1. 引言1.1 盐酸右美托咪定生产工艺概述盐酸右美托咪定是一种常用的药物,广泛应用于临床治疗。
其生产工艺主要包括原料准备阶段、反应工艺控制、纯化和结晶过程、干燥和成品包装,以及质量控制等环节。
通过各个环节的严格控制和规范操作,可以保证最终产品的质量和稳定性。
盐酸右美托咪定的生产工艺需要遵循一定的技术要求和操作规范,确保生产过程的安全性和可控性。
在工艺优化和改进的基础上,不断提高生产效率和产品质量,促进盐酸右美托咪定的生产与应用。
通过对生产工艺的深入研究和实践经验的积累,可以不断提升盐酸右美托咪定的生产水平,满足市场需求和医疗用药的要求。
盐酸右美托咪定生产工艺的完善和发展,将为临床药物治疗提供更加可靠的保障和支持。
2. 正文2.1 原料准备阶段在盐酸右美托咪定生产工艺中,原料准备阶段是非常重要的一环。
在这个阶段,需要准备各种原材料和试剂,确保生产过程的顺利进行和产品质量的稳定。
主要包括以下几个方面的工作:1.右美托咪定原料:右美托咪定是盐酸右美托咪定的主要原料,通常是通过合成或提取的方式获得。
(19)中华人民共和国国家知识产权局(12)发明专利申请(10)申请公布号 (43)申请公布日 (21)申请号 201711461965.0(22)申请日 2017.12.28(71)申请人 石药银湖制药有限公司地址 044000 山西省运城市盐湖工业园区(72)发明人 狄彩霞 王振国 康月菊 郭良 胡菲 李晓林 张俊燕 姚春虎 费晖娟 高凯丽 (74)专利代理机构 北京轻创知识产权代理有限公司 11212代理人 杨立 王灏增(51)Int.Cl.A61K 31/4174(2006.01)A61K 9/08(2006.01)A61K 47/02(2006.01)A61P 25/20(2006.01)A61P 25/22(2006.01)A61J 1/05(2006.01)A61J 1/14(2006.01)(54)发明名称一种提高盐酸右美托咪定注射液稳定性的处理方法及盐酸右美托咪定注射液(57)摘要本发明公开了一种提高盐酸右美托咪定注射液稳定性的处理方法及盐酸右美托咪定注射液,该处理方法包括如下步骤:在氮气保护下,将配制好的盐酸右美托咪定注射液经微孔滤芯过滤,冷却至35-40℃,装入内表面修饰有活性基团的玻璃瓶中,灭菌即可;其中,所述活性基团为氨基、巯基、羧基、酸酐中的一种或多种。
采用该方法处理后,不用在盐酸右美托咪定注射液中添加任何辅料即可提高其稳定性,避免了辅料对注射液造成的不利影响。
权利要求书1页 说明书9页CN 108113986 A 2018.06.05C N 108113986A1.一种提高盐酸右美托咪定注射液稳定性的处理方法,其特征在于,包括如下步骤:在氮气保护下,将配制好的盐酸右美托咪定注射液经微孔滤芯过滤,冷却至35-40℃,装入内表面修饰有活性基团的玻璃瓶中,灭菌即可;其中,所述活性基团为氨基、巯基、羧基、酸酐中的一种或多种。
2.根据权利要求1所述的处理方法,其特征在于,所述盐酸右美托咪定注射液的配制方法如下:取配制量40%的注射用水,注射用水的温度为70-80℃,加入处方量的氯化钠,搅拌至溶解;再加入处方量的盐酸右美托咪定,搅拌至溶解,加注射用水至全量,搅拌20-35min。
盐酸右美托咪定
Yansuan Youmeituomiding
Dexmedetomidine Hydrochloride
N
H N
CH 3
C H 3CH 3
C 13H 16N 2·HCl 236.76
.0
本品为4-【(1s )-1-(2,3-二甲基苯基)乙基】-1H-咪唑盐酸盐。
按干品计算,含C13H16N2·HC 不得少于99.0%。
性状:本品为白色或类白色结晶性粉末,极局引湿性。
本品在水中极易溶解,在乙醇或氯仿中易容,在乙醚中几乎不溶。
熔点:本品的熔点(中国药典2010年版二部附录Ⅵ C )为153-158℃。
比旋度:取本品,精密称定,加水溶解并稀释制成每1ml 中约含10mg 的溶液,依法测定(中国药典2010年版二部附录Ⅵ E ),比旋度应为+51.0°-+54.0°
鉴别:(1)取本品约5mg ,加水5ml 溶解,加碘化铋钾试液数滴,即生成橙黄色沉淀。
(2):本品的红外吸收光谱应与对照品的图谱一致(中国药典2010年版二部附录Ⅳ C )
(3)取本品约50mg ,加水溶解后,加氨试液使成碱性,滤过,滤液加硝酸使成酸性后,溶液显氯化物的鉴别反应(中国药典2010年版二部附录Ⅲ)。
检查:酸度 取本品,加水制成1ml 中约含10mg 的溶液,依法测定(中国药典2010年版二部附录Ⅵ H ),PH 值应为3.5-4.5.
溶液的澄清度与颜色:取本品,加水制成1ml 中约含10mg 的溶液,应澄清无色。
如显浑浊,与浊度1号标准液(中国药典2010年版二部附录Ⅸ B )比较,不得更浓。
如显色,与黄色1号标准比色液(中国药典2010年版二部附录Ⅸ A )比较,不得更深。
有关物质: 照高效液相色谱法(中国药典2010年版二部附录Ⅴ D )测定。
色谱条件与系统适应性试验:用十八烷基键合硅胶为填充剂,以0.05%的磷酸(用三乙胺调节PH 至7.0)-乙腈(60:40)为流动相,检测波长为220nm ,理论塔板数按右美托咪定峰计算应不低于2000,右美托咪定峰相邻杂质峰的分离度应符合要求。
取本品,加流动相制成每1ml 中含0.3mg 的溶液,作为供试品溶液,量取适量,加流动相制成1ml 含3微克的溶液,作为对照溶液。
在上述色谱条件下,取对照溶液20微升注入液相色谱仪,调节检测灵敏度,使主成分色谱峰的峰高为满量程的10%以上。
再精密量取上述俩种溶液各20微升,分别进样,记录色谱图至主成分峰保留时间的2倍。
供试品溶液的色谱图中如先杂质峰,各杂质峰峰面积之和不得大于对照溶液主峰面积(1.0%)。
盐酸左美托咪定 照高效液相色谱法(中国药典2010年版二部附录Ⅴ D )测定。
色谱条件与系统适应性试验 用AGP 为填充剂,以0.03mol/L 的磷酸盐缓冲液(取磷酸二氢钾2.04克,加0.1mol/L 的氢氧化钠溶液80ml ,用水稀释至500ml )-乙腈(82.5:17.5)为流动相,检测波长为220nm ,理论塔板数按左美托咪定峰计算应不低于1000,左美托咪定峰与右美托咪定峰的分离度应符合要求。
取本品,加加流动相制成每1ml中含0.12mg的溶液,作为供试品溶液,精密称取取盐酸左美托咪定对照品适量,加流动相制成每1ml中约含1.2微克的溶液,作为对照溶液。
精密量取对照溶液20微升注入液相色谱仪,调节检测灵敏度,使主成分峰的逢高约为满量程的10%,再量取供试品溶液20微升注入液相色谱仪,供试品溶液的色谱峰中左美托咪定的峰不得大于对照品溶液主成分峰面积(1.0%)。
甲醇,乙醇,丙酮,二氯甲烷,四氢呋喃,乙酸乙酯:精密称取甲醇,乙醇,丙酮,二氯甲烷,四氢呋喃,乙酸乙酯各适量,加N,N二甲基甲酰胺制成每1ml中含甲醇0.15mg,四氢呋喃0.036mg,二氯甲烷0.03mg,乙醇丙酮乙酸乙酯各0.25mg的溶液,作为对照溶液,精密称取供试品约0.5g,置10ml量瓶中,加N,N二甲基甲酰胺溶液溶解并稀释至刻度,作为供试品溶液。
取上述两种溶液,照气相色谱法(中国药典2010年版二部附录Ⅴ E),用聚乙二醇毛细管柱,程序升温,起始温度为50度,保持8分钟,然后以20度/分钟升温速度升至200度,维持5分钟,按外标法以峰面积计算,含甲醇不得过0.3%,二氯甲烷不得过0.06%,四氢呋喃不得过0.072%,乙醇丙酮乙酸乙酯均不得过0.5%。
干燥失重:取本品,在105度干燥至恒重,减失重量不得过1.0%(中国药典2010年版二部附录Ⅷ L)
炽灼残渣:取本品,依法检查(中国药典2010年版二部附录Ⅷ N),遗留残渣不得过0.1%。
重金属取炽灼残渣项下遗留残渣,依法检查(中国药典2010年版二部附录Ⅷ H第二法),含重金属不得过百万分之十。
含量测定:取本品约0.2克,精密称定,加冰醋酸10ml溶解后,加醋酸汞试液5ml,结晶紫指示液1滴,用高氯酸滴定液(0.1mol/L)滴定至溶液显蓝色,并将滴定结果用空白试验校正。
每1ml高氯酸滴定液(0.1mol/L)相当于23.68mg的C13H16N2·HCl。
【类别】镇静药
【贮藏】密封保存
【制剂】盐酸右美托咪定注射液
【有效期】暂定2年。