化学常见气体的制备方法总结(超经典)
- 格式:ppt
- 大小:1.87 MB
- 文档页数:28

【化学】高中化学常见物质制备方法 在高中化学的学习中,掌握常见物质的制备方法是非常重要的。这不仅有助于我们理解化学反应的原理,还能提高我们的实验操作能力和解决实际问题的能力。下面,我们就来一起了解一下高中化学中一些常见物质的制备方法。
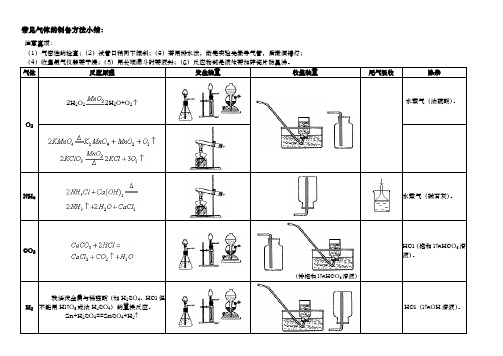
一、氧气的制备 氧气是一种非常重要的气体,在许多实验和工业生产中都有广泛的应用。在实验室中,我们通常可以通过以下两种方法来制备氧气:
1、 加热高锰酸钾法 化学方程式:2KMnO₄ 加热 K₂MnO₄ + MnO₂ + O₂↑ 实验步骤:首先,检查装置的气密性。然后,将适量的高锰酸钾粉末装入大试管中,并在试管口塞上一团棉花,以防止加热时高锰酸钾粉末进入导管。接下来,将试管固定在铁架台上,使试管口略向下倾斜,这是为了防止冷凝水回流导致试管炸裂。点燃酒精灯,先对试管进行预热,然后集中加热。当导管口有连续均匀的气泡冒出时,开始收集氧气。收集氧气可以采用排水法或向上排空气法。排水法收集的氧气比较纯净,而向上排空气法收集的氧气比较干燥。实验结束时,先将导管从水槽中移出,然后再熄灭酒精灯,以防止水槽中的水倒吸进入试管,导致试管炸裂。 2、 过氧化氢分解法 化学方程式:2H₂O₂ (MnO₂作催化剂) 2H₂O + O₂↑ 实验步骤:首先,连接好装置,检查装置的气密性。然后,在锥形瓶中加入适量的过氧化氢溶液,再向其中加入少量的二氧化锰粉末作为催化剂。当看到有大量气泡产生时,就可以开始收集氧气了。收集方法同样可以选择排水法或向上排空气法。
二、氢气的制备 氢气是一种密度很小、具有可燃性的气体。实验室中通常用锌和稀硫酸反应来制备氢气。
化学方程式:Zn + H₂SO₄ = ZnSO₄ + H₂↑ 实验步骤:先检查装置的气密性。然后,将锌粒放入大试管中,再加入适量的稀硫酸。立即用带有导管的橡皮塞塞住试管口,并将导管另一端伸入到集气瓶中。收集氢气可以采用排水法或向下排空气法。由于氢气是一种可燃性气体,在使用前一定要检验其纯度,以免发生爆炸。

化学实验中的气体制备在化学实验中,气体的制备是一个常见的实验项目。
无论是用于实验研究还是应用于工业生产,制备气体都是必不可少的步骤。
本文将介绍几种常见的气体制备方法,包括制备氧气、氢气、二氧化碳和氮气。
一、氧气的制备氧气是一种常用的气体,广泛应用于呼吸、燃烧和氧化反应等领域。
在实验室中,可以使用以下两种方法制备氧气:1. 过氧化氢的分解过氧化氢(H2O2)分解可以制备氧气。
首先,将适量的过氧化氢溶液放入反应瓶中,然后加入少量的催化剂,如锰(MnO2)。
在加热的条件下,过氧化氢分解成水和氧气。
反应方程式如下所示:2H2O2 → 2H2O + O22. 高温分解金属氧化物高温分解金属氧化物也可以制备氧气。
选择适量的金属氧化物,如二氧化锰(MnO2),放入烧杯中,然后加热至较高温度。
金属氧化物分解生成金属和氧气。
反应方程式如下所示:2MnO2 → 2Mn + O2二、氢气的制备氢气是一种重要的气体,在实验室和工业中均具有广泛的应用。
以下是两种常见的氢气制备方法:1. 金属与酸的反应一些金属可以与酸反应产生氢气。
常用的金属有锌(Zn)和铁(Fe),常用的酸有盐酸(HCl)。
将适量的金属放入反应瓶中,然后添加足够的酸。
金属与酸反应生成氢气。
反应方程式如下所示:Zn + 2HCl → ZnCl2 + H22. 水的电解水的电解是制备氢气的另一种方法。
使用电解槽装置,将两个电极(一个是阳极,一个是阴极)浸入水中,然后通电。
在电解的过程中,水分解成氢气和氧气。
反应方程式如下所示:2H2O → 2H2 + O2三、二氧化碳的制备二氧化碳是一种常见的气体,在植物光合作用、饮料制造和灭火等方面具有重要作用。
以下是两种常见的二氧化碳制备方法:1. 一氧化碳和氧气的燃烧将适量的一氧化碳(CO)和氧气(O2)混合,然后点燃混合物。
在燃烧过程中,一氧化碳与氧气反应生成二氧化碳。
反应方程式如下所示:CO + O2 → CO22. 碳酸酸和酸的反应将适量的碳酸酸(如碳酸钠)与酸(如盐酸)反应,生成二氧化碳。

2025届高考复习之常见气体和金属的制备-2019人教版一、气体制备1.Cl2制备原理:实验室加热:4HCl(浓)+MnO2MnCl2+2H2O+Cl2↑实验室不加热:16HCl(浓)+2KMnO4=2KCl+2MnCl2+5Cl2↑+8H2O注:实验室还可通过浓盐酸与KClO3的反应、浓盐酸与K2Cr2O7的反应、PbO2和浓盐酸的反应制备Cl2。
工业制Cl2:2NaCl+2H2O 2NaOH+Cl2↑+H2↑考点:①涉及HCl的反应往往要除杂。
②两处的“浓”含义不一样,MnO2与稀HCl不反应,MnO4-与Cl-任何情况都反应,用浓溶液是为了加快V。
典型例题1.某学习小组利用下图装置制备84消毒液。
下列说法正确的是A .湿润的蓝色石蕊试纸褪色,说明2Cl 有漂白性B .Ⅱ中溶液出现浑浊,说明2Cl 降低了NaCl 的溶解度C .若无装置Ⅱ,制取的84消毒液中NaClO 的纯度下降D .该装置条件下,若用2MnO 代替4KMnO 也可制取84消毒液 2.在实验室采取如图装置和下列各组试剂,能使纸蝴蝶只变色不褪色的是 选项 液体A+C 固体BA稀硝酸+紫色石蕊溶液CuB 浓盐酸+紫色石蕊溶液4KMnOC 稀盐酸+品红溶液 FeSD 醋酸+酚酞溶液3CaCOA .AB .BC .CD .D2.SO2制备原理:实验室加热:Cu+2H2SO4(浓) CuSO4+SO2↑+2H2O实验室不加热: Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O考点:①SO2有四性:漂白性,还原性,氧化性,酸性。
检验酸性:把气体通到氢氧化钠的酚酞溶液中,会褪色;检验漂白性:把气体通到品红溶液中,会褪色,加热会恢复红色,这是可逆型漂白。
检验还原性:把气体通到酸性高锰酸钾溶液或溴水中,均会褪色。
(通到液溴中不反应)检验氧化性:通到硫化氢的水溶液中会看到黄色浑浊。
②SO2能漂白品红和有色布条的漂白性可逆,加热可恢复颜色。

高中常见气体的制备在高中化学的世界里,气体制备可谓是一门奇妙的艺术。
哎,谁不想在实验室里挥舞着试管,感受那种“科学家”的气息呢?咱们今天就聊聊几种常见的气体怎么做,顺便也来点儿轻松幽默的调侃,保证让你笑着学,乐着记。
咱们来说说氢气。
这个小家伙可神奇了,轻飘飘的,感觉随时能飞起来似的。
想要制备氢气,最简单的方法就是用锌和盐酸来搞定。
把锌片放进盐酸里,哎呀,那个反应可热闹了,咕噜咕噜的冒出小泡泡,简直像是在开派对。
想象一下,氢气的性格就像个小男孩,爱玩、爱闹,最后它会随着气泡飘上天,真是让人羡慕啊!小心点,氢气可是个易燃的家伙,别让它给你来个意外的惊喜哦。
然后,咱们再来聊聊氧气。
哦,氧气可是生命之源呀!没有它,咱们可就活不下去了。
制备氧气的方法也简单,常用的是分解过氧化氢。
把过氧化氢倒进烧杯里,加入点儿二氧化锰,哗啦啦,反应开始了,氧气一股脑儿冒出来,感觉就像一场盛大的烟火秀。
气泡越来越多,空气中都能闻到清新的味道,真让人心旷神怡。
嘿,你知道吗,氧气的性格就像个温柔的妈妈,默默地支持着我们,让我们能尽情呼吸,活得滋润。
再来看看二氧化碳。
这小子就爱搞事情,特别是在喝饮料的时候。
想要制备二氧化碳,一般用酸和碳酸钙反应。
你把醋倒在碳酸钙上,那个反应简直就像火山爆发一样,气泡直冒。
看到那些气泡在冒,仿佛在说:“快来,喝我!我能让你爽!”而二氧化碳可真是个调皮鬼,能让饮料起泡,带来爽口的体验。
哎,说到这里,谁不爱喝一口冰凉的饮料呢?还有一位常客,氨气。
氨气的气味可真不是好惹的,呛鼻得很。
想要制备氨气,咱们可以用氨水和石灰反应。
把氨水加到石灰里,哇,氨气就开始冒出来了,气味扑鼻而来,简直像是个小恶作剧,告诉你:我来了!氨气在化学中可是个多才多艺的角色,能用于肥料的制造,对农业有着不小的贡献。
再说说一氧化碳,这家伙可是个隐形的杀手。
它的制备方法有很多,但通常通过燃烧不完全的碳源来产生。
比如,点燃木炭,然后不让氧气完全进入,嘿,一氧化碳就悄然无声地出来了。

常见气体及有机物的制备方法及一、气体的制备1、3NH : O H CaCl NH OH Ca Cl NH 2232422)(2++↑===+3233NH LiOH O H N Li +===+注意事项;(1)不能用34NO NH 跟2)(OH Ca 反应制因为34NO NH 是氧化性,加热时在120度时分解为和硝酸随着温度升高,硝酸的强氧化性发挥作用使生成的氨进一步被氧化生成氮气和氮的氧化物。
到了210度时分解产物为和水 ,到了300度以上就为氮气、氧气和水。
附:也不能用碳酸氢铵、硫酸铵:加热会产生CO2,受,在不同温度下,产物不同,当温度小于150摄氏度时,产物为与硫酸,而当温度大于150摄氏度时,能发生自身的,生成二等多种产物(2)实验室制3NH 不能用NaOH 、KOH 代替2)(OH Ca因为NaOH 、KOH 是,具有吸湿性(潮解)易结块,不易与混合充分接触反应。
又KOH 、NaOH 具有强腐蚀性在加热情况下,对玻璃仪器有腐蚀作用,所以不用NaOH 、KOH 代替2)(OH Ca 制3NH 。
(3)用试管收集氨气为什么要堵棉花因为3NH 分子微粒直径小,易与空气发生对流,堵棉花目的是防止3NH 与,确保收集纯净。
(4)实验室制3NH 除水蒸气为什么用,而不采用浓42SO H 和固体2CaCl①因为浓42SO H 与3NH 反应:两者反应为酸碱。
反应方程式为:424423)(22SO NH SO H NH ==+(硫酸少量) 44423HSO NH SO H NH ==+(硫酸过量)②3NH 与2CaCl 反应:生成一种络合物“八氨合氯化钙”(328NH CaCl ⋅),反应方程式:323288NH CaCl NH CaCl ⋅==+(5)实验室快速制得氨气的方法:用浓加固体NaOH (或加热浓)2、4CH :无水醋酸钠与混合加热制甲烷无水醋酸钠是由普通醋酸钠晶体O H COONa CH 233⋅加热脱水而成是氢氧化钠和的混合物,呈颗粒状。
实验基础知识补充二、常见气体的制备方法(前6个最常考,有下划线的必须熟记)1.氨气?(1)工业制法?(合成氨工业):N2+3H2?2NH3?(2)实验室制法?(氯化铵和消石灰混合加热):?2NH4Cl+Ca(OH)2?CaCl2+2NH3?↑+2H2O?说明:试管口棉花的作用是支撑固定导管,且减少NH3与空气的对流,提高氨气的纯度。
(3)实验室快速制氨法:浓氨水滴入到生石灰(或烧碱或碱石灰)表面快速产生氨气。
2.氯气?(1)工业制法?①电解饱和食盐水得到烧碱、氢气和氯气:2NaCl+2H2O2NaOH?+H2↑+?Cl2↑?②冶炼钠(或镁)时得到金属和氯气:2NaCl(熔融)?2Na?+?Cl2↑?(2)实验室制法?①KMnO4常温氧化浓盐酸:2KMnO4+16HCl(浓) = 2KCl+2MnCl2+5Cl2↑+8H2O?②MnO2加热氧化浓盐酸:MnO2+4HCl(浓) ?MnCl2+Cl2↑+2H2O?(与稀盐酸不反应)3.二氧化硫?(1)工业制法?①高温煅烧硫铁矿:4FeS2+11O2?2Fe2O3+8SO2??②火法炼铜得到副产物二氧化硫:Cu2S+O2??2Cu+SO2?③燃烧硫磺得到二氧化硫:S+O2?SO2?(2)实验室制法?①Cu+2H2SO4(浓) ?CuSO4+SO2↑+2H2O?(向上排空气法收集)②Na2SO3+?H2SO4(70%)=Na2SO4+H2O+SO2?↑SO2与水反应并溶解在溶液中。
2、B装置的作用是验证SO2具有还原性;B装置中的现象是紫红色褪色或颜色变浅;离子方程式为5SO2+2MnO-4+2H2O===5SO2-4+2Mn2++4H+3、C装置的作用是验证SO2的氧化性;现象是溶液中产生黄色浑浊4.氯化氢?(1)工业制法?(氢气在氯气中燃烧):H2+Cl2??2HCl?(2)实验室制法?①2NaCl+H2SO4(浓)?Na2SO4+2HCl?↑?②浓硫酸滴入到浓盐酸中快速制备HCl气体。
高中阶段常见气体的实验室制法
1、酸性气体:硫酸
实验室制法:将湿铁粉和硫酸放入圆瓶中,做好密封处理,并加热,由于反应势能很小,只能产生大量气体,将产生的硫酸气体用三氯乙烯(CCl3)和银粉进行吸收,即可得到硫酸液体。
2、碱性气体——氢氧化钠
实验室制法:用硫酸锂和氢氧化钠同时混合,然后放入圆瓶中,加热2-3分钟,即可产生大量的氢氧化钠气体,将该气体冷却及蒸发处理,也可以凝胶固体。
4、有机气体——甲醛
实验室制法:将甲醛与乙醇混合,然后放入圆瓶中,加热水浴温度至60—70度,即可产生大量的甲醛气体,将该气体以大量的氧化铝或硫酸钡吸收,即可得到纯净的甲醛液体。
5、无色有毒气体——二氧化碳
实验室制法:将烧杯中的酸性碳酸钾加热,由于其反应性十分强烈,所以可在短时间内产生大量的二氧化碳气体,其产生的二氧化碳气体也可以用水蒸汽来吸收。
总之,上述气体的实验室制法都是使用酸、碱类物质与其它物质进行化学反应来获得气体的。
通过不同的化学反应,可以获得不同的气体,所以在实验室制法中要根据需求灵活选择合适的化学反应。
化学实验中的气体的制备与收集气体在化学实验中起着重要的作用,通过适当的制备与收集方法,可以获取所需的气体样品。
本文将以化学实验中的气体的制备与收集为主题,介绍几种常用的方法。
一、碳酸氢钠与醋酸反应制备二氧化碳气体碳酸氢钠(NaHCO3)与醋酸(CH3COOH)反应可以制备二氧化碳气体(CO2)。
实验步骤如下:1. 准备一个干净的反应瓶,称取适量的碳酸氢钠固体放入瓶中;2. 加入一定量的醋酸溶液,反应瓶盖密封;3. 观察反应瓶中产生气泡,并通过适当的装置将产生的二氧化碳气体收集起来。
二、铁与盐酸反应制备氢气铁(Fe)与盐酸(HCl)反应可以制备氢气(H2)。
实验步骤如下:1. 准备一个干净的反应瓶,称取适量的铁末放入瓶中;2. 加入一定量的盐酸溶液,反应瓶盖密封;3. 观察反应瓶中产生气泡,并通过适当的装置将产生的氢气收集起来。
三、过氧化氢分解制备氧气过氧化氢(H2O2)在催化剂存在下分解可以制备氧气(O2)。
实验步骤如下:1. 准备一个干净的反应瓶,加入一定量的过氧化氢溶液;2. 在加入适量的催化剂,如过氧化锰(MnO2);3. 观察反应瓶中产生气泡,并通过适当的装置将产生的氧气收集起来。
四、水和硫酸反应制备氯气水(H2O)与硫酸(H2SO4)反应可以制备氯气(Cl2)。
实验步骤如下:1. 准备两个干净的反应瓶,在一个瓶子中加入适量的硫酸溶液;2. 在另一个瓶子中加入一定量的水;3. 将两个反应瓶用一根玻璃管连接起来;4. 在硫酸瓶中加热产生热量,观察连接管中产生气泡,并通过适当的装置将产生的氯气收集起来。
五、气体的收集方法在化学实验中,常用的气体收集方法有水位置法和倒气法。
水位置法适用于溶于水的气体,如二氧化碳气体。
实验步骤如下:1. 准备一个带有分液漏斗的收集装置,将装有气体的试管或反应瓶倒置至水缸中;2. 缓慢提起气体收集瓶,使水位逐渐上升,气体被排除,直至气体完全填满收集瓶。
此时,水位在收集瓶内外相等,可以停止收集气体。