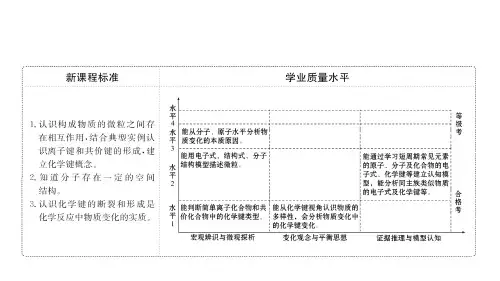
1.下列叙述错误的是 ( A ) A.带相反电荷的离子之间的相互吸引力称为离子键 B.金属元素与非金属元素化合时,不一定形成离子键 C.原子序数为11与9的元素能够形成离子化合物,该化合物中存在离子键 D.非金属元素也可能形成离子键
2.(2021山东烟台高一月考)下列有关电子式的叙述正确的是
A.H、He、Li的电子式分别为H·、·He·、·Li··
解析 氢化钠(NaH)是离子化合物,其电子式为Na+[··H]-,A正确;NaH中氢元素 的化合价为-1,其离子的电子层排布与氦原子的电子层排布相同,B错误;Li+和 H-的电子层排布相同,但是锂元素的核电荷数比氢元素的大,所以半径:H->Li+, C错误;NaH与H2O反应生成H2和NaOH,NaH中氢元素的化合价升高,被氧化, NaH作还原剂,H2O中氢元素的化合价降低,被还原,H2O作氧化剂,D正确。
提示 同主族元素的原子或简单离子的电子式的写法相似,差别仅在于元素
符号不同,如·O ·与·S·,[·×Cl··]-与[·× Br··]-。
探究归纳
1.电子式书写中的常见错误
(1)漏标阴离子的括号,如将S2-的电子式错写为··S··2-。
(2)给阳离子多标电子和括号,如将Al3+的电子式错写为[··A l··]3+。
B.2Na+F2
2Na+[··F ··]
C.
Mg+2··F
··
Mg2+[×F·
×]·2
(D)
D.
6.A、B、C三种短周期元素,其原子序数依次增大,三种元素的原子序数之和
为35,A、C同主族,B+核外有10个电子,则:
(1)A、B、C三种元素分别为 氧(O) 、 钠(Na) 、 硫(S) 。