高三化学一轮复习第6章氮族元素 第一节 氮族元素习题详解(含解析)(实验班)
- 格式:docx
- 大小:190.60 KB
- 文档页数:4



高三化学总复习氮族元素可能用到的相对原子质量:H: 1 O: 16 N: 14 Cl: 35.5 S:32 Ca: 40 Cu:64 Na:23I卷一、选择题(每小题有1-2个答案,共50分)1.汽车尾气在光照下分解时,即开始光化学烟雾的循环,它的形成过程可用下列方程式表示:NO2NO+O;2NO+O2== 2NO2;O+O2==O3下列有关叙述不正确的是A.在此过程中,NO2是催化剂B.在此过程中,NO是反应的中间产物C.此过程的总反应方程式为:2O3==3O2D.光化学烟雾能引起人的外呼吸功能严重障碍2.锗酸铋(BGO)是我国研制成功的一种性能优良的闪烁晶体材料,其中锗元素处于最高价态,又知铋元素是V A族元素,它的价态与铋跟氯形成某种共价氯化物所呈现的价态相同,此时该氯化物中铋有8电子的稳定结构,则BGO 的化学式为A.Bi2Ge3O15 B. Bi4Ge3O12C. Bi4Ge3O16D. Bi2Ge3O123.在浅绿色的硝酸亚铁溶液中主要存在的平衡是Fe2++2H 2O Fe(OH)2+2H+,现向该溶液中加入少量的稀盐酸,溶液颜色的变化应该是A.绿色变浅B.绿色加深C.溶液变黄D.几乎不变化4.下列各组比较中,正确的是A.原子半径:N<P<S B.稳定性:NH3< H2O < HFC.碱性:Sb(OH)3>Bi(OH)3D.酸性:H3AsO4> H2SeO4> HBrO4 5.含3.7gCa(OH)2的石灰水中滴加150ml0.5mol/L的H3PO4溶液,待完全反应后,下列叙述正确的是A.只生成CaHPO4B.有Ca3(PO4)2和CaHPO4生成C.只生成Ca(H2PO4)2D.有CaHPO4和Ca(H2PO4)26.蘸有浓氨水的玻棒靠近下列各浓酸时,均有白烟产生的一组是A.HCl、H2SO4、HNO3B.HCl、HBr、HNO3C.HCl、H3PO4、HNO3D.HCl、H3PO4、H2SO47.亚硝酸钠有咸味,有毒,外观类似于食盐,故应严防把它误当作食盐用。
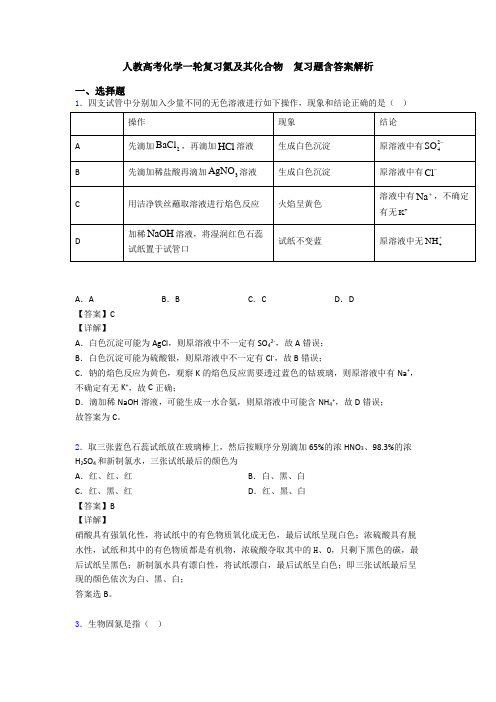
人教高考化学一轮复习氮及其化合物复习题含答案解析一、选择题1.四支试管中分别加入少量不同的无色溶液进行如下操作,现象和结论正确的是()A.A B.B C.C D.D【答案】C【详解】A.白色沉淀可能为AgCl,则原溶液中不一定有SO42-,故A错误;B.白色沉淀可能为硫酸银,则原溶液中不一定有Cl-,故B错误;C.钠的焰色反应为黄色,观察K的焰色反应需要透过蓝色的钴玻璃,则原溶液中有Na+,不确定有无K+,故C正确;D.滴加稀NaOH溶液,可能生成一水合氨,则原溶液中可能含NH4+,故D错误;故答案为C。
2.取三张蓝色石蕊试纸放在玻璃棒上,然后按顺序分别滴加65%的浓HNO3、98.3%的浓H2SO4和新制氯水,三张试纸最后的颜色为A.红、红、红B.白、黑、白C.红、黑、红D.红、黑、白【答案】B【详解】硝酸具有强氧化性,将试纸中的有色物质氧化成无色,最后试纸呈现白色;浓硫酸具有脱水性,试纸和其中的有色物质都是有机物,浓硫酸夺取其中的H、O,只剩下黑色的碳,最后试纸呈黑色;新制氯水具有漂白性,将试纸漂白,最后试纸呈白色;即三张试纸最后呈现的颜色依次为白、黑、白;答案选B。
3.生物固氮是指()A.生物从土壤中吸收含氮养料B.豆科植物根瘤菌将含氮化合物转变为植物蛋白质C.将氨转变成硝酸及其它氮的化合物D.生物将空气中的氮气转变成含氮化合物【答案】D【分析】生物固氮是指固氮微生物将大气中的氮气转化为含氮的化合物的过程。
【详解】A.土壤中含有的NO3-、NH4+,被植物吸收合成植物所需的物质,是氮的化合物转化为氮的化合物,A不符合题意;B.根瘤菌将含氮化合物转化为蛋白质,是氮的化合物转化为氮的化合物,B不符合题意;C.将氨转变成硝酸及其它氮的化合物,是氮的化合物转化为氮的化合物,C不符合题意;D.生物将氮气转化为含氮化合物,符合生物固氮的定义,D符合题意;答案选D。
4.14 g铜、银合金与一定量某浓度的硝酸溶液完全反应,将放出的气体与1.12 L(标准状况下)氧气混合通入水中,恰好全部被水吸收,则合金中铜的质量是( )A.9.6 g B.6.4 g C.4.8 g D.3.2 g【答案】D【详解】根据题意:有如下转化关系:设Cu xmol 、Ag ymol 金属铜、银失去电子给了硝酸中+5价的氮,还原产物中的NO和 NO2又失去电子给了氧气生成硝酸,整个过程等效于铜、银失电子,转移给了氧气,所以根据电子得失守恒规律:2x+y=4×1.1222.4,质量守恒:64x+108y=14,分别解出x=0.05mol,m(Cu)=0.05mol×64g/mol=3.2g;D正确;故答案选D。

氮族元素一、氮和磷1.氮族元素:包括氮(7N)、磷、(15P)、砷(33As)、锑(51Sb)、铋(83Bi)五种元素.氮族元素位于元素周期表中第VA 族,其代表元素为氮和磷.2.氮族元素的原子结构(1)相似性:①最外层电子数均为5个;②主要化合价:氮有-3、+1、+2、+3、+4、+5价;磷和砷有-3、+3、+5价;锑、铋有+3、+5价.(2)递变规律:按氮、磷、砷、锑、铋的顺序,随着核电荷数的增加,电子层数增多,原子半径增大,失电子能力增强,得电子能力减弱,非金属性减弱,金属性增强.在氮族元素的单质中,氮、磷具有较明显的非金属性;砷虽然是非金属,但有一些金属性;锑、铋为金属. 3.氮族元素单质的物理性质(一).氮气1.(1)氮元素在自然界中的存在形式:既有游离态又有化合态.空气中含N 2 78%(体积分数)或75%(质量分数);化合态氮存在于多种无机物和有机物中,氮元素是构成蛋白质和核酸不可缺少的元素.(2)氮气的物理性质:纯净的氮气是无色气体,密度比空气略小.氮气在水中的溶解度很小.在常压下,经降温后,氮气变成无色液体,再变成雪花状固体. (3)氮气的分子结构:氮分子(N 2)的电子式为,结构式为N ≡N .由于N 2分子中的N ≡N 键很牢固,所以通常情况下,氮气的化学性质稳定、不活泼. (4)氮气的化学性质: ①N 2与H 2化合生成NH 3 N 2 +3H 22NH 3(该反应是一个可逆反应,是工业合成氨的原理.) ②N 2与O 2化合生成NO : N 2 + O 22NO (在闪电或行驶的汽车引擎中会发生以上反应.)(5)氮气的用途①合成氨,制硝酸;②代替稀有气体作焊接金属时的保护气,以防止金属被空气氧化; ⑧在灯泡中填充氮气以防止钨丝被氧化或挥发; ④保存粮食、水果等食品,以防止腐烂;⑤医学上用液氮作冷冻剂,以便在冷冻麻醉下进行手术; ⑥利用液氮制造低温环境,使某些超导材料获得超导性能. 2.NO 、NO 2性质的比较(1)电闪雷鸣时:N 2+O 22NO(2) 2NO + O 2= 2NO 2(3)下雨时:3NO 2 + H 2O =2HNO 3 + NO(4)生成的硝酸随雨水淋洒到土壤中,并与土壤中的矿物作用生成能被植物吸收的硝酸盐.4.光化学烟雾:NO 、NO 2有毒,是大气的污染物.空气中的NO 、NO 2污染物主要来自于石油产品和煤燃烧的产物、汽车尾气以及制硝酸工厂的废气.NO 2在紫外线照射下,发生一系列光化学反应,产生一种有毒的烟雾——光化学烟雾.因此,NO 2是造成光化学烟雾的主要因素.光化学烟雾刺激呼吸器官,使人生病甚至死亡. (二)磷 1.. (1)磷元素在自然界中的存在形式:自然界中无游离态的磷.化合态的磷主要以磷酸盐的形式存在于矿石中.动物的骨骼、牙齿和神经组织,植物的果实和幼芽,生物的细胞里都含有磷. (2)单质磷的化学性质: ①与O 2反应: 4P+5O 22P 2O 5②磷在C12中燃烧: 2P+3C12(不足量) 2PCl 3 2P+5Cl 2(足量)2PCl 52.磷的同素异形体——白磷与红磷240℃白磷、红磷在空气中燃烧,都生成白色的P 2O 5白磷与红磷燃烧都生成素形成的单质红磷证明白磷与红磷所含元素相同——互为同素异形体密封保存,防止吸湿切削白磷应在水中进行3.五氧化二磷、磷酸(1)五氧化二磷的性质:五氧化二磷是白色粉末状固体,极易吸水(因此可作酸性气体的干燥剂).P 2O 5是酸性氧化物,与水反应:P 2O 5+3H 2O 2H 3PO 4(2)磷酸的性质、用途:磷酸(H 3PO 4)是一种中等强度的三元酸,具有酸的通性.磷酸主要用于制造磷肥,也用于食品、纺织等工业.4.氮、磷元素及其单质、化合物性质的比较222P22NH22PH二.铵盐1.氨(1)氨的物理性质:①氨是无色、有刺激性气味的气体,比空气轻;②氨易液化.在常压下冷却或常温下加压,气态氨转化为无色的液态氨,同时放出大量热.液态氨气化时要吸收大量的热,使周围的温度急剧下降;③氨气极易溶于水.在常温、常压下,1体积水中能溶解约700体积的氨气(因此,氨气可进行喷泉实验);④氨对人的眼、鼻、喉等粘膜有刺激作用.若不慎接触过多的氨而出现病症,要及时吸入新鲜空气和水蒸气,并用大量水冲洗眼睛.(2)氨分子的结构:NH3的电子式为,结构式为,氨分子的结构为三角锥形,N原子位于锥顶,三个H 原子位于锥底,键角107°18′,是极性分子.(3)氨的化学性质:①跟水反应.氨气溶于水时(氨气的水溶液叫氨水),大部分的NH3分子与H2O分子结合成NH3·H2O(叫一水合氨).NH3·H2O 为弱电解质,只能部分电离成NH4+和OH-:NH3 + H23·H24++ OH-a.氨水的性质:氨水具有弱碱性,使无色酚酞试液变为浅红色,使红色石蕊试液变为蓝色.氨水的浓度越大,密度反而越小(是一种特殊情况).NH3·H2O不稳定,故加热氨水时有氨气逸出:NH4++ OH-NH3↑+ H2Ob.氨水的组成:氨水是混合物(液氨是纯净物),其中含有3种分子(NH3、NH3·H2O、H2O)和3种离子(NH4+和OH-、极少量的H+).c.氨水的保存方法:氨水对许多金属有腐蚀作用,所以不能用金属容器盛装氨水.通常把氨水盛装在玻璃容器、橡皮袋、陶瓷坛或内涂沥青的铁桶里.d.有关氨水浓度的计算:氨水虽然大部分以NH3·H2O形式存在,但计算时仍以NH3作溶质.②跟氯化氢气体的反应:NH3 + HCl = NH4C1说明: a.当蘸有浓氨水的玻璃棒与蘸有浓盐酸的玻璃棒靠近时,产生大量白烟.这种白烟是氨水中挥发出来的NH3与盐酸挥发出来的HCl化合生成的NH4C1晶体小颗粒.b.氨气与挥发性酸(浓盐酸、浓硝酸等)相遇,因反应生成微小的铵盐晶体而冒白烟,这是检验氨气的方法之—.c.氨气与不挥发性酸(如H2SO4、H3PO4等)反应时,无白烟生成.③跟氧气反应: 4NH3 + 5O2 4NO + 6H2O说明:这一反应叫做氨的催化氧化(或叫接触氧化),是工业上制硝酸的反应原理之一.(4)氨气的用途:①是氮肥工业及制造硝酸、铵盐、纯碱的原料;②是有机合成工业如合成纤维、塑料、染料、尿素等的常用原料;③用作冰机中的致冷剂.2.铵盐铵盐是由铵离子(NH4+)和酸根阴离子组成的化合物.铵盐都是白色晶体,都易溶于水.(1)铵盐的化学性质:①受热分解.固态铵盐受热都易分解.根据组成铵盐的酸根阴离子对应的酸的性质的不同,铵盐分解时有以下三种情况:a .组成铵盐的酸根阴离子对应的酸是非氧化性的挥发性酸时,则加热时酸与氨气同时挥发,冷却时又重新化合生成铵盐。

氮族元素复习第一节氮和磷【考点解读】1.氮族元素核外电子排布、性质的相似性和递变规律2.氮气的分子结构及其化学性质3.氮氧化物的性质、相互转化、用途及对环境的污染4、磷的两种同素异形体的性质及用途【学习指导】氮族元素性质变化没有卤族元素性质变化明显,最好通过核外电子排布分析其存在价态,每种价态所对应物质,这样学习能够起到事半功倍的效果。
【基础与疑难突破】1.氮族元素核外电子排布、性质的相似性和递变规律(1)相似性①最外层都有5个电子,电子构型为ns2 np3,化合价主要有-3、+3和+5。
②气态氢化物的通式:RH3③最高价氧化物对应的水化物通式为HRO3或H3RO4(2)递变性原子结构的递变性:随着核电荷数的增大,电子层数增多,原子半径增大。
化学性质的递变性:①元素的非金属性减弱,金属性增强,N、P、As为非金属,Sb、Bi为金属。
②单质氧化性减弱,还原性增强。
③氢化物的稳定性减弱:NH3>P H3>AsH3④最高价氧化物对应水化物的酸性减弱:HNO3>H3PO4>H3 AsO4(3)氮族与同周期比较①最高价氧化物对应水化物的酸性:H3PO4<H2SO4<HCIO4②气态氢化物的稳定性:PH3<H2S<HCI2.氮气的分子结构及其化学性质(1)结构:电子式:,结构式:。
(2)化学性质:氮气(N≡N)的结构非常稳定,所以化学性质很稳定。
但要注意,N2一旦吸收能量变为N原子则性质较活泼。
+3H22NH3(氧化性)人工固氮N2+3Mg Mg3N2NMg3N2+6H2O=3Mg(OH)2+2NH3↑N2+O22NO(还原性)自然固氮例1:氮气与其他单质化合一般需要高温,有时还需高压等条件,但金属锂在常温、常压下就能与氮气化合生成氮化锂,这是因为()①此反应可能是吸热反应②此反应可能是放热反应③此反应可能是氮分子不必先分解成为原子④此反应前可能氮分子先分解成为原子A.①②B.②④C.②③D.①④解析:氮分子中存在N≡N,键能很大,非常牢固,通常情况下很难断裂N≡N键成为氮原子与其他物质反应,如果氮分子能与这种物质容易反应,只可能是氮分子不必先分解为氮原子这种情况;另外化学反应中放热反应一般比较容易发生。
高考化学一轮复习氮及其化合物复习题及答案一、选择题1.如图所示,将相同条件下的m体积NO和n体积O2同时通入倒立于水槽中且盛满水的试管内,充分反应后,试管内残留m2体积的气体,该气体与空气接触后立即变为红棕色。
则m与n的比值为()A.3∶2 B.2∶3 C.8∶3 D.3∶8【答案】C【详解】在一定条件下,将m体积NO和n体积O2同时通入倒立于水中且盛满水的容器中内,充分反应, NO和O2全部溶于水时按照下列反应进行,化学方程式为:4NO + 3O2+ 2H2O = 4HNO3,由于气体与空气接触后立即变为红棕色,所以容器内残留气体为NO,那么与O2反应的NO气体为m-m2=m2,NO和O2按照4:3混合溶于水恰好全部溶解所以mn2: =4 :3,所以m:n=8:3;故选C。
2.可用来干燥氨气的有( )A.浓硫酸B.碱石灰C.氯化钙D.五氧化二磷【答案】B【详解】因为氨气可以和酸反应,所以不能用浓硫酸和五氧化二磷等酸性干燥剂干燥;氯化钙可以吸收氨气生成八氨合氯化钙,所以也不能用氯化钙干燥氨气。
碱石灰是氧化钙和氢氧化钠组成的混合物,可以干燥氨气,所以本题选B。
3.四支试管中分别充满NO、SO2、NO2、Cl2中的一种,把它们分别倒置于盛有水的水槽中,放置一段时间后的现象如图所示。
其中原试管充满NO2的是A.B.C.D.【答案】B【详解】NO不溶于水,对应D图像,SO2在水中的溶解度为1体积水溶解40体积SO2,对应图像A,根据化学方程式3NO2+H2O=2HNO3+NO,剩余气体是反应前的1/3,对于图像B,Cl2+H2O =HCl+HClO,HClO2HCl+O2↑,对应图像C,所以其中原试管充满NO2的是B,答案选B。
4.某些离子的检验及结论一定正确的是()A.加入氢氧化钠溶液并加热,产生气体能使湿润的红色石蕊试纸变蓝,一定有NH4+ B.加入稀盐酸产生无色无味气体,将气体通入澄清石灰水中,溶液变浑浊,则一定有CO32-C.加入氯化钡溶液有白色沉淀产生,再加入盐酸沉淀不消失,一定有SO42-D.某溶液加入稀盐酸酸化的AgNO3产生白色沉淀,则原溶液中一定含有Cl-【答案】A【详解】A. 加入氢氧化钠溶液并加热,产生气体能使湿润的红色石蕊试纸变蓝,则说明该气体为氨气,推出原溶液中一定有NH4+,A项正确;B. 原溶液中若含HCO3-,加入稀盐酸后也会产生无色无味能使澄清石灰水变浑浊的气体,故原溶液中不一定有CO32-,B项错误;C. 产生不溶于盐酸的白色沉淀也可能是AgCl,则原溶液中不一定有SO42-,C项错误;D. 加入盐酸酸化的AgNO3溶液时,则引入了Cl-,故不能证明是原溶液中是否含有Cl-,D 项错误;答案选A。
氮族一、氮气1、结构2、物理性质3、化学性质二、氮的氧化物1、一氧化氮2、二氧化氮三、硝酸四、硝酸盐五、氨六、铵盐1.(2007年高考理综上海卷,氮族-固氮)将空气中氮气转化为氮的化合物的过程称为固氮。
下面能实现人工固氮的是( )(A)闪电(B)电解饱和食盐水车间(C)根瘤(D)合成氨车间[答案]D。
2.(2007年高考江苏卷,氮族-NO2)三聚氰酸[C3N3(OH)3]可用于消除汽车尾气中的NO2。
其反应原理为:C3N3(OH)3△3HNCO;8HNCO+6NO2△7N2+8CO2+4H2O,下列说法正确的是( )(A)C3N3(OH)3与HNCO为同一物质(B)HNCO是一种很强的氧化剂(C)1 mol NO2在反应中转移的电子为4 mol D)反应中NO2是还原剂[答案]C。
3.(2007年高考江苏卷,硝酸)某合金(仅含铜、铁)中铜和铁的物质的量之和为y mol,其中Cu的物质的量分数为a,将其全部投入50 mL b mol·L-1的硝酸溶液中,加热使其充分反应(假设NO是唯一的还原产物)。
下列说法正确的是( )(A)若金属有剩余,在溶液中再滴入硫酸后,金属又开始溶解(B)若金属全部溶解,则溶液中一定含有Fe3+(C)若金属全部溶解,且产生336 mL气体(标准状况),则b = 0.3(D)当溶液中金属离子只有Fe3+、Cu2+时,则a与b的关系为:b≥80y(1-a/3)[答案]AD。
[提示]若再加入硫酸,其中的NO3-在酸性条件下能继续氧化剩余的金属,A对;若金属全溶解,因为不知HNO3是否过量,铁可能是Fe2+,也可能是Fe3+,B错;HNO3的量应大于NO的量,即:0.05 L×b mol·L-1>0.336 L/22.4 L·mol-1,得b>0.3,C错;当溶液中金属只有Fe3+、Cu2+时,金属全部溶液,据反应3Cu+8HNO3 = 3Cu(NO3)2+2NO↑+4H2O,Fe+4HNO3 = Fe(NO3)3+NO↑+2H2O,知n(HNO3)≥n(Cu)×8/3+4n(Fe),即:0.05 L×b mol·L-1≥ay·8/3+4y(1-a),得b≥80y(1-a/3),D对。
人教高考化学一轮复习氮及其化合物 (讲义及答案)含答案解析一、选择题1.在如图所示的装置中,烧瓶中充满干燥气体a ,将滴管中的液体b 挤入烧瓶内,轻轻振荡烧瓶,然后打开弹簧夹f ,烧杯中的液体d 呈喷泉状喷出,最终几乎充满烧瓶。
则a 和b 分别是a(干燥气体) b(液体)A . 2NO 水B . 2SO4mol/LNaHSO 3溶液 C . Cl 2饱和NaCl 水溶液 D .3NH1mol/L 盐酸A .AB .BC .CD .D【答案】D 【详解】A.二氧化氮与水反应生成硝酸和NO ,所以不能充满烧瓶,故A 不选;B.二氧化硫和亚硫酸氢钠不反应,而且在亚硫酸氢钠中的溶解度极小,所以不能呈喷泉状喷出,故B 不选;C.氯气不溶于饱和食盐水,不能形成压强差,不能形成喷泉,故C 不选;D.氨气既能与盐酸反应生成氯化铵,又极易溶于水,导致烧瓶内的压强迅速减小,且反应后无气体剩余,烧杯中的液体b 呈喷泉状喷出且最终几乎充满烧瓶,故D 选; 答案选D 。
2.从某些性质来看,NH 3和H 2O 、NH 4+和H +、NH 2-和OH -、N 3-和O 2-两两类似。
据此判断,下列反应中正确的是( )①4232NH Cl NaNH NaCl NH ∆+→+↑ ②423222CaO NH Cl CaCl NH H O ∆+→+↑+③223233()4Mg NH Mg N NH ∆→+↑ A .仅①正确 B .②③正确 C .①③正确 D .全部正确【答案】D 【详解】①OH -和NH 2-相当,NH 3和H 2O 相当,依据NH 4Cl+NaOH=NaCl+NH 3+H 2O ;类推得到:NH 4Cl+NaNH 2═NaCl+2NH 3,故正确;②NH 4+和H 3O +相当,依据CaO+2HCl=CaCl 2+H 2O ,类推得到反应:CaO+2NH 4Cl= CaCl 2+2NH 3↑+H 2O ,故正确;③OH -和NH 2-相当,N 3-和O 2-两两相当,依据Mg (OH )2=MgO+H 2O ,类推得到:223233()4Mg NH Mg N NH ∆→+↑,故正确;因此上述三个反应都能够发生; 正确答案D 。
第一节 氮族元素
一、选择题 1.砷为第四周期ⅤA 族元素,根据在元素周期表中的位置推测,砷不可能具有的性质是( )。
A .砷在通常状况下为固体
B .可以有3-价,5+价等多种化合价
C .25As O 对应水化物的酸性比34H PO 弱
D .3AsH 稳定性比3PH 强
解答:本题考查ⅤA 族元素性质的递变规律。
解:砷在元素周期表中与N 、P 处在同一主族,随着原子序数的递增,单质状态由气态到固态递变,磷为固体,砷必为固体,所以选项A 正确;
ⅤA 族元素非金属均有3-价、3+价、5+价等多种化合价,所以选项B 正确;
随着原子序数的递增,元素的非金属性逐渐减弱,其最高价氧化物的水化物的酸性逐渐减弱,即33434HNO H PO H AsO >>,所以选项C 正确;
随着原子序数的递增,元素的非金属性逐渐减弱,其氢化物的稳定性逐渐减弱,所以选项D 错误。
本题答案为选项D 。
2.某主族元素R 原子的最外电子层上有5个电子,它的含氧酸的钾盐化学式不可能是( )。
A .3KRO B .34K RO C .2KRO D .24K RO
解答:本题考查ⅤA 族元素性质的递变规律。
ⅤA 族元素非金属均有3-价、3+价、5+价等多种化合价。
解:对绝大多数主族元素而言,最外层电子数与最高正价相等。
但不排除该元素存在其他正价的可能,只不过其他正价均小于最高正价。
选项D 中R 元素化合价为6+价,已超过了最外层电子数。
因此不可能。
本题答案为选项D 。
3.自然界中氮有两种同位素:147N 和15
7N 。
氮的相对原子质量为14.0037,而147N 原子百分数
为( )。
A .0.37%
B .48.3%
C .88.9%
D .99.63% 解答:本题考查元素相对原子质量的求算方法。
解:可用两种方法求解。
或判断:平均值极度偏向14,说明l4N 所占的比例极大。
本题答案为选项D 。
4.Bi 是原子序数最大的氮族元素,推测Bi 的化合物可能具有的性质是( )。
A .3BiH 很稳定 B .铋具有比铅更明显的非金属性 C .()3Bi OH 具有两性,但偏碱性 D .铋酸酸性比锑酸强
解答:本题考查ⅤA 族元素性质的递变规律。
ⅤA 族元素,随着原子序数的递增,元素的非金属性逐渐减弱,金属性逐渐增强。
解:随着原子序数的递增,气态氢化物的稳定性逐渐减弱,3BiH 不稳定,所以选项A 错误; 铋和铅位于同周期,随着原子序数的递增,元素的非金属性逐渐增强,因此铋具有比铅更明显的非金属性,所以选项B 正确; ()3Bi OH 呈碱性,所以选项C 错误;
随着原子序数的递增,元素的非金属性逐渐减弱,其最高价氧化物的水化物的酸性逐渐减弱,铋酸酸性比锑酸弱,所以选项D 错误。
本题答案为选项B 。
5.能证明氮元素比磷元素非金属性强的事实是( )。
A .氮气在常温下是气体,而磷单质是固体
B .氮气在空气中不能燃烧,而磷能在空气中燃烧
C .3NH 极易溶于水,而3PH 难溶于水
D .3NH 在空气中不可燃,而3PH 可燃
解答:本题考查元素的非金属性的判断。
元素的非金属性可用以下性质进行判断:单质的氧化性、氢化物的稳定性、最高价氧化物对应水化物的酸性。
解:只能说明单质的熔沸点逐渐增大,不能证明氮元素比磷元素非金属性强,所以选项A 不正确;
氮气中由于氮氮三键的键能很大,使氮气稳定,但不能说明单质的氧化性相对强弱,不能证明氮元素比磷元素非金属性强,所以选项B 不正确;
氨气与水分子间氢键的存在使3NH 极易溶于水,不能证明氮元素比磷元素非金属性相对强弱,所以选项C 不正确;
3NH 在空气中不可燃,而3PH 可燃,说明单质的氧化性氮气比磷强,能证明氮元素比磷元素
非金属性强,所以选项D 正确。
本题答案为选项D 。
6.现有X 、Y 两种ⅤA 族元素,下列事实不能说明X 的非金属性比Y 强的是( )。
A .两种元素所形成的酸的酸性强弱:3434H XO H YO > B .两种元素所形成气态氢化物的稳定性:33XH YH > C .两种元素所形成的最高价氧化物的稳定性:2525X O Y O > D .两种元素形成的气态氢化物的还原性:33YH XH >
解答:本题考查元素的非金属性的判断。
元素的非金属性可用以下性质进行判断:单质的氧化性、氢化物的稳定性、最高价氧化物对应水化物的酸性。
解:第ⅤA 族元素最高正价为5+价,所形成的最高价氧化物的水化物酸性强弱:3434H XO H YO >,能说明X 的非金属性比Y 强,所以选项A 正确;
所形成气态氢化物的稳定性:33XH YH >,能说明X 的非金属性比Y 强,所以选项B 正确; 所形成的最高价氧化物的稳定性:2525X O Y O >,不能说明X 的非金属性比Y 强,所以选项C 不正确;
气态氢化物的还原性:33YH XH >,能说明X 的非金属性比Y 强,所以选项D 正确。
本题答案为选项C 。
7.下列有关氮族元素物质性质的比较中,不正确...的是( )。
A .熔、沸点:Bi Sb > B .稳定性:33NH PH > C .活泼性:2P N > D .酸性:3434H PO H AsO >
解答:本题考查氮族元素性质的递变规律。
解:ⅤA 族元素,Sb Bi >,所以选项A 错误;
随着原子序数的递增,元素的非金属性逐渐减弱,其气态氢化物的稳定性逐渐减弱,所以选项B 正确;
氮氮三键的键能很大,使氮气性质稳定.但非金属性N P >,所以选项C 正确;
随着原子序数的递增,元素的非金属性逐渐减弱,其最高价氧化物的水化物的酸性逐渐减弱,所以选项D 正确。
本题答案为选项A 。
8.下列各组气态氢化物中,按稳定性由强.到弱.的顺序排列的是( )。
A .4SiH 、3PH 、2H S 、HCl B .HF 、HC1、HBr 、HI C .3NH 、3PH 、3AsH 、HF
D .3AsH 、3PH 、2H S 、HCl
解答:本题考查气态氢化物稳定性的判断。
气态氢化物的稳定性与元素的非金属性强弱有关,而元素非金属性的强弱可以由元素在元素周期表中的位置体现。
解:四种元素位于同周期,随着原子序数的递增,元素的非金属性逐渐增强,因此4SiH 、3PH 、2H S 、HCl 稳定性逐渐增强,选项A 错误;
四种元素位于同主族,随着原子序数的递增,元素的非金属性逐渐增强减弱,因此HF 、HCl 、HBr 、HI 稳定性逐渐减弱,选项B 正确;
四种元素非金属性强弱次离:F N P As >>>,因此稳定性333HF NH PH AsH >>>,选项C 错误;
四种元素非金属性强弱次序:As P S Cl <<<,因此稳定性332AsH PH H S HCl <<<,选项D 错误。
本题答案为选项B 。
二、填空题
9.在缺氧条件下,砷化氢受热分解能形成亮黑色的“砷镜”。
“砷镜”能被HClO 溶液所溶解,其生成物之一为砷酸。
这两个变化的化学方程式为___________________、
___________________。
解答:本题考查氧化还原反应方程式的书写。
解:砷化氢受热分解能形成亮黑色的“砷镜”,在氧化还原反应中元素化合价有升高,必有降低,可确认有氢气生成。
“砷镜”能被HClO 溶液所溶解,其生成物砷酸为氧化产物,可以推测还原产物为氯化氢。
本题答案为:
322AsH 2As 3H −−→+△
;23425HClO 3H O 2H AsO 5HCl As ++−−→+。
10.砷(As )的原子序数为33,在元素周期表中砷元素位于第__________周期第__________族,最高价氧化物对应的水化物的化学式为__________,气态氢化物的化学式为__________,砷酸可以用硝酸氧化23As O 而制得,同时硝酸被还原为NO ,写出反应的化学方程式:__________。
34Na AsO 在酸性条件下使KI 氧化为2I ,同时生成33Na AsO 和水,这个反应的离子方程式是__________。
解答:本题考查元素周期律的应用。
解:根据电子分层排布原理,33号元素的原子结构示意图为:。
根据元素原子的电子层分布与元素在元素周期表中的位置之间的关系,可以确认砷元素位于第四周期第ⅤA 族。
位于第ⅤA 族,可判断最高价为5+价,最低价为3-价,所以最高价氧化物对应的水化物为34H AsO (而非3HAsO ——类似磷酸),氢化物为3AsH 。
2332343As O 4HNO 7H O 6H AsO 4NO ++−−→+↑;334232AsO 2H 2I I AsO H O -+--++−−
→++。
本题答案为:砷元素位于第四周期第ⅤA 族。
最高价氧化物对应的水化物为34H AsO ,氢化物为3AsH ,
2332343As O 4HNO 7H O 6H AsO 4NO ++−−→+↑;334232AsO 2H 2I I AsO H O -+--++−−
→++。