第二章主族元素的金属有机化合物
- 格式:ppt
- 大小:1.48 MB
- 文档页数:79

人教版化学必修二全册知识点总结第一章物质结构元素周期表第一节元素周期表一、周期表周期表是根据元素的原子结构和性质,将元素按一定的顺序排列成表格的化学工具。
元素的原子结构是指元素的原子中包含的质子、中子和电子的数量和排列方式。
而元素的性质则是指元素在化学反应中表现出来的特征和行为。
周期表中的元素按照横行和纵列排列,其中横行称为周期,纵列称为族。
横行是按照元素的电子层数从左到右排列,纵列是按照元素的最外层电子数从上到下排列。
周期表中的元素按照周期和族的顺序排列,便于研究元素的周期性规律和性质。
二、元素的性质和原子结构一)碱金属元素:碱金属元素是指周期表中第一族元素,包括锂、钠、钾、铷、铯和钫。
这些元素的原子结构相似,最外层电子数都为1个。
随着核电荷数的增大,电子层数增多,原子半径增大。
这种递变性导致了物理性质的相似性和递变性。
碱金属元素的化学性质也有相似性和递变性,其中最明显的是它们的化合价都为+1.二)卤族元素:卤族元素是指周期表中第七族元素,包括氟、氯、溴、碘和石碳酸。
这些元素的原子结构相似,最外层电子数都为7个。
随着核电荷数的增大,电子层数增多,原子半径增大。
这种递变性导致了物理性质的递变性,包括颜色加深、密度增大和熔点、沸点升高。
卤族元素的化学性质也有递变性,其中最明显的是它们与氢气反应生成氢卤酸。
总结:周期表是研究元素周期性规律和性质的重要工具。
碱金属元素和卤族元素都具有原子结构相似性和递变性,导致了它们的物理性质和化学性质的相似性和递变性。
这些规律和性质的研究有助于我们更深入地理解元素的本质和行为。
原子核外电子按照能量从低到高的顺序填充到各个能级上,每个能级最多容纳一定数量的电子。
3、能级的编号:K、L、M、N、O、P、Q(从内到外依次编号)4、能级的容纳电子数:K层2个电子,L层8个电子,M层18个电子,N层32个电子,O层50个电子,P层72个电子,Q层98个电子。
二.元素周期律1、元素周期律:将元素按照原子序数大小依次排列,具有相似化学性质的元素周期性地出现在同一周期中。



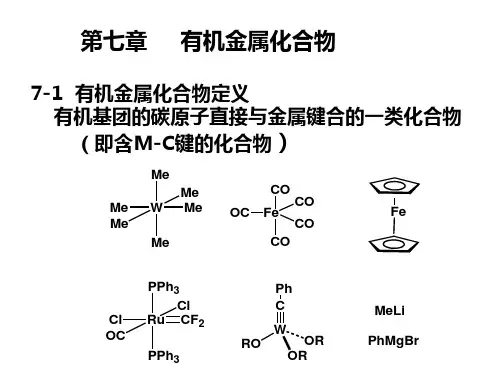
课题6. 金属有机化合物二茂铁及其衍生物的合成与性能研究6.1研究课题背景金属有机化合物是指含有一个或多个C-M键(σ键或π键)的化合物,M主要指金属原子,有时也包括非金属原子硼、硅等。
通常金属有机化合物依据金属被分为活泼金属有机化合物和过度金属有机化合物两大类,前者相对简单,而过渡金属有机化合物的内容要丰富得多,是当代化学的前沿领域之一,逐步形成为发展极为活跃、迅速和极富生命力的新兴学科。
第一个金属有机化合物是1827年Zeise合成的Zeise盐KPtCl3(CH2=CH2),其后虽然陆续制得含C-M σ键的锌、汞、锡的金属烷基化合物,但在此后的一百多年里,有机金属化合物并没有得到人们充分的认识和理解。
早期的金属有机化合物研究主要局限于第AⅠ、第AⅡ主族金属元素上,Reformatsky反应(1887年)、Ullmann(1904年)和Grignard反应(1912年)等有限的几个反应的发现显示了其在有机合成中的独特魅力,但是这些反应的发现和应用是孤立的,并未能引起对整个金属有机化学的重视。
直到1951年,T.J.Kealy和P.J.Pauson 意外地合成了二茂铁(Ferrocene),次年,G.Wilkinson和R.B.Woodward通过红外光谱、磁化率以及偶极矩的测定,判定二茂铁是具有夹心结构(sandwich strucyure)的金属π配合物,E.D.Fiseher等人后来通过x射线衍射的研究,认为二茂铁具有五角反棱柱的结构。
伴随着二茂铁结构和性能的研究,Zeigler-Natta烯烃聚合催化剂的发现(1953年)和乙烯催化(PdCl2-Cu+/Cu++)氧化合成乙醛的Wacker方法的相继问世(1957年),过渡金属有机化合物引起整个化学界的强烈震撼和重视。
自此以后,二茂铁及其衍生物的合成、结构与性质的研究数十年方兴未艾,二茂铁衍生物新物种层出不穷,使金属有机化学的发展,特别是过渡金属有机化学的发展出现了一个空前飞跃,开辟了金属有机化学的一个新领域,这些研究工作也极大地推动了化学键理论和结构化学的迅速发展。

-金属有机化学1.序言2.主族金属有机化学3.过渡金属有机化学4.稀土金属有机化学5.有机合成中的金属有机化学6.金属有机化学催化反应一、序言1. 定义:金属有机化学是研究含有金属-碳键的化合物的化学,包括合成、结构、反应性质及催化性能等。
其中金属包括硼、硅、砷等类金属。
严格区分:有机金属化合物 M -C金属有机化合物 M -O ,M -N ,M -C金属有机化学是无机化学和有机化学的交叉学科,既可以归属于无机化学,也可以归属于有机化学。
2. 发展史1760年 合成第一个金属有机化合物1827年 合成第一个过渡金属有机化合物(第一个含烯烃的金属有机化合物)Zeise’s 盐,Na[Pt(C 2H 4)Cl 3]1849年 E. Frankland 用氢气作保护气体3C 2H 5I + 3Zn → (C 2H 5)2Zn + C 2H 5ZnI + ZnI 21890年 第一个有工业应用价值的金属有机化合物Ni(CO)4,可用于提纯金属镍。
1901年 格氏试剂的发现,V . Grignard (1912年诺贝尔奖)RX + Mg → RMgX1919年 H. Hein, CrCl 3 + PhMgBr → Ph 2Cr1925年 Fischer-Tropsch 反应的发现,其机理的研究目前仍然是金属有机化学的一个重要研究领域,可能是先生成M -C 或者M =C 。
1938年 O.Roelen 发现氢甲酰化反应(Hydroformylation, oxo process)。
PdCl 2催化乙烯水合生成乙醛。
1938~1945年 Reppe 合成的发展CO + H 2 + CH 2=CH 2 → CH 3CH 2CHO1951年 二茂铁的发现 FeCl 2 + C 5H 5- → Fe(C 5H 5)2,导致烯烃-金属π络合物理论的提出。
1953年 Wittig 反应的发现,利用膦叶立德合成烯烃的方法1955年 Ziegler-Natta 催化剂的发现 MCl 3/AlR 3催化烯烃低压聚合 "Cadet's fuming liquid" [(CH 3)2A s]2O A s 2O 3 + 4CH 3COOK1956年H. C. Brown 硼氢化反应的发现,符合反马可夫尼可夫原则,R 2B 接在最少取代的碳原子上。



《金属有机化学》作业一选择题1.最早的哪个金属有机化合物是1827年由丹麦药剂师Zeise合成的。
()A. (CH3)4TiB. K[Pt(C2H4)Cl3]C. (CH3)2HgD. CH3MgCl2.二茂铁(C5H5)2Fe属于哪一类非经典键合的化合物?()A. M—C键中为缺电子型键B. M—C键中碳原子为π键电子给予体的多中心键化合物C. M—C键以夹心型键形成的π键化合物D. M—C键以σ—π配键形成的化合物3.烯烃和B—H键的加成遵循以下哪个规则?()A. Markovnikov规则B. 反Markovnikov规则C. Zaitsev规则D. 反Zaitsev规则4.下列有关烷基铝说法不正确的是()A.烷基铝化合物是缺电子化合物B.烷基铝化合物一般是强的Lewis酸C.当三烷基铝的烷基为烷氧基所取代后,烷基铝化合物的反应性即降低。
D.从烷基铝和烯烃的反应能得到有很长链的烷基的化合物5.Ni(CO)4的几何构型是()A.正四面体型 B. 正方锥型 C.八面体型 D. 三角锥型6.Si—C键的反应性一般比C—C键的反应性为()A. 大B. 小C. 相等D. 不确定7.下列采用sp3杂化轨道成键的是()A. Cr(CO)6B. Fe(CO)5C. Ni(CO)4D. [Ag(CN)2]-8.Fred属于下列哪类配合物?()A. 混合配体羰基金属配合物B. 单核全羰基金属配合物C. 双核羰基金属配合物D. 原子簇配合物9.炔烃配体配合物中炔配体提供给金属的电子数是()A.4B.3C.2D.110.下列不属于类环戊二烯基配体的是()A. B. C. D.11.IA族金属的烷基物和芳基物的活性正确的是()A. Li-R<Na-R<K-R<Rb-R<Cs-RB. Li-R<K-R<Na-R<Rb-R<Cs-RC. Cs-R<Rb-R<K-R<Na-R<Li-RD. Cs-R<Rb-R<Na-R<K-R<Li-R12.Ni(CO)4属于哪一类非经典键合的化合物?()A. M—C键中为缺电子型键B. M—C键中碳原子为π键电子给予体的多中心键化合物C. M—C键以夹心型键形成的π键化合物D. M—C键以σ—π配键形成的化合物13.铝氢化物中最重要的是氢化铝锂,LiAlH4是重要的()A.还原剂 B. 氧化剂C. 催化剂D.脱水剂14.Fe(CO)5的几何构型是( )A. 正四面体型B. 正方锥型C. 三角锥型D. 八面体型15.Si —C 键的反应性一般比C —C 键的反应性为( )。


一、选择题1.下列各项中表达正确的是 A .F -的结构示意图: B .CO 2的分子模型示意图:C .CSO 的电子式:D .HClO 的结构式:H —Cl —O答案:C 【详解】A .F -的最外层含有8个电子,F -的结构示意图:,故A 错误;B .二氧化碳为直线型结构,碳原子半径大于氧原子半径,则CO 2的分子模型示意图:,故B 错误;C .CSO 属于共价化合物,C 与O 、S 分别形成2个共用电子对,则CSO 的电子式:,故C 正确;D .次氯酸的结构式:H-O-Cl ,O 、Cl 均满足最外层8电子稳定结构,故D 错误; 故选C 。
2.下列说法不正确的是( ) ①24N H 分子中既含极性键又含非极性键②若2R -和+M 的电子层结构相同,则原子序数:R>M ③2F 、2Cl 、2Br 、2I 熔点随相对分子质量的增大而升高 ④3NCl 、3PCl 、2CO 、2CS 分子中各原子均达到8e -稳定结构 ⑤固体熔化成液体的过程是物理变化,所以不会破坏化学键 ⑥HF 分子很稳定是由于HF 分子之间能形成氢键 ⑦由于非金属性:Cl>Br>I ,所以酸性:HCl>HBr>HI A .②⑤⑥⑦ B .①③⑤C .②④⑤D .③⑤⑦答案:A 【详解】24N H 分子中N 原子之间形成非极性共价键,N 原子和H 原子之间形成极性共价键,①正确;若2R -和M +的电子层结构相同,则M 处于R 的下一周期,所以原子序数:M R >,②错误;2F 、2Cl 、2Br 、2I 的组成和结构相似,熔点随相对分子质量的增大而升高,③正确;3NCl 、3PCl 、2CO 、2CS 分子中各原子均满足最外层电子数8+=化合价,则均达到8e -稳定结构④正确;固体熔化成液体的过程是物理变化,但可能破坏化学键,例如氢氧钠熔化时离子键被破坏,⑤错误;HF分子很稳定,是因为H F-键键能大,与分子间氢键无关,⑥错误;元素的非金属性越强,其最高价氧化物对应水化物的酸性越强,但氢化物的酸性变化无此规律,酸性:HCl HBr HI<<,⑦错误。
第二章主族元素的金属有机化合物主族元素的金属有机化合物是指含有主族元素金属和碳元素的化合物。
这类化合物具有独特的化学性质和应用价值,可以广泛应用于有机合成、催化剂、光电材料等领域。
本文将对主族元素的金属有机化合物进行详细介绍。
一、有机锂化合物有机锂化合物是最常见的主族元素的金属有机化合物之一、它们通常由金属锂与卤代烃反应得到。
有机锂化合物具有反应活性强、易与其他化合物发生反应等特点,因此在有机合成中得到广泛应用。
例如,有机锂试剂可以作为亲核试剂参与亲电加成反应,从而实现碳-碳键的构建;同时,有机锂试剂还可以用于合成取代基多的有机化合物。
二、有机硼化合物有机硼化合物是另一类重要的主族元素的金属有机化合物。
它们通常由金属硼烷与卤代烃反应得到。
有机硼化合物具有独特的化学性质,可以作为有机合成中的重要试剂。
例如,一些具有硼取代基的有机硼化合物可以与有机羰基化合物进行加成反应,得到取代基多的有机化合物;另外,有机硼化合物还可以用于构建碳-硼键,从而实现新的有机化合物的构建。
三、有机锗化合物有机锗化合物也是主族元素的金属有机化合物中的一种。
它们通常由重金属锗与卤代烃反应得到。
有机锗化合物具有独特的结构和性质,可以应用于光电材料、生物活性物质等方面。
例如,一些具有锗取代基的有机锗化合物可以用作有机发光材料,具有很强的荧光发射性质;此外,有机锗化合物还可以用于合成新型的生物活性分子,具有潜在的药物研发价值。
四、有机锑化合物有机锑化合物也是主族元素的金属有机化合物的一类代表。
它们通常由金属锑与有机卤化物反应得到。
有机锑化合物在有机合成中具有广泛应用,特别是在催化剂领域。
例如,一些具有锑取代基的有机锑化合物可以用作光催化剂,可以通过光照下的电子转移过程进行还原或氧化反应;此外,有机锑化合物还可以用于合成特殊的有机合成试剂,具有催化剂的效果。
总之,主族元素的金属有机化合物是一类具有独特性质和广泛应用价值的化合物。
有机锂化合物、有机硼化合物、有机锗化合物和有机锑化合物等都在有机合成、催化剂、光电材料等领域得到了广泛应用。
一、选择题1.(0分)[ID :139545]科学研究表明,PCl 5在气态条件下为分子形态,在熔融条件下能发生电离: 2PCl 5PCl +4+PCl -6,下列说法错误的是 A .PCl 5分子中的化学键为极性键B .PCl 5在熔融状态下具有一定的导电性C .PCl +4呈正四面体构型 D .PCl -6中P 只用3s 、3p 轨道参与成键2.(0分)[ID :139599]下列说法中正确的是A .随着核电荷数的递增同主族元素的单质熔点不断升高B .草酸二甲酯分子中σ键和π键个数比为6:1C .DNA 的双螺旋结构与氢键无关D .原子的价电子排布为(n-1)d 6~8ns 2的元素一定位于元素周期表d 区3.(0分)[ID :139590]X 元素的简单阳离子和Y 元素的简单阴离子的核外电子层结构相同,下列叙述正确的是A .简单离子半径:X>YB .原子半径:X<YC .原子序数:X<YD .原子最外层电子数:X<Y 4.(0分)[ID :139577]短周期主族元素X 、Y 、Z 、W 的原子序数依次增加,K 、L 、M 均是由这些元素组成的氧化物,甲、乙分别是元素Y 、W 的单质,甲是常见的固体,乙是常见的气体。
K 是红棕色气体,丙的浓溶液具有强氧化性,上述物质的转化关系如图所示。
下列说法不正确的是( )A .Y 、Z 、W 三种元素电负性:W>Z>YB .Y 、Z 、W 三种元素的第一电离能:W>Z>YC .Y 、Z 、W 与氢元素均可形成含非极性键的二元化合物D .由X 、Y 、Z 、W 构成的化合物中可能含有离子键5.(0分)[ID :139575]下列有关说法正确的是A .氧原子处于基态的轨道表示式B .用价层电子对互斥理论预测3NH 的空间结构为三角锥形C .用电子式表示2MgCl 的形成:D .向5%的22H O 溶液中加入2MnO 粉末后,分解速率迅速加快是因为2MnO 粉末降低了反应的焓变6.(0分)[ID :139569]意大利罗马大学的 FulvioCacace 等人获得了极具理论研究意义的气态 N4分子,其分子结构如图所示。
系列二主族金属专题2 皱及其化合物在自然界中,以硅彼石Be4Si2O7(OH)2和绿柱矿Be3Al2Si6Oi8等矿物存在。
绿柱石由于含有少量杂质而示出不同的颜色。
如含2%的Cr3+离子呈绿色。
亮蓝绿色的绿柱石称为海蓝宝仃,深绿色的绿柱仃称为祖母绿。
(1)皱表而易形成氧化层,减小了金属本身的活性。
根据对角线规则,Be与AI的性质相似,这一点与Ll 和Mg的相似性原理相同。
披相同是典型的两性金属。
(2)还原性:它与6, N2, S反应,生成BeO, Be3N2和BeS。
它与碳反应生成Be2C碳化物(与AI4C3同类,类似的还有BeCl2和AICI3均为共价化合物,易升华,易溶于有机溶剂),而英他碱土金属的碳化物都是MC2 型。
2Be + O2^=2BeO, 3Be+ N2^=Be3N2, Be + S^=BeS(3)类比学AIBe与AI的性质的相似性①二者均不仅能溶于酸溶液,也能溶于碱溶液,放出H》但披、铝与冷的浓硝酸接触,发生“钝化”现象。
Be÷2NaOH+2H2O=Na2[Be(OH)4]+H*或Be+2NaOH=Na2BeO2+H2T:2A1+2NaOH+6H2O=2Na[Al(OH)4] + 3H2↑或2Al+2NaOH+2H20=2NaA102÷3H2↑o②二者的氢氧化物均为两性氢氧化物,易溶于强碱溶液。
Be(OH)2+2NaOH=Na2 [Be(OH)4]或Be(OH)2+2NaOH=Na2BeO2+2H2O:Al(OH)3+NaOH=NatAl(OH)4]或AI(OH)3+NaOH=NaAKh+2吐0。
③彼、铝的盐都易水解。
如BeS+2H2O=≥Be(OH)2+H2S,而A12S3也有相同的性质(4)制备①还原BeF2,用此法制备存在许多困难,该反应强烈放热甚至会导致爆炸。
且最终体系内物质沸点结晶,导致Be与MgF2分离比较困难。
BeF2 + Mg^=MgF2 + Be②电解熔融盐。