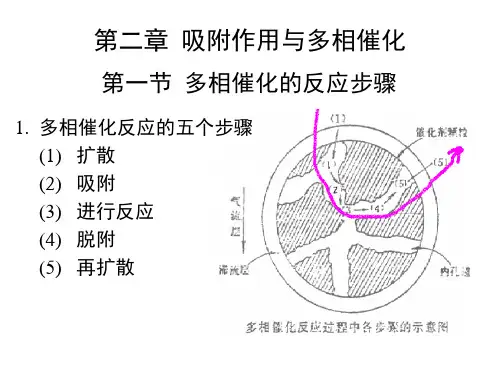
吸附作用与多相催化
- 格式:ppt
- 大小:7.37 MB
- 文档页数:60


多相催化反应机理
多相催化反应是指在反应中存在两个或更多的相,如气体与固体的催化反应、液体与固体的催化反应等。
其机理可以分为以下几个步骤:
1. 吸附:反应物进入固体催化剂表面,通过吸附与催化剂发生物理或化学吸附作用。
这一步通常是决定整个反应速率的关键步骤,在反应过程中会产生吸附物。
2. 表面反应:吸附物上的反应物与其他吸附物相互作用,发生化学反应。
这一步骤通常是反应物转化为产物的关键步骤,其速率取决于吸附物的浓度和反应物之间的相互作用强度。
3. 解吸:反应物与产物从催化剂表面解吸,离开催化剂,进入反应体系中。
解吸过程可能是可逆的,有时会回到吸附阶段。
以上是一个基本的多相催化反应机理,在实际的多相催化反应中,还可能存在其他的步骤或中间体。
催化剂的种类和特性以及反应条件(如温度、压力、溶剂等)也会对反应机理产生影响。





多相催化中的化学吸附
化学吸附是指物质在能量作用下,由于化学键的形成而使表面上原本相对稳定的反应物分子被吸附到催化剂表面,从而具有物理吸附所不具备的化学性质,因此又称作“化学吸附”。
一般来说,化学吸附可以分为单相催化反应和多相催化反应两种。
多相催化中的化学吸附,是指在多相催化反应过程中,反应物分子在固体表面上受到表面官能团作用而形成化学键,使反应物分子产生新的化学性质,从而促进反应的进行。
多相催化反应中,化学吸附的作用可以分为活性位点的形成和反应物的激活两部分。
活性位点的形成是指在固体表面上,由于官能团的作用,使反应物分子形成一系列新的有机分子结构,这些有机分子结构就是活性位点。
活性位点的形成是促进反应进行的关键环节,因为它可以使反应物产生新的化学性质,从而使反应能够进行下去。
另外,多相催化反应中,化学吸附还可以激活反应物,激活反应物即使反应物分子在发生反应之前,能够达到它能够发生反应的活性能状态,也就是说反应物本身的能量可以被激活,从而使反应物更容易发生反应。

多相催化反应器工作原理多相催化反应器是一种常见的化学反应设备,广泛应用于工业生产中。
它通过在反应物和催化剂之间形成多相界面,加速化学反应的进行。
本文将详细介绍多相催化反应器的工作原理。
多相催化反应器中,催化剂通常存在于固体或液体相中,而反应物则存在于气体或液体相中。
催化剂的作用是提供反应物分子之间的反应位,从而降低反应的活化能,加速反应速率。
多相催化反应器的工作原理可分为吸附和反应两个阶段。
在吸附阶段,反应物分子首先与催化剂表面发生物理或化学吸附,形成吸附物种。
吸附作用使反应物分子靠近催化剂表面,提供了反应的反应位,促进反应的进行。
吸附物种的形成取决于反应物与催化剂之间的相互作用力,包括物理吸附和化学吸附。
物理吸附是反应物分子与催化剂之间的弱相互作用力,如范德华力和静电力。
物理吸附通常发生在低温和高压条件下,吸附物种较为不稳定,易于脱附。
相比之下,化学吸附是反应物分子与催化剂之间的化学键形成,通常需要较高的温度和压力。
化学吸附产生的吸附物种较为稳定,能够在反应中参与反应。
在反应阶段,吸附物种与其他吸附物种或反应物分子发生反应,形成产物。
反应物分子在吸附物种之间发生反应,通过吸附物种之间的扩散传递质量和能量,实现反应的进行。
反应阶段的速率受到吸附物种的浓度、反应物浓度、反应物分子间的相互作用力等因素的影响。
多相催化反应器的设计需要考虑催化剂的选择、反应物的输送和分离,以及反应器的运行条件等因素。
催化剂的选择应考虑其活性、稳定性和选择性,以确保反应的高效进行。
反应物的输送和分离可以通过流化床、固定床、搅拌反应器等方式实现。
反应器的运行条件需要根据反应的特性进行调节,包括温度、压力和反应物浓度等。
总之,多相催化反应器通过在反应物和催化剂之间形成多相界面,加速化学反应的进行。
其工作原理涉及吸附和反应两个阶段,吸附物种提供反应的反应位,促进反应物分子之间的反应。
多相催化反应器的设计需要考虑催化剂选择、反应物的输送和分离,以及反应器的运行条件等因素。

第二章吸附作用一、概述凡气固多相催化反应,都包含吸附步骤.在反应过程中,至少有一种反应物参与吸附过程.多相催化反应的机理与吸附的机理不可分割.固体表面是敞开的,表面原子所处的环境与体相不同,配位不饱和,它受到了一个不平衡力的作用,当气体与清洁固体表面接触时,将与固体表面发生相互作用,气体在固体表面上出现了累积,其浓度高于气相,这种现象称吸附现象( adsorption).与吸收(absorption)不同,吸收发生在体相. 吸附气体的固体物质称为吸附剂.被吸附的气体称为吸附质.吸附质在表面吸附以后的状态称为吸附态.吸附发生在吸附剂表面的局部位置上,这样的位置就叫吸附中心或吸附位.吸附中心与吸附的物质共同构成表面吸附络合物.当固体表面上的气体浓度由于吸附而增加时,称吸附过程,反之,当气体在表面上的浓度减小时,则为脱附过程.二、物理吸附与化学吸附吸附可以分为物理吸附与化学吸附两种.它们的作用力不同.物理吸附是由分子间作用力,即van der W alls 力所产生.由于这种力较弱,故对分子结构影响不大,所以可把物理吸附类比为凝聚现象.化学吸附的作用力属于化学键力(静电与共价键力).由于此种力作用强,涉及到吸附分子和固体间的电子重排、化学键的断裂或形成,所以对吸附分子的结构影响较大.吸附质分子与吸附中心间借此种力形成吸附化学键.化学吸附类似化学反应.由于产生吸附的作用力不同,两种吸附有不同的特征,两者主要特征比较见表2.1.表2.1物理吸附与化学吸附主要特征比较化学吸附物理吸附.(A) 吸附热≥80kJ·mol-10-40kJ·mol-1这是化学吸附的充分,但不是必要的条件(B) 吸附速率常常需要活化,所以速率慢因不需活化,速率快(C) 脱附活化能≥化学吸附热凝聚热(D) 发生温度常常在高温下(高于气体的液化点)接近气体的液化点(E) 选择性有选择性,与吸附质、吸附剂的本性有关无选择性,任何气体可在任何吸附剂上吸附(F) 吸附层单层多层(G) 可逆性可逆或不可逆可逆表2.2和表2.3提供了某些气体的液化潜热、物理吸附热与化学吸附热,以供比较.表2.2某些气体的液化潜热和最大物理吸附热[4]Gas H2O2N2CO CO2CH4C2H4C2H2NH3H2O Cl2 q(kJ/mol) 0.92 6.69 5.61 6.02 25.10 9.12 14.64 24.01 23.26 44.22 18.41 q max(kJ/mol) 8.4 20.9 20.9 25.1 37.7 20.9 33.5 37.7 37.7 58.6 35.6表2.3某些气体的化学吸附热Q(kJ/mol)[4]气体Ti Ta Nb W Cr Mo Mn Fe Co Ni Rh Pt H2188 188 167 71 134 117O2720 494 293 N2586 293CO 640 192 176CO2682 703 552 456 339 372 222 225 146 184NH3301 188 155C2H4577 427 427 285 243 209三、吸附位能曲线吸附过程中,吸附体系(吸附质—吸附剂)的位能变化可以用吸附位能图表示.对大多数物理吸附而言,其位能变化原则上可以使用Lennard-Jones曲线来描述,该曲线原来是用以描述两个气体分子质点在相互靠近时的位能变化.当然在吸附场合就不单单是两个质点间的相互作用,而是吸附分子与表面上的许多原子间的相互作用.这种相互作用的总位能是吸附分子与每一个表面原子作用能量的加合.对这种加合,Lennard-Jones曲线给出的描述基本上是正确的.图2.1是表示分子物理吸附中位能变化的Lennard-Jones图,其中的X表示分子A2距表面无限远位能取作零时与表面的距离.随着分子与表面的接近,位能下降,到Y时发生了物理吸附,放出吸附热Q p,这是物理吸附热.当分子再靠近表面,因排斥作用增强、吸引作用相对减弱,使体系位能上升,由于稳定性原因,体系不能在这样的状态稳定存在.图2.1 A2分子在固体表面S上的物理吸附位能曲线[6]描述活性原子在固体表面上化学吸附的位能变化可用Morse公式近似计算得到,见图2.2的曲线.对大多数化学吸附来说,这种图给出的形状也是类似的.图2.2 活性原子A在固体表面S上的吸附位能曲线[6]X表示活性原子A与表面相距很远时的体系位能。