物质构成的奥秘知识点归纳(有答案)
- 格式:doc
- 大小:84.50 KB
- 文档页数:2

一、选择题1.关于下列四种粒子的说法正确的是A.X、Y、M均是已形成稳定结构离子B.粒子Y若失去一个电子就可以变成原子C.它们表示四种元素D.上述粒子中有两个是离子,两个是原子D解析:DA、最外层电子数达到8电子,为相对稳定结构,则X、Y、M均是已形成相对稳定结构,但M的质子数=核外电子数,为原子,不是离子,故A不正确;B、在原子中,质子数=核外电子数,Y的质子数为19,核外电子数为18,则粒子Y若得到一个电子就可以变成原子,故B不正确;C、元素是具有相同质子数的一类原子的总称,质子数分别为17、19、18、17,则它们表示三种元素,故C不正确;D、X是氯离子,Y是钾离子,M是氩原子,N是氯原子,上述粒子中有两个是离子,两个是原子,故D正确。
故选D。
2.下列说法正确的是A.同种分子构成的物质是纯净物,纯净物一定由同种分子构成B.所有的原子都是由质子、中子和电子构成C.金属元素有正化合价,因此非金属元素一定没有正化合价D.最外层电子数是8的原子一定是稀有气体元素的原子D解析:DA、同种分子构成的物质是纯净物,但纯净物不一定由同种分子构成,也可能是原子或离子构成,故选项说法错误。
B、并不是所有的原子都是由质子、中子、电子构成,如氢原子没有中子,选项说法错误。
C、在化合物中,金属元素通常显正价,显正价的不都是金属元素,例如在二氧化碳中碳元素显正价,就不是金属元素,故选项说法错误。
D、最外层电子数为8的原子一定是稀有气体元素的原子,例如氖原子,选项说法正确。
故选:D。
3.宜昌磷矿资源丰富。
已知一个磷原子核内含有15个质子,相对原子质量为31,则磷原子的核外电子数为A.8B.15C.16D.31B解析:B【分析】原子中,核内质子数=核电荷数=核外电子数,已知核内质子数为15,则核外电子数为15;故选B。
【点睛】4.下列说法正确的是()A.钠原子失去一个电子就变成稀有气体元素氖的原子B.氯原子得到一个电子后,就变成了与氩原子核外电子排布相同的阴离子C.两种离子,核外电子排布相同,化学性质一定相同D.原子最外层电子数少于4个的元素,一定是金属元素B解析:BA、原子失去电子后原子核没有变化,故质子数不会变化,所以原子的种类就不会变化;错误;B、氩原子核外有18个电子,而氯原子得到一个电子后核外也有18个电子,故会变成了和氩原子电子层结构相同的阴离子;正确;C、两种粒子,核外电子排布情况相同,化学性质不一定相同,例如氖原子和钠离子,只能说都比较稳定,但化学性质不可能相同;错误;D、原子最外层电子数小于4的元素,不一定是金属元素,如氢原子;错误;故选:B。

九年级化学上册第三单元物质构成的奥秘知识点梳理单选题1、考古学家通过测定碳14的含量等方法将人类生活在黄土高原的历史推前至距今212万年。
碳14原子的核电荷数为6,相对原子质量为14,则该原子核外电子数为 A .6B .8C .14D .20 答案:A原子中,质子数=核电荷数=核外电子数,故A 正确。
2、下列化学用语中,数字“2”的说法正确的是①2H;②2NH 3;③SO 2;④Cu +2O;⑤Mg 2+;⑥2OH -;⑦H 2O A .表示离子个数的是⑤⑥ B .表示离子所带电荷数的是④⑤ C .表示分子中原子个数的是③⑦ D .表示分子个数的是①② 答案:CA 、元素符号右上角的数字表示离子所带电荷的数目,即⑤中Mg 2+中的2表示1个镁离子带2个单位的正电荷,选项错误;B 、化学式中,元素符号正上方的数字表示元素的化合价,即④中Cu +2O中的2表示氧化铜中铜元素的化合价为+2价,选项错误;C 、化学式中,元素符号右下角的数字表示分子中原子的个数,即③中SO 2中的2表示1个二氧化硫分子中含有2个氧原子,⑦中H 2O 中的2表示1个水分子中含有2个氢原子,选项正确;D 、元素符号前面的数字表示原子的数目,即①中2H 中的2表示2个氢原子,选项错误,故选C 。
3、荷叶中含有的荷叶碱(化学式为C 19H 21NO 2)具有降脂、抑菌等作用。
下列有关荷叶碱的说法,正确的是 A .含有O 2B .由四种非金属元素组成C .属于氧化物D .其中氢元素的质量分数最大 答案:BA. 荷叶碱由荷叶碱分子构成,是纯净物,不含其他物质,不含氧气。
错误。
B. 物质由元素组成,荷叶碱由碳、氢、氮、氧四种非金属元素组成。
正确。
C. 氧化物是由两种元素组成,其中一种是氧元素的化合物。
荷叶碱由四种元素组成,不是氧化物。
错误。
D. 荷叶碱中碳、氢、氮、氧元素的质量比为(12×19):(1×21):(14×1):(16×2),碳元素占比最大,所以碳元素的质量分数最大,错误。

最新物质构成的奥秘知识点总结及经典习题(含答案)(word)一、物质构成的奥秘选择题1.关于分子、原子、离子的说法正确的是()A.原子是最小的粒子,不可再分B.分子、原子、离子都可以直接构成物质C.蔗糖溶于水是由于蔗糖分子变成了水分子D.钠原子的质子数大于钠离子的质子数【答案】B【解析】试题分析:构成物质的基本微粒有分子、原子、离子,根据微粒的特征分析。
A、原子是化学变化中的最小粒子,但原子仍可以再分,分成原子核和核外电子,错误;B、分子、原子、离子都可以直接构成物质,正确;C、蔗糖溶于水,是因为蔗糖分子在不断运动,并最终进入水分子间,错误;D、钠原子和钠离子都属于钠元素,故质子数相同,错误。
故选B考点:分子、原子、离子、元素与物质之间的关系点评:理解和熟记分子、原子、离子、元素与物质之间的关系,以及与之相关的知识,是解题的关键。
2.下列粒子结构示意图中表示阴离子的是()A.B.C.D.【答案】C【解析】【分析】【详解】A、核内质子数=12>核外电子数=10,属于阳离子,故A不符合题意;B、核内质子数=核外电子数=10,属于原子,故B不符合题意;C、核内质子数=8<核外电子数=10,属于阴离子,故C符合题意;D、核内质子数=11>核外电子数=10,属于阳离子,故D不符合题意。
故选C3.生活中废弃的铝质易拉罐、破铁锅、废铜线等可归为一类加以回收,它们属于()A.化合物B.金属或合金C.氧化物D.非金属【答案】B【解析】铝质易拉罐、破铁锅、废铜线都属于废旧金属材料,主要成分是金属单质或合金,与有机物氧化物非金属无任何关系,应属于金属或合金.点评:此题是对废旧金属的考查,属于废旧金属回收的知识,属基础性知识考查题.4.如图所示的是氧原子的结构示意图和氧元素在元素周期表中的信息。
下列说法错误的是( )A.x=2B.氧原子在化学反应中容易失去电子C.氧属于非金属元素D.氧的相对原子质量是16.00【答案】B【解析】A、由原子结构中质子数=电子数可知,8=x+6,x=2,正确;B、由氧原子结构示意图可知,最外层电子数为6>4,故氧原子在化学反应中容易得到电子,错误;C、由汉字氧带“气字头”,不带“金字旁”可知,氧属于非金属元素,正确;D、由元素周期表中一格的信息可知,最下方的数字表示相对原子质量,故氧的相对原子质量是16.00,正确。
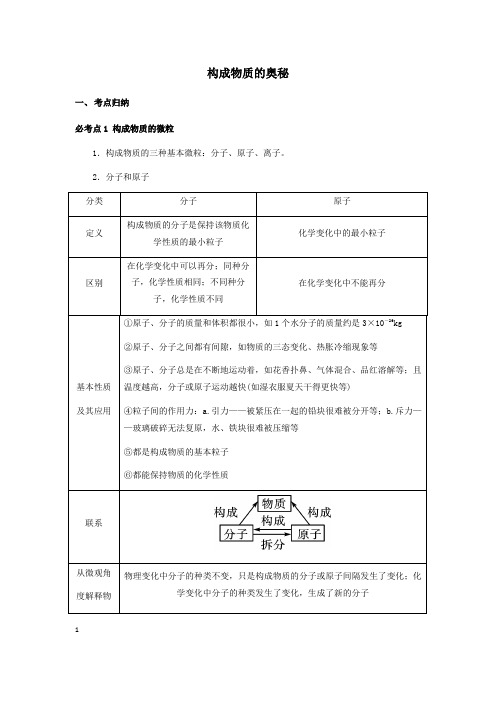
构成物质的奥秘一、考点归纳必考点1 构成物质的微粒1.构成物质的三种基本微粒:分子、原子、离子。
2.分子和原子123.离子(1)带电的原子或原子团叫做离子,带正电的原子叫做阳离子,带负电的原子叫做阴离子。
(2)离子符号周围的数字表示的意义(以Mg 为例)(3)原子和离子的区别(以Na 、S 为例)(4)常见的带电的原子团:OH -(氢氧根离子),SO 4 (硫酸根离子),CO 3 (碳酸根离子),NO -3 (硝酸根离子),HCO -3 (碳酸氢根离子),NH +4 (铵根离子)。
归纳总结(1)原子不能再分的前提是在化学变化中,事实上原子是由更小的微粒构成的。
(2)从分子和原子角度分析,化学变化的微观本质是分子分解成原子,原子重新组合成新的分子或直接构成新的物质。
(3)虽然分子由原子构成,但不同的原子大小差异较大,所以分子不一定比原子大,分子只是比构成该分子的原子大。
4.构成物质的微观粒子(1)物质由分子构成有:气态非金属单质(氧气、氢气、氮气等)、氧化物(二氧化碳、二氧化硫)和不溶性碱和盐(氢氧化镁、氢氧化铜、碳酸钙等);(2)物质由原子构成有:稀有气体(氦气、氖气等)、金属单质(镁条、铁丝、铜片等)和固态非金属(硫磺、碳等)。
(3)物质由离子构成有:可溶性碱和盐(氢氧化钠、氢氧化钾、氯化钠、碳酸钠等)和酸(硫酸、盐酸、硝酸等)。
必考点2 原子的结构1.原子的结构3特别提醒①虽然原子中的质子和核外电子都带电荷,但整个原子不带电,因为原子中质子数(核电荷数)=核外电子数。
②不是所有的原子都有中子(如有一种氢原子,原子核内只有一个质子,没有中子)。
③构成物质的基本微粒有三种:分子、原子、离子。
④一般来说,原子最外层电子数相同的元素,具有相似的化学性质,但并不绝对,如氦原子最外层有2个电子,但由于其核外只有一个电子层而具有相对稳定结构,镁、钙等原子的最外层也是2个电子,在化学反应中却易失去2个电子。

2024九年级化学上册“第三单元物质构成的奥秘”必背知识点一、物质的构成1. 构成物质的微粒:物质由分子、原子、离子等微观粒子构成。
分子:由分子构成的物质,分子是保持其物质化学性质的最小粒子。
如氧气(O₂)、氢气(H₂)、二氧化碳(CO₂)、水(H₂O)等。
原子:原子是化学变化中的最小粒子。
如金属(如Fe、Cu)、金刚石(C)、硅(Si)等。
离子:带电的原子或原子团。
如氯化钠(NaCl)由Na₂和Cl₂构成,硫酸铜(CuSO₂)由Cu²₂和SO₂²₂构成。
2. 微粒的基本性质:微粒的质量和体积都很小。
微粒在不断地运动,温度越高,运动速率越快。
微粒之间有间隔,间隔大小随温度和压强的变化而变化。
同种微粒化学性质相同,不同种微粒化学性质不同。
二、分子与原子的关系1. 分子与原子的区别:在化学变化中,分子可以再分为原子,而原子则不能再分,只是重新组合成新的分子。
2. 分子与原子的联系:分子由原子构成,原子可以相互结合成分子。
三、原子的构成1. 原子的基本构成:原子由居于中心的带正电的原子核和核外带负电的电子构成。
原子核由质子和中子构成 (氢原子除外,它只有质子没有中子)。
2. 原子中的数量关系:核电荷数= 质子数= 核外电子数= 原子序数。
相对原子质量≈质子数+ 中子数。
3. 电子排布:电子在核外是分层排布的,能量低的电子优先排在离核近的电子层中。
四、元素与物质的关系1. 元素的定义:元素是具有相同核电荷数(即质子数)的一类原子的总称。
元素只讲种类,不讲个数。
2. 物质的组成与构成:物质由元素组成,如水由氢元素和氧元素组成。
物质由粒子 (分子、原子、离子)构成,如水由水分子构成,金由金原子构成,氯化钠由钠离子和氯离子构成。
五、化学反应的实质1. 化学反应的实质:在化学反应中,分子分裂为原子,原子重新组合成新的分子。
2. 物理变化与化学变化的区别:物理变化中没有新物质的生成,只是物质的状态或形状发生改变;化学变化中有新物质的生成。

物质构成的奥秘知识点梳理及经典练习(超详细)经典1一、物质构成的奥秘选择题1.下列说法不正确的是A.原子的质量几乎都集中在原子核中B.原子通过得失电子变成离子,但离子不能变成原子C.原子、分子、离子都是构成物质的微粒。
D.由分子构成的物质发生化学变化时,分子本身一定改变【答案】B【解析】【分析】【详解】A、原子由原子核和核外电子构成,电子质量相对于原子核来说很小,因此原子的质量几乎都集中在原子核上,该选项说法正确;B、原子通过得失电子形成离子,离子通过得失电子形成原子,该选项说法不正确;C、原子、分子、离子都是构成物质的微粒,该选项说法正确;D、由分子构成的物质发生化学变化时,分子改变,而原子不变,该选项说法正确。
故选B。
【点睛】原子核中的质子和中子的质量比电子质量大,每个质子或中子是每个电子质量的1836倍。
2.下列有关微粒的说法正确的是A.分子可以再分,而原子不能再分B.分子、原子、离子都可以构成物质C.原子失去电子变成阴离子D.分子大,原子小【答案】B【解析】【详解】A、在化学反应中分子可以再分,原子不能再分,脱离化学变化,原子仍可再分为原子核和核外电子,错误;B、构成物质的基本微粒:分子、原子和离子,所以分子、原子、离子都可以构成物质,正确;C、失去电子带正电荷,属于阳离子,错误;D、有的分子比有的原子大,有的原子比有的分子大,所以分子和原子不能笼统的比较大小,错误。
故选B。
3.下列粒子结构示意图中表示阴离子的是()A.B.C.D.【答案】C【解析】【分析】【详解】A、核内质子数=12>核外电子数=10,属于阳离子,故A不符合题意;B、核内质子数=核外电子数=10,属于原子,故B不符合题意;C、核内质子数=8<核外电子数=10,属于阴离子,故C符合题意;D、核内质子数=11>核外电子数=10,属于阳离子,故D不符合题意。
故选C4.芯片是内含集成电路的硅片,如图是硅元素在元素周期表中的相关信息,下列说法正确的是A.硅元素属于金属元素B.硅原子核内有14个质子C.硅的相对原子质量为28.1g D.硅元素是地壳中含量最高的元素【答案】B【解析】【详解】A、硅元素属于非金属元素,A错误B、硅原子核内有14个质子,B正确;C、硅的相对原子质量为28.1,C错误;D、硅元素是地壳中含量居第二位,D错误;故选B。
物质构成的奥秘知识点1. 原子理论- 原子是物质的基本单位,由质子、中子和电子组成。
- 质子带正电,中子不带电,电子带负电。
- 原子核由质子和中子构成,电子在核外的轨道上运动。
2. 元素周期表- 元素周期表是化学元素按照原子序数(质子数)递增的排列方式。
- 表中元素按照周期(横行)和族(纵列)分类,具有相似性质的元素位于同一族。
3. 化学键- 化学键是原子之间的相互作用,使它们结合在一起形成分子或晶体结构。
- 包括离子键、共价键和金属键。
- 离子键由电荷相反的离子间的电静力吸引形成。
- 共价键由两个或多个原子共享电子对形成。
- 金属键是金属原子间的电子共享,形成“电子海”。
4. 分子结构- 分子是由两个或多个原子通过化学键结合而成的稳定组合。
- 分子的形状和性质由其原子的排列方式和化学键的类型决定。
- VSEPR(价层电子对互斥理论)用于预测分子的几何形状。
5. 物质的状态- 物质可以存在于固态、液态、气态,以及在特定条件下的等离子态。
- 状态的变化由温度和压力的变化引起。
- 相变是物质状态之间的转换,如熔化、蒸发和凝固。
6. 化学反应- 化学反应是原子重新排列形成新物质的过程。
- 反应速率受多种因素影响,包括浓度、温度、催化剂等。
- 化学方程式用于表示反应物和生成物,以及它们之间的摩尔比例。
7. 能量转换- 化学反应通常伴随着能量的吸收或释放。
- 能量形式包括热能、光能、电能等。
- 焓变(ΔH)是反应中能量变化的量度。
8. 核反应- 核反应涉及原子核的变化,如裂变和聚变。
- 核裂变是重核分裂成较轻的核,并释放大量能量。
- 核聚变是轻核合并成重核的过程,也是太阳和其他恒星能量的来源。
9. 量子力学- 量子力学是描述微观粒子行为的物理学理论。
- 波函数和薛定谔方程用于描述粒子的量子态。
- 量子力学解释了原子和分子的稳定性、光谱线以及其他微观现象。
10. 纳米技术- 纳米技术涉及极小尺度(纳米级别)的材料和结构的研究和应用。
物质构成的奥秘知识点总结及经典习题(含答案)一、物质构成的奥秘选择题1.从分子的角度解释下列事实,错误的是A.酒香不怕巷子深——分子在不断地运动B.1滴水大约有1.67×1021个水分子——分子很小C.醋酸是酸的,蔗糖是甜的——不同种分子性质不同D.将空气液化,体积变小——分子体积变小【答案】D【解析】A、酒精分子在做无规则的运动,故远处就可以闻到酒香味,正确;B、1滴水大约有1.67×1021个水分子说明分子很小,正确;C、醋酸和蔗糖是两种不同的分子故性质不同,故正确;D、将空气液化,分子之间的间隙变大,而分子的大小不变,故错误。
故选D。
2.科学家用钙原子轰击铕原子,合成117号元素(部分信息如图所示)。
下列说法错误..的是A.钙和铕都属于金属元素B.该元素的相对原子质量为294gC.该元素原子的核外电子数为117D.该元素的原子序数为117【答案】B【解析】【详解】A、根据钙和铕元素的汉语名称的偏旁为金字旁可知,都属于金属元素,正确;B、由上图知,该元素的相对原子质量为294,单位不是克,错误;C、由上图知,该元素的原子序数为117,根据原子序数=核外电子数,所以该元素的核外电子数为117,正确;D、由上图知,该元素的原子序数为117,正确。
故选B。
【点睛】以钠为例,元素周期表中信息:。
3.近日,我国企业成功研发圆珠笔笔头用新型不锈钢材料,标志着笔头用材料的国产化、自主化进程迈出了关键一步。
笔头不锈钢材料中含有碳、铁、钨等元素。
如图是其元素的部分信息。
下列说法正确的是A.碳元素只能形成二种单质B.铁是地壳中含量最多的金属元素C.一个钨原子的质量为183.84gD.碳、铁、钨的原子核外电子数依次增加【答案】D【解析】本题主要考查元素周期表的特点及其应用;原子的定义与构成;碳元素组成的单质。
同一种元素可以形成不同的物质,金刚石,石墨,活性炭等都是碳元素的单质。
据题中的图示,元素周期表所提供的信息进行解答。
《物质构成的奥秘》知识清单一、物质的微粒性1、物质是由微粒构成的我们周围的世界是由形形色色的物质组成的,而这些物质都是由极其微小的粒子——分子、原子和离子等构成的。
分子是保持物质化学性质的最小粒子。
例如,水是由水分子构成的,氧气是由氧分子构成的。
同种分子性质相同,不同种分子性质不同。
原子是化学变化中的最小粒子。
在化学变化中,分子可以再分,而原子不能再分。
离子是带电的原子或原子团。
例如,氯化钠是由钠离子和氯离子构成的。
2、微粒的性质微粒具有以下性质:(1)微粒很小。
肉眼无法直接看到分子、原子等微粒。
(2)微粒在不断运动。
例如,能闻到花香是因为花中的分子在不断运动,进入了人的鼻腔。
(3)微粒之间有间隔。
物质的三态变化、热胀冷缩等现象,都是微粒间间隔发生改变的结果。
二、原子的构成1、原子的结构原子由居于原子中心的带正电的原子核和核外带负电的电子构成。
原子核由质子和中子构成。
质子带正电荷,电子带负电荷,中子不带电。
在原子中,质子数等于电子数,所以整个原子不显电性。
2、原子中的数量关系质子数=电子数相对原子质量≈ 质子数+中子数3、核外电子的排布核外电子是分层排布的。
离原子核越近的电子能量越低,越远的电子能量越高。
原子结构示意图可以直观地表示核外电子的排布情况。
例如,钠原子的结构示意图为:(画一个钠原子的结构示意图,这里不好展示)最外层电子数决定了元素的化学性质。
一般来说,最外层电子数小于 4 的原子在化学反应中易失去电子,大于 4 的原子易得到电子,等于 8(氦为 2)的原子化学性质相对稳定。
三、元素1、元素的概念元素是具有相同质子数(即核电荷数)的一类原子的总称。
元素只论种类,不论个数。
例如,水由氢元素和氧元素组成,但不能说水由两个氢元素和一个氧元素组成。
2、元素的分类元素可分为金属元素、非金属元素和稀有气体元素。
金属元素的名称一般带有“钅”字旁(汞除外);非金属元素的名称中,“气”字头的表示气态非金属元素,“石”字旁的表示固态非金属元素,“氵”字旁的表示液态非金属元素。
第三单元物质构成的奥秘课题1分子和原子第1课时物质由微观粒子构成分子的基本性质1.分子的________和________都很小。
2.分子总是在不停地________。
温度越高,分子运动速率越________。
3.分子间有________。
一般来说,气体分子间间隔﹥液体分子间间隔﹥固体分子间间隔。
温度升高,分子间间隔________。
压强增大,分子间间隔________。
4.同种分子化学性质________,不同种分子化学性质________。
第2课时分子可分为原子)一、分子与原子1.分子的概念:由分子构成的物质,分子是__________________________________。
2.原子的概念:原子是__________________________________。
3.本质区别:在化学变化中分子可分,原子不可再分。
4.联系:(1)分子由原子构成。
(2)分子和原子都是构成物质的粒子。
二、物理变化与化学变化的微观解释1.物理变化:分子种类________,如水的三态变化只是分子间间隔________。
2.化学变化:分子种类________。
课题2 原子的结构 第1课时 原子的构成原子的构成 1.原子的结构原子⎩⎪⎨⎪⎧原子核⎩⎪⎨⎪⎧ (带 电)中子( ) (带 电)2.在原子中,核电荷数=质子数=核外电子数。
注意:①质子数不一定等于中子数。
②原子的质量主要集中在原子核上。
第2课时原子核外电子的排布离子一、原子核外电子排布1.原子结构示意图2. 原子结构与原子化学性质之间的关系原子的分类最外层电子数得失电子趋势化学性质稀有气体原子______个(氦为______个) 不易得失稳定金属原子一般小于______个易______最外层电子不稳定非金属原子一般大于______个易______电子不稳定结论:原子的化学性质与__________________关系密切二、离子1.定义:__________原子(或原子团)称为离子。
物质构成的奥秘知识点 一、 分子与原子
1、 分子
概念:分子是保持物质化学性质的最小粒子。
(①只保持物质化学性质,单个的分子不能保持物质物理性质;②最小不是指质量、体积最小;③化学变化中,分子要变,化学性质也要变;④物理变化中,分子不变,化学性质也不变;⑤分子只是构成物质的一种粒子,还有别的粒子(原子、离子)
基本性质:①分子的体积小、质量也小;②分子在不停地运动(温度越高,运动越快);③分子间有间隔(温度越高,间隔越大。
气态物质的分子间,间隔最大);④同种物质的分子,性质相同;不同物质的分子,性质不同。
结构:都由原子构成(大多数由两个或两个以上的原子构成。
可由同种原子构成分子,如: F 2、Cl 2、Br 2、I 2、 H 2、N 2、O 2、:也可由不同种原子构成分子,如:CO 、CO 2、H 2O 、P 2O 5等) 2、 原子:
概念:原子是化学变化中最小粒子。
(①只是化学变化中的最小粒子,不包括物理变化等;②最小不是指质量、体积最小,而是指能不能拆分;③在化学变化中,原子不变;④原子也是构成物质的一种粒子;⑤原子与分子的本质区别是:在化学变化中分子可以分成原子,而原子却不能再分;⑥化学应的实质的实质是:反应物的原子重新组合成其他物质的过程.(反应前后原子的种类没有改变,原子的数目没有增减,原子的质量也没有变化。
)
基本性质:①原子的体积小、质量也小;②原子在不停地运动(温度越高,运动越快);③原子间有间隔(温度越高,间隔越大)④同种原子,性质相同,不同种原子,性质不同。
化学反应的实质:在化学反应中分子分裂为原子,原子重新组合成新的分子。
二、物质的组成、构成及分类 组成:物质由元素组成
原子:金属、稀有气体、碳、硅等。
物质 构成 分子:如氯化氢由氯化氢分子构成。
H 2、O 2、N 2、Cl 2。
离子:NaCl 等离子化合物,如氯化钠由钠离子(Na +
)氯离子(
Cl -)构成
混合物(多种物质)
分类 单质 :金属、非金属、稀有气体
纯净物 (一种元素)
(一种物质)
化合物:
有机化合物 CH 4、
C 2H 5OH 、C 6H
12O 6、淀粉、蛋白质(多
种元素) 氧化物
H 2O CuO CO 2
无机化合物 酸 HCl H 2SO 4 HNO 3
碱 NaOH Ca(OH)2 KOH 概念 盐 NaCl CuSO 4 Na 2CO 3 ①混合物:由两种或多种物质混合而成的,这些物质相互间没有发生反应,各物质都保持原来的性质。
(多种物质或多种分。
)
②纯净物:由一种物质组成(或一种分子构成) ③单质:由同种元素成的纯净物。
(一种元素、一种物质。
) ④化合物:由不同种元素组成的纯净物。
(两种或多种元素、一种物质。
)
⑤氧化物:由两种元素组成的化合物,其中一种是氧元素。
(两种元素、其中之一是氧元素、一种物质。
)
⑥含氧化合物:含有氧元素的化合物。
(两种或多种元素、其中之一是氧元素、一种物质。
) 三、原子的构成
(1)原子结构示意图的认识 (2)在原子中核电荷数=质子数=核外电子数 决定元素种类 质子数(核电荷数) (3)原子的质量主要集中在 原子核 上 (5三决定 决定元素化学性质 最外层电子数 (4)相对原子质量≈质子数+中子数 决定原子的质量 原子核 说明:最外层电子数相同其化学性质不一定都相同(Mg ,He 最外层电子数为2) 最外层电子数不同其化学性质有可能相似(He ,Ne 均为稳定结构) 四、元素
(1)定义:具有相同核电荷数(质子数)的一类原子的总称.(①核电荷数或质子数决定元素的种类;②一类原子:质子数相同,而中子数、电子数不一定相同的原子或离子;③物质由元素组成)
一种元素与另一种元素的本质区别:质子数不同 注意:
由同种元素组成的物质不一定是单质,(如由O 2、O 3组成的混合物或金刚石与石墨的混合物)不可能是化合物。
a 、书写方法:拉丁文名称的第一个字母大写
b 、意义
注意:*有些元素符号还可表示一种单质 如Fe 、He 、C 、Si
*在元素符号前加上数字后只能有微观意义,没有宏观意义,如3O :只表示3个氧原子 C 、由分子构成的物质,有4种描述方法(以水为例)
①水由氢元素和氧元素组成;②水是由水分子构成的;③水分子由氢原子和氧原子构成; ④一个水分子由两个氢原子和一个氧原子构成;
由原子或离子构成的物质,有2种描述方法(以汞、食盐为例): ①汞是由汞元素组成的;食盐是由钠元素和氯元素组成的; ②汞是由汞原子构成的;食盐是由钠离子和氯离子构成的;
D 、有关元素周期表 *发 现:门捷列夫 *排列依据
*注:原子序数=质子数
d 、分类
e 、元素之最:地壳:O 、Si 、Al 、Fe 细胞:O 、C 、H N 五、离子:带电的原子或原子团
(1)表示方法及意义:如Fe 3+
:一个铁离子带3个单位正电荷
(2)离子结构示意图的认识
注意:与原子示意图的区别:质子数=电子数则为原子结构示意图
*原子数≠电子数为离子结构示意图
①阳离子:带正电荷的离子,
如钠离子Na +、镁离子Mg 2+、铝离子Al 3+、亚铁离子Fe 2+、铁离子Fe 3+、铵根离子NH 4+
、; ②阴离子:带负电荷的离子,
如氯离子Cl -、硫离子S 2-、碳酸根离子CO 32-、硫酸根离子SO 42-、硝酸根离子NO 3-
、氢氧根离子OH -;;
粒子种类
原子
离子
阳离子
阴离子
区别
粒子结构 质子数=核外电子数
质子数>电子数 质子数<电子数 粒子电性 不带电 带正电
带负电
符号
元素符号
阳离子符号,如Mg 2+
阴离子符号,如Cl -
联系
阳离子 原子 阴离子
(4) 核外有10个电子的粒子有:(1)分子:Ne 、HF 、H 2O 、NH 3、CH 4 ;(2)阴离子:N 、O 、F 、OH -;(3)阳离子:Mg 2+、Na +、Al 3+、NH 4+
; (5)、几种数字的含义
注意:①元素符号前的数字表示原子的个数②化学式前的数字表示分子的个数③化学式中元素符号右下角的数字表示一个分子中该原子的个数。
④表示几个原子:在元素符号前加数字(只有一符号 符号表示的意义 粒子符号表示的意符号中数字“2”表示的意义
义
2N 表示两个氮原子
表示两个氮原子 表示两个氮原子 SO 2
表示二氧化硫,表示二氧化硫由硫元素和氧元素组成,
表示二氧化硫中硫原子与氧原子个数比为1:2,
表示二氧化硫中硫元素与氧元素的质量比为1:1,
表示一个二氧化硫分子,
表示一个二氧化硫分子由一个硫原子和二个氧原子构成。
表示一个二氧化硫分子,
表示一个二氧化硫分子由一个硫原子和二个氧原子构成
表示一个二氧化硫分子含有两个氧原子
N 2
表示氮气,表示氮气由氮元素组成,表示一个氮分子,
表示一个氮分子由两个氮原子构成。
表示一个氮分子, 表示一个氮分子由两个氮原子构成。
表示一个氮分子含有两个氮原子 2CO
表示二个一氧化碳分子
表示两个一氧化碳分子
表示两个一氧化碳分子 2SO 42—
表示2个硫酸根离子
表示两个硫酸根离子
①前面“2”表示两个硫酸根离子;
②右上角的“2”表示一个硫酸根离子和两个单位的负电荷。
化学式表示的意义 以“CO 2”为例 以“N 2”为例 宏观
①表示一种物质
①表示二氧化碳这种物质
①表示氮气
②表示这种物质由哪些元素组成 ②表示二氧化碳由碳元素和氧元素组成
②表示氮气由氨气组成 量的意义
①表示这种物质中各元素的质量比
①表示二氧化碳中碳元素与氧元素的质量比为3:8
①无
②表示这种物质中各元素的原子个数比
②表示二氧化碳中碳原子与氧原子个数比为1:2
②无
微观
①表示这种物质的一个分子
①表示一个二氧化碳分子
①表示一个氮气分子
②表示这种物质的一个分子由哪些原子构成
②表示一个二氧化碳分子由一个碳原子和二个氧原子构成
或表示一个二氧化碳分子含有一个碳原子和二个氧原子
②表示一个氮气分子含有两个氮原子,或表示一个氮气分子由两个氮原子构成
金属元素:如Mg 、Al ,最外层电子数特点:<4
非金属元素:如N 、C ,最外层电子数特点:≥4 稀有气体元素:如He 、Ne 。
最外层电子数特点:2或8 7横行(7个周期) 18纵行(16族) 各周期电子层数相同,核电荷数逐渐增加 各族最电外层电数相同,电子层数逐渐增加(化学性质相似)
质子数>电子数:则为阳离子,如Al 3+
质子数<电子数:则为阴离子,O 2-- 同种元素的原子与离子比较:
①质子数相等
②电子数及最外
层电子数不同,
③电子层数可能相同。