抗肿瘤药物设计的新靶点
- 格式:pdf
- 大小:238.40 KB
- 文档页数:6

---------------------------------------------------------------最新资料推荐------------------------------------------------------靶向抗肿瘤药物的研究进展靶向抗肿瘤药物的研究进展近年来,随着肿瘤生物学及相关学科的飞速发展,人们逐渐认识到细胞癌变的本质是细胞信号转导通路的失调导致的细胞无限增生,随之而来的是抗肿瘤药物研发理念的重大转变。
研发焦点正从传统细胞毒药物向针对肿瘤发生发展过程中众多环节的新药方向发展,这些靶点新药针对正常细胞和肿瘤细胞之间的差异,可达到高选择性、低毒性的治疗效果,从而克服传统细胞毒药物的选择性差、毒副作用强、易产生耐药性等缺点,为此,肿瘤药物进入了一个崭新的研发阶段。
目前发现的药物靶点主要包括蛋白激酶、细胞周期和凋亡调节因子、法尼基转移酶(FTase) 等,现就针对这些靶点的研发药物做一综述。
1、蛋白激酶蛋白激酶是目前已知的最大的蛋白超家族。
蛋白激酶的过度表达可诱发多种肿瘤。
蛋白激酶主要包括丝氨酸/苏氨酸激酶和酪氨酸激酶,其中酪氨酸激酶主要与信号通路的转导有关,是细胞信号转导机制的中心。
蛋白激酶由于突变或重排,可引起信号转导过程障碍或出现异常,导致细胞生长、分化、代谢和生物学行为异常,引发肿瘤。
研究表明,近 80%的致癌基因都含有酪氨酸激酶编码。
1 / 22抑制酪氨酸激酶受体可以有效控制下游信号的磷酸化,从而抑制肿瘤细胞的生长。
酪氨酸激酶受体分为表皮生长因子受体(EGFR) 、血管内皮细胞生长因子受体(VEGFR) 、血小板源生长因子受体(PDGFR)等,针对各种受体的酪氨酸激酶抑制剂目前已开发上市的主要为表皮生长因子受体酪氨酸激酶(EGFR-TK) 抑制剂、血管内皮细胞生长因子受体酪氨酸激酶(VEGFR-TK) 抑制剂和血小板源生长因子受体酪氨酸激酶(PDGFR-TK) 抑制剂等。

690上海交通大学学报(医学版)2019, 39 (7)JOURNAL OF SHANGHAI JIAO TONG UNIVERSITY (MEDICAL SCIENCE )V ol.39 No.7 Jul. 2019Inhibiting PD-L1 palmitoylation enhances T-cell immune responses against tumours 引自:Nat Biomed Eng , 2019, 3(4): 306-317. DOI: 10.1038/s41551-019-0375-6.Abstract:Checkpoint blockade therapy targeting the programmed-death ligand 1 (PD-L1) and its receptor programmed cell death 1 promotes T-cell-mediated immunosurveillance against tumours, and has been associated with marked clinical benefit in cancer patients. Antibodies against PD-L1 function by blocking PD-L1 on the cell surface, but intracellular storage of PD-L1 and its active redistribution to the cell membrane can minimize the therapeutic benefits, which highlights the importance of targeting PD-L1 throughout the whole cell. Here, we show that PD-L1 is palmitoylated in its cytoplasmic domain, and that this lipid modification stabilizes PD-L1 by blocking its ubiquitination, consequently suppressing PD-L1 degradation by lysosomes. We identified palmitoyltransferase ZDHHC3 (DHHC3) as the main acetyltransferase required for the palmitoylation of PD-L1, and show that the inhibition of PD-L1 palmitoylation via 2-bromopalmitate, or the silencing of DHHC3, activates antitumour immunity in vitro and in mice bearing MC38 tumour cells. We also designed a competitive inhibitor of PD-L1 palmitoylation that decreases PD-L1 expression in tumour cells to enhance T-cell immunity against the tumours. These findings suggest new strategies for overcoming PD-L1-mediated immune evasion in cancer.许 杰(1979—),上海交通大学医学院附属仁济医院研究员、博士生导师。


抗肿瘤药物研究及新药筛选提纲一、化疗药物的发展二、肿瘤的药物治疗三、抗肿瘤药物筛选及评价四、体外抗肿瘤活性试验五、体内抗肿瘤活性试验一、化疗药物的发展•近代肿瘤化疗学始于20世纪40年代。
• 50年代通过动物筛选化疗药物发现了5FU、MTX、CTX等,化疗学有了发展。
• 60年代认识到肿瘤细胞动力学及化疗药药代动力学的重要性。
大部分目前所用的抗癌药已发现,有急淋、HD、睾丸癌等可化疗治愈。
• 70年代形成肿瘤内科学,更多肿瘤有了比较成熟的化疗方案。
• 80年代研究以生物反应修饰剂等药物来提高化疗疗效,探索抗药性产生的原因,5%肿瘤患者可治愈。
• 90年代新抗癌药进入临床,多药耐药基因发现,生物治疗,基因治疗辅助治疗改善等,疗效进一步提高。
二、肿瘤的药物治疗1、细胞毒类抗肿瘤药a、拓扑异构酶抑制剂原理:真核细胞DNA拓扑异构酶Ⅰ(Topo Ⅰ)是生物体内及其重要的细胞核内酶,参与DNA复制、转录和修复等所有关键的核内过程。
DNA拓扑异构酶Ⅰ已成为重要的抗肿瘤药物研究新靶点。
拓扑异构酶Ⅰ抑制剂已成为高选择性抗肿瘤药物研究的一个主攻方向。
代表药物:喜树碱类化合物对S期的毒性作用,这一作用需共价TopoI-DNA复合物的形成和DNA复制。
TopoI抑制剂诱导的细胞凋亡而非DNA断裂是引起细胞最终死亡的原因。
b、胸苷酸合成酶抑制剂原理:胸苷酸合成酶(TS)把单磷酸脱氧尿嘧啶(DUMP)转换成单磷酸胸腺嘧啶(TMP),在DNA复制和细胞生长过程中起着关键作用。
是已知抗肿瘤药物的重要有效靶点之一。
胸苷酸合成酶抑制剂导致了DNA断裂从而导致细胞死亡。
代表药物:培美曲塞它是一种结构上含有核心为吡咯嘧啶基团的抗叶酸制剂,通过破坏细胞内叶酸依赖性的正常代谢过程,抑制细胞复制,从而抑制肿瘤的生长。
体外研究显示,培美曲塞能够抑制胸苷酸合成酶、二氢叶酸还原酶和甘氨酰核苷酸甲酰转移酶活性,这些酶都是合成叶酸所必需的酶。
一旦培美曲塞进入细胞内,它就在叶酰多谷氨合成酶的作用下转化为多谷氨酸的形式。

抗肿瘤药物开发研究与策略分析肿瘤是一种严重危害人类健康的疾病,其中癌症是最常见和致命的类型之一。
为了对抗这一疾病,抗肿瘤药物的开发和研究变得至关重要。
本文将针对抗肿瘤药物的开发研究和相关策略进行分析。
一、抗肿瘤药物的开发研究1. 抗肿瘤药物的分类抗肿瘤药物可以分为化学药物和生物药物两大类。
化学药物主要包括细胞毒性药物和激素类药物,其主要通过抑制肿瘤细胞的增殖和分裂来发挥作用。
生物药物则是通过给予人体免疫系统更多的能力来对抗肿瘤细胞,例如免疫检查点抑制剂和细胞治疗。
2. 抗肿瘤药物的研发过程抗肿瘤药物的研发过程通常分为药理学评估、药代动力学研究、安全性评价和临床试验四个阶段。
药理学评估主要是通过体外实验来评估药物的抗肿瘤活性和机制。
药代动力学研究则旨在了解药物在体内的代谢和排泄情况。
安全性评价主要包括毒理学评价和副作用评估。
最后,临床试验是将药物应用于人体进行治疗效果评估的阶段。
3. 新一代抗肿瘤药物随着科技的不断进步,新一代抗肿瘤药物的研发取得了一系列的突破。
例如,靶向治疗药物的出现,可以通过针对肿瘤细胞的特定分子标靶,发挥定向杀伤作用,减少对正常细胞的影响。
免疫治疗则是利用人体免疫系统来攻击肿瘤细胞,增强机体抗肿瘤能力。
二、抗肿瘤药物开发策略1. 靶向治疗策略靶向治疗是目前抗肿瘤药物开发的主要策略之一。
通过针对特定的分子标靶,抑制肿瘤细胞的增殖和生长,减少对正常细胞的伤害。
例如,针对HER2阳性乳腺癌的靶向治疗药物赫赛汀(Herceptin)的研发与应用,显著改善了患者的生存率。
2. 免疫治疗策略免疫治疗是一种利用人体免疫系统来对抗肿瘤的策略。
这种策略通过激活免疫细胞如T细胞和自然杀伤细胞,增强它们对肿瘤细胞的杀伤能力。
免疫检查点抑制剂(ICIs)是其中一种应用广泛的免疫治疗方法,它可以抑制免疫检查点蛋白,以恢复免疫系统对肿瘤的杀伤作用。
3. 多靶点联合治疗策略由于肿瘤细胞的异质性和多样性,单一的靶点治疗在一些情况下可能面临抵抗和耐药的问题。

全球新型抗肿瘤药物研发进展及趋势作者:李积宗张博文方淑蓓韩佳毛开云江洪波陈大明来源:《上海医药》2022年第25期李积宗,中共党员﹑高级工程师,上海市生物医药科技发展中心主任、上海医药行业协会副会长,长期从事生物医药领域科研项目管理、科技成果转化和软课题研究等工作,牵头建设运行上海市生物医药研发与转化功能型平台,熟悉上海生物医药科技创新政策,具有丰富的项目管理和成果转化经验。
通信作者:陈大明,研究员,长期从事生物医药等领域的科技情报研究,创新了基于关联索引的情报研究新方法,揭示了多学科交叉融合演进的范式,构建了用于专利价值和成果转化的评估框架,在软科学研究、知识产权分析、产业情报研究等方面带领团队完成了数十项研究课题,有力支撑了多种决策。
摘要:新型抗肿瘤药物已成功用于规避常规策略的某些局限性,同时提供更高的敏感性和特异性、更高的生物利用度和改善的综合治疗效果。
本文总结了过去70年的抗肿瘤药物开发里程碑,综述了基于肿瘤标志性特征的14类抗肿瘤药物开发路径,并且从多学科交叉融合的视角探索了抗肿瘤药物开发中的前景。
关键词:抗肿瘤药物多学科研究中图分类号:R979.1文献标志码:A文章编号:1006-1533(2022)S2-0001-o8引用本文李积宗,张博文,方淑蓓,等.全球新型抗肿瘤药物研发进展及趋势[J.上海医药,2022,43(S2):1-8.Noval anti-tumor drugs: global advances and trendsLlJizong' , ZHANG Bowen', FANG Shubei' ,HAN Jia', MAO Kaiyun',JIANG Hongbo , CHEN Daming( 1.Shanghai Center of Biomedicine Development,Shanghai 201203,China; 2. Shanghai lnformation Center for LifeSciences,Shanghai Institute of Nutrition and Health, Chinese Academy of Sciences ,Shanghai 200031 , China)ABSTRACT Noval anti-tumor drugs have been successfully employed to circumvent certain limitations of conventionalstrategies while providing higher sensitivity and specificity,greater bioavailability, and improved comprehensive effects fortherapeutic outcomes. This paper summarized anti-tumor drug development milestones in the past seven decades,reviewed anti-tumor drug based therapies accroding to 14 different targeting approaches, and discussed the imperative role of multidisciplinaryresearches that could drive anti-tumor drug developments.KEY WORDS anti-tumor ; drug; multidisciplinary research過去数十年来,全球肿瘤治疗巨大需求的拉动力、多种技术融合创新的驱动力,共同推动了全球抗肿瘤药物研发的快速发展。
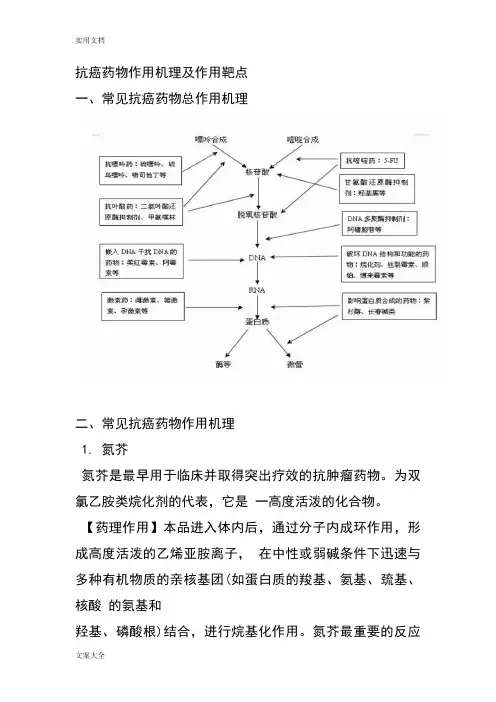
抗癌药物作用机理及作用靶点一、常见抗癌药物总作用机理二、常见抗癌药物作用机理1. 氮芥氮芥是最早用于临床并取得突出疗效的抗肿瘤药物。
为双氯乙胺类烷化剂的代表,它是一高度活泼的化合物。
【药理作用】本品进入体内后,通过分子内成环作用,形成高度活泼的乙烯亚胺离子,在中性或弱碱条件下迅速与多种有机物质的亲核基团(如蛋白质的羧基、氨基、巯基、核酸的氨基和羟基、磷酸根)结合,进行烷基化作用。
氮芥最重要的反应是与鸟嘌呤第7位氮共价结合,产生DNA 的双链内的交叉联结或DNA 的同链内不同碱基的交叉联结。
G1期及M 期细胞对氮芥的细胞毒作用最为敏感,由G1期进入S 期延迟。
【适应症】主要用于恶性淋巴瘤及癌性胸膜、心包及腹腔积液。
目前已很少用于其他肿瘤,对急性白血病无效。
与长春新碱(VCR)、甲基卡肼(PCZ)及泼尼松(PDN)合用治疗霍奇金病有较高的疗效,对卵巢癌、乳腺癌、绒癌、前列腺癌、精原细胞瘤、鼻咽癌(半身化疗法)等也有一定疗效;腔内注射用以控制癌性胸腹水有较好疗效;对由于恶性淋巴瘤等压迫呼吸道和上腔静脉压迫综合征引起的严重症状,可使之迅速缓解。
2.环磷酰胺环磷酰胺为氮芥与磷酰胺基结合而成的化合物,是临床常用的烷化剂类免疫剂。
【药理作用】该品在体外无抗肿瘤活性,进入体内后先在肝脏中经微粒体功能氧化酶转化成醛磷酰胺,而醛酰胺不稳定,在肿瘤细胞内分解成酰胺氮芥及丙烯醛,酰胺氮芥对肿瘤细胞有细胞毒作用。
环磷酰胺是双功能烷化剂及细胞周期非特异性药物,可干扰 DNA 及 RNA 功能,尤以对前者的影响更大,它与DNA 发生交叉联结,抑制DNA 合成,对S 期作用最明显。
【适应症】该品为最常用的烷化剂类抗肿瘤药,进入体内后,在肝微粒体酶催化下分解释出烷化作用很强的氯乙基磷酰胺(或称磷酰胺氮芥),而对肿瘤细胞产生细胞毒作用,此外本品还具有显著免疫作用。
临床用于恶性淋巴瘤,多发性骨髓瘤,白血病、乳腺癌、卵巢癌、宫颈癌、前列腺癌、结肠癌、支气管癌、肺癌等,有一定疗效。



新型抗肿瘤药物靶点研究及其临床前实验癌症是严重的全球性健康问题,而抗肿瘤药物的诞生为人类对抗癌症提供了新的工具。
然而,传统的抗癌药物多数是通过对肿瘤细胞的无差别杀伤来达到治疗效果。
由于这种治疗方式会对正常细胞造成一定的损伤,导致副作用极大,难以持久有效。
而新型抗肿瘤药物则主要作用于肿瘤细胞自身的致癌机制,而不是单纯的杀伤肿瘤细胞,因此会极大程度地减少因治疗所引起的副作用,更加有效的提高了治疗效果。
这种新型药物的研究中,靶点研究是其中的重要环节,下面我们将来深入了解一下什么是靶点研究以及它在新型抗肿瘤药物开发中的应用。
什么是靶点?靶点是一种指定的分子或化合物,用于在生物体内特定的途径中调节或控制某个生物过程。
在肿瘤细胞中,靶点就是通过抑制或激活某些肿瘤细胞生物学过程,以达到治疗肿瘤的目的。
在新型抗肿瘤药物中,靶点研究就是要确定肿瘤细胞中的关键靶点,并寻找相应的药物和治疗策略来针对这些靶点。
靶点研究的重要性作为抗肿瘤药物开发的关键环节,靶点研究为新型抗肿瘤药物的开发奠定了基础。
在开发新药物之前,需要通过一系列的严格评估,确定每个靶点的临床可行性。
这个过程涉及到从许多不同来源的细胞株中的有可能的靶点的筛选和鉴定。
最终确定的靶点需要开展严格的临床前药物评估,来确定治疗的最佳方案。
临床前实验新型抗肿瘤药物在投放市场前需要经过严格的临床前实验。
这些实验包括体外实验和体内实验。
体外实验体外实验通常是指在离体细胞、组织或器官中对药物的作用进行研究。
这些实验提供了治疗剂量和药效的基本数据,确定所选择的化合物或药物的适宜性。
体外实验可以帮助筛选候选化合物,并为下一步体内实验提供重要的信息。
体内实验体内实验是在动物体内对药物的毒性和药效进行评估。
体内实验提供了更加精确和全面的药物安全性和有效性的数据。
在体内实验中,一般将模型动物接种肿瘤细胞后进行试验,在此基础上确定规定的药物剂量、频率和时长。
这些数据的结果将为设计初步临床试验提供有价值的信息。

新型抗肿瘤药物的研发与临床应用研究探讨癌症,一直是威胁人类健康的重大疾病之一。
随着科技的不断进步,新型抗肿瘤药物的研发取得了显著的成果,为癌症患者带来了新的希望。
本文将对新型抗肿瘤药物的研发以及临床应用进行深入探讨。
一、新型抗肿瘤药物的研发背景在过去的几十年里,传统的肿瘤治疗方法,如手术、放疗和化疗,虽然在一定程度上提高了患者的生存率,但仍存在诸多局限性。
手术治疗对于晚期或转移性肿瘤往往效果不佳;放疗可能会对正常组织造成损伤;化疗则伴随着严重的副作用,且容易产生耐药性。
因此,研发更加高效、低毒、特异性强的新型抗肿瘤药物成为了医学领域的迫切需求。
二、新型抗肿瘤药物的种类1、免疫检查点抑制剂免疫检查点抑制剂是近年来肿瘤治疗领域的重大突破。
它们通过阻断肿瘤细胞对免疫系统的抑制作用,激活患者自身的免疫系统来攻击肿瘤细胞。
例如,PD-1/PDL1 抑制剂和 CTLA-4 抑制剂在多种恶性肿瘤,如黑色素瘤、非小细胞肺癌、肾癌等的治疗中显示出了显著的疗效。
2、靶向治疗药物靶向治疗药物是针对肿瘤细胞特定的靶点,如基因突变、蛋白过度表达等进行精准打击的药物。
例如,针对 EGFR 突变的非小细胞肺癌患者,EGFR 酪氨酸激酶抑制剂能够显著延长患者的生存期,提高生活质量。
3、抗体药物偶联物(ADC)ADC 是将抗体与细胞毒性药物通过连接子偶联而成的新型药物。
抗体部分能够特异性地识别肿瘤细胞表面的抗原,将细胞毒性药物精准递送至肿瘤细胞内,发挥杀伤作用。
ADC 药物在乳腺癌、胃癌等肿瘤的治疗中展现出了良好的前景。
4、肿瘤疫苗肿瘤疫苗通过激活患者的免疫系统,使其能够识别和攻击肿瘤细胞。
包括预防性肿瘤疫苗和治疗性肿瘤疫苗,目前仍处于研究和临床试验阶段,但具有很大的潜力。
三、新型抗肿瘤药物的研发策略1、基于基因测序和生物信息学的研发随着基因测序技术的飞速发展,我们能够更加深入地了解肿瘤的基因突变和分子特征。
通过对大量肿瘤样本的基因测序和分析,发现新的治疗靶点,为药物研发提供依据。
新型抗肿瘤药物的临床研究进展肿瘤,一直是威胁人类健康的重大疾病之一。
随着医学技术的不断进步,新型抗肿瘤药物的研发和临床应用取得了显著的成果。
这些新药物为肿瘤患者带来了新的希望,也为肿瘤治疗领域带来了革命性的变化。
一、免疫检查点抑制剂免疫检查点抑制剂是近年来肿瘤治疗领域的重大突破之一。
其中,PD-1/PDL1 抑制剂和 CTLA-4 抑制剂最为常见。
PD-1/PDL1 抑制剂通过阻断 PD-1 与 PDL1 的结合,重新激活免疫系统对肿瘤细胞的攻击。
CTLA-4 抑制剂则通过解除 CTLA-4 对 T 细胞的抑制作用,增强免疫系统的抗肿瘤活性。
这些免疫检查点抑制剂在多种肿瘤类型中显示出了显著的疗效,如黑色素瘤、非小细胞肺癌、肾癌、膀胱癌等。
例如,帕博利珠单抗(Keytruda)在黑色素瘤和非小细胞肺癌的治疗中取得了良好的效果,显著延长了患者的生存期。
同时,免疫检查点抑制剂的联合治疗也成为研究的热点。
例如,PD-1/PDL1 抑制剂与化疗、放疗或其他免疫治疗药物的联合应用,显示出了更强的抗肿瘤活性。
然而,免疫检查点抑制剂的治疗也并非一帆风顺。
部分患者可能对治疗无反应,或者在治疗过程中出现免疫相关不良事件,如免疫性肺炎、免疫性肝炎、免疫性肠炎等。
因此,如何筛选出对免疫治疗敏感的患者,以及如何管理免疫相关不良事件,是当前研究的重点方向。
二、靶向治疗药物靶向治疗药物是针对肿瘤细胞特定的分子靶点进行治疗的药物。
这些靶点通常是肿瘤细胞生长、增殖和存活所必需的关键分子,如基因突变产物、受体、激酶等。
通过抑制这些靶点的活性,可以有效地抑制肿瘤细胞的生长和扩散。
在肺癌治疗中,EGFR 酪氨酸激酶抑制剂(如吉非替尼、厄洛替尼)和 ALK 抑制剂(如克唑替尼、阿来替尼)的应用显著改善了患者的生存。
在乳腺癌治疗中,HER2 抑制剂(如曲妥珠单抗、帕妥珠单抗)的出现也为 HER2 阳性乳腺癌患者带来了福音。
此外,针对其他肿瘤相关靶点的药物,如 BRAF 抑制剂、VEGF 抑制剂等,也在相应的肿瘤治疗中发挥了重要作用。
最热门抗肿瘤靶点及小分子靶向药物全景报告抗肿瘤靶点是指对肿瘤生长、转移等过程具有重要调控作用的蛋白分子或通路。
小分子靶向药物是一类能够专一靶向抗肿瘤靶点并抑制其活性的化学物质。
随着抗肿瘤研究的不断深入,越来越多的抗肿瘤靶点及小分子靶向药物被发现并应用于临床。
以下将介绍一些当前最热门的抗肿瘤靶点及小分子靶向药物:1.EGFR(表皮生长因子受体):EGFR是一种跨膜酪氨酸激酶受体,参与肿瘤细胞的生长和分化等过程。
一些小分子靶向药物如吉非替尼和厄洛替尼等通过抑制EGFR的酪氨酸激酶活性,抑制肿瘤细胞生长。
2.HER2(人表皮生长因子受体2):HER2是一种细胞表面受体,参与调节细胞增殖和存活等过程。
一些小分子靶向药物如曲妥珠单抗和拉普替尼等能够靶向结合HER2,抑制其信号传导,减少肿瘤细胞的增殖。
3.ALK(酪氨酸激酶受体):ALK是一种重排基因,其突变被发现与多种肿瘤的发生和发展相关。
小分子靶向药物如克唑替尼和艾尔莎替尼能够抑制ALK的活性,阻断肿瘤细胞的生长和转移。
4.BRAF(B型RAF激酶):BRAF是一种信号转导分子,突变导致了多种恶性黑色素瘤的发生。
例如,维米非尼和达替尼等小分子靶向药物能够抑制BRAF的活性,减少肿瘤细胞的增殖和转移。
5.PD-1(程序性死亡受体1)和PD-L1(程序性死亡配体1):PD-1和PD-L1参与抑制免疫系统对肿瘤的攻击,突变导致肿瘤逃避免疫监视。
一些免疫检查点抑制剂如伊普替尼和纳武利尼等能够靶向PD-1或PD-L1,恢复免疫系统的抗肿瘤活性。
除了上述靶点外,还有许多其他热门的抗肿瘤靶点及小分子靶向药物,如PI3K、FLT3、VEGFR等。
这些靶点及药物的发现和应用为肿瘤治疗提供了新的进展和希望。
需要注意的是,虽然靶向药物在抗肿瘤治疗中具有重要作用,但并非适用于所有患者。
个体化治疗是当前的研究热点,通过检测患者的肿瘤基因和蛋白表达水平来选择最合适的靶向药物,以提高治疗效果和减少不良反应。
抗肿瘤药物的作用机制与新靶点肿瘤,这个令人闻之色变的词汇,一直是医学界努力攻克的难题。
而抗肿瘤药物,则是对抗肿瘤的重要武器。
了解它们的作用机制和新靶点,对于开发更有效的治疗方法、提高肿瘤患者的生存率和生活质量,具有至关重要的意义。
抗肿瘤药物的作用机制多种多样,大致可以分为以下几类。
一是细胞毒性药物,它们通过直接损伤肿瘤细胞的 DNA 结构或干扰其合成,从而抑制肿瘤细胞的生长和分裂。
例如,烷化剂类药物能与肿瘤细胞的 DNA 发生共价结合,导致 DNA 链断裂和交联,使细胞无法正常复制和转录。
铂类化合物则通过与 DNA 形成加合物,阻碍DNA 的复制和转录,最终诱导肿瘤细胞凋亡。
二是靶向药物,这类药物能够特异性地针对肿瘤细胞中异常激活的信号通路或分子靶点发挥作用。
例如,针对表皮生长因子受体(EGFR)的靶向药物,可以阻断 EGFR 介导的细胞增殖信号传导,从而抑制肿瘤细胞的生长。
还有针对血管内皮生长因子(VEGF)的药物,通过抑制肿瘤血管生成,切断肿瘤细胞的营养供应,达到抑制肿瘤生长的目的。
三是免疫治疗药物,它们通过调节人体自身的免疫系统来对抗肿瘤。
免疫检查点抑制剂,如 PD-1/PDL1 抑制剂,能够解除肿瘤细胞对免疫系统的抑制,使免疫系统重新识别并攻击肿瘤细胞。
另外,过继性细胞免疫治疗,如 CART 细胞治疗,是通过对患者自身的免疫细胞进行基因改造,使其能够特异性识别和杀伤肿瘤细胞。
随着对肿瘤生物学的深入研究,不断有新的抗肿瘤靶点被发现。
其中一个重要的新靶点是肿瘤干细胞。
肿瘤干细胞具有自我更新和多向分化的能力,被认为是肿瘤发生、发展和复发的根源。
针对肿瘤干细胞的药物研发,有望从根本上解决肿瘤的治疗难题。
另一个新靶点是肿瘤微环境。
肿瘤微环境由肿瘤细胞、免疫细胞、基质细胞、细胞外基质以及各种细胞因子等组成。
研究发现,肿瘤微环境在肿瘤的发生、发展和转移中起着重要作用。
因此,通过调节肿瘤微环境来治疗肿瘤成为了一个新的研究方向。
Aurora-A激酶及其抑制剂研究进展许晓辉;孙陶利;朱玉婷【摘要】Aurora-A 是 Aurora 激酶家族中的重要成员之一,在细胞有丝分裂过程中发挥着重要功能, Aurora-A的过度表达与人类多种恶性肿瘤紧密相关。
鉴于Aurora-A的重要作用,其被作为一个设计抗肿瘤药物的新靶点。
目前已有几种选择性Aurora-A激酶抑制剂进入到临床研究中,并且表现出良好的治疗效果。
本文从Aurora-A激酶的生物学、与肿瘤的密切关系及其抑制剂的研发状况进行综述。
%Aurora-A is an important member of Aurora kinase family,which plays a signifi-cant function in cell mitosis process.The overexpression of Aurora-A is closely associated with a va-riety of human tumors.Aurora-A is designed as a new target for anticancer drugs,owing to its major function in cell mitosis.At present,a few selective inhibitors of Aurora-A kinase have entered the clinical study and showed good therapeutic effect.In this article,we will state the biological proper-ties of Aurora-A kinase.At the same time,we will introduce the close relationship between Aurora-A kinase and tumor,and further outline the development status of Aurora-A kinase inhibitors.【期刊名称】《转化医学杂志》【年(卷),期】2014(000)002【总页数】5页(P79-83)【关键词】Aurora-A;有丝分裂;抗肿瘤;激酶抑制剂【作者】许晓辉;孙陶利;朱玉婷【作者单位】744000 甘肃平凉,平凉市药品检验检测中心;423000 湖南郴州,湘南学院基础医学部;723000 陕西汉中,汉中市人民医院药剂科【正文语种】中文【中图分类】R284.1;R914.5近几年来,人们发现一种新的能调节中心体和微管功能的丝氨酸-苏氨酸蛋白激酶-Aurora蛋白家族,Aurora激酶的突变会导致中心体分离异常,形成单极纺锤体。