2020高三公开课原电池、化学电源
- 格式:ppt
- 大小:1.59 MB
- 文档页数:20

第2讲原电池化学电源考纲要求:1.了解原电池的工作原理,能写出电极反应和电池反应方程式。
2.了解常见化学电源的种类及其工作原理。
考点一原电池原理[教材知识层面]1.概念把化学能转化为电能的装置。
2.构成条件(1)有两个活泼性不同的电极(常见为金属或石墨)。
(2)将电极插入电解质溶液中。
(3)两电极间构成闭合回路(两电极接触或用导线连接)。
(4)能自发发生氧化还原反应。
3.工作原理如图是CuZn原电池,请填空:(1)反应原理:(2)原电池中的三个方向:①电子方向:从负极流出沿导线流入正极;②电流方向:从正极沿导线流向负极;③离子的迁移方向:电解质溶液中,阴离子向负极迁移,阳离子向正极迁移。
(3)两种装置的比较:装置Ⅰ中还原剂Zn与氧化剂Cu2+直接接触,易造成能量损耗;装置Ⅱ能避免能量损耗;装置Ⅱ中盐桥的作用是提供离子迁移通路,导电。
[高考考查层面]命题点1 与原电池原理有关的辨析理解原电池的工作原理要注意的四点(1)只有放热的氧化还原反应才能通过设计成原电池将化学能转化为电能。
(2)电解质溶液中阴、阳离子的定向移动,与导线中电子的定向移动共同形成了一个完整的闭合回路。
(3)不论在原电池还是在电解池中,电子均不能通过电解质溶液。
(4)原电池负极失去电子的总数等于正极得到电子的总数。
[典题示例]1.在如图所示的8个装置中,属于原电池的是( )A.①④B.③④⑤C.④⑧ D.②④⑥⑦【答案】D【解析】根据原电池的构成条件可知:①中只有一个电极,③中两电极材料相同,⑤中酒精不是电解质,⑧中两电极材料相同且无闭合回路,故①③⑤⑧不能构成原电池。
2.如图,在盛有稀H2SO4的烧杯中放入用导线连接的电极X、Y,外电路中电子流向如图所示,关于该装置的下列说法正确的是( )A.外电路的电流方向为:X→外电路→YB.若两电极分别为铁和碳棒,则X为碳棒,Y为铁C.X极上发生的是还原反应,Y极上发生的是氧化反应D.若两电极都是金属,则它们的活动性强弱为X>Y【答案】D【解析】外电路电子流向为X→外电路→Y,电流方向与其相反,X极失电子,作负极,Y极发生的是还原反应,X极发生的是氧化反应。


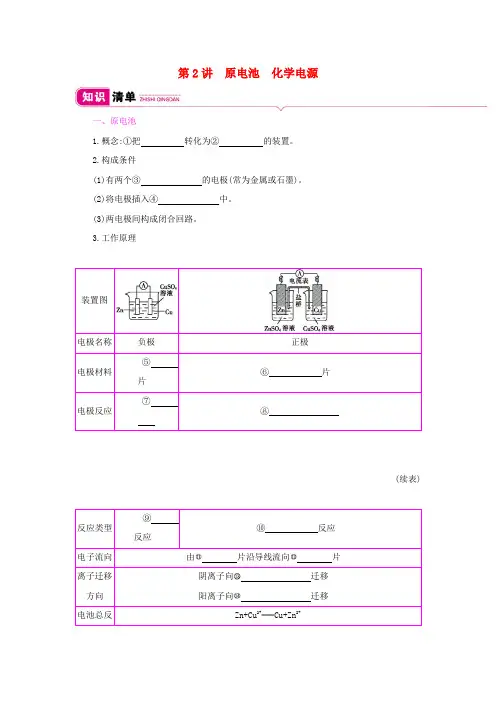
第2讲原电池化学电源一、原电池1.概念:①把转化为②的装置。
2.构成条件(1)有两个③的电极(常为金属或石墨)。
(2)将电极插入④中。
(3)两电极间构成闭合回路。
3.工作原理(续表)电子流向由片沿导线流向片离子迁移阴离子向迁移阳离子向迁移电池总反Zn+Cu2+Cu+Zn2+二、化学电源的种类及其工作原理1.一次电池(碱性锌锰电池)碱性锌锰电池的工作原理如图所示:负极(Zn),电极反应式为。
正极(MnO2),电极反应式为2MnO2+2H2O+2e-2MnOOH+2OH-。
总反应式:Zn+2MnO2+2H2O Zn(OH)2+2MnOOH。
2.二次电池(以铅蓄电池为例)(1)放电时的反应a.负极反应:。
b.正极反应:PbO2+4H++S-+2e-PbSO4+2H2O。
c.总反应:Pb+PbO2+2H2SO42PbSO4+2H2O。
(2)充电时的反应a.阴极反应:。
b.阳极反应:。
c.总反应:2PbSO4+2H2O Pb+PbO2+2H2SO4。
3.燃料电池(以氢氧燃料电池为例)负极反应正极反应电池总反2H2+O22H2O⑤锌⑥铜⑦Zn-2e-Zn2+⑧Cu2++2e-Cu ⑨氧化⑩还原锌铜负极正极Zn+2OH--2e-Zn(OH)2Pb+S--2e-PbSO4PbSO4+2e-Pb+S-PbSO4+2H2O-2e-PbO2+4H++S-2H2-4e-4H+2H2+4OH--4e-4H2O O2+4H++4e-2H2O O2+2H2O+4e-4OH-1.原电池实质的2个方面(1)能量转化:化学能转化为电能。
(2)反应本质:自发进行的氧化还原反应。
2.原电池中的4个“方向”(1)外电路中电子移动方向:负极→正极。
(2)外电路中电流方向:正极→负极。
(3)电池内部离子移动方向:阴离子→负极,阳离子→正极。
(4)盐桥中(含饱和KCl溶液)离子移动方向:K+→正极,Cl一→负极。
3.判断原电池正负极的6种方法电极材料、电极现象、电子移向、离子移向、得失电子、电解质溶液。

2020年高考一轮复习第十九讲原电池与化学电源教材版本全国通用课时120分钟知识点原电池的概念及组成、原电池的工作原理、原电池的判定、化学电源;复习目标1、掌握原电池的基本概念、装置特点、形成条件、反应原理。
2、熟练掌握原电池电极方程式以及总反应方程式的书写。
3、洞悉原电池原理在生产生活中的应用。
复习重点1、原电池的电子移动方向、离子迁移方向。
2、对几种化学电源的电极反应式的认识和书写。
3、原电池原理的应用。
复习难点电极反应式的书写、原电池原理的应用一、自我诊断知己知彼1、【2017浙江理综】银锌电池是一种常见化学电源,其原理反应:Zn+Ag2O+H2O═Zn(OH)2+2Ag,其工作示意图如图。
下列说法不正确的是()A.Zn电极是负极B.Ag2O电极上发生还原反应C.Zn电极的电极反应式:Zn﹣2e﹣+2OH﹣═Zn(OH)2D.放电前后电解质溶液的pH保持不变2、【2017新课标Ⅲ】全固态锂硫电池能量密度高、成本低,其工作原理如图所示,其中电极a常用掺有石墨烯的S8材料,电池反应为:16Li+xS8=8Li2S x(2≤x≤8)。
下列说法错误的是()A.电池工作时,正极可发生反应:2Li2S6+2Li++2e﹣=3Li2S4B.电池工作时,外电路中流过0.02 mol电子,负极材料减重0.14 gC.石墨烯的作用主要是提高电极a的导电性D.电池工作时,电解液中的S82﹣向a电极迁移3、(2013·新课标全国卷Ⅱ,11)“ZEBRA”蓄电池的结构如图所示,电极材料多孔Ni/NiCl2和金属钠之间由钠离子导体制作的陶瓷管相隔。
下列关于该电池的叙述错误的是()A.电池反应中有NaCl生成B.电池的总反应是金属钠还原三价铝离子C.正极反应为NiCl2+2e-===Ni+2Cl-D.钠离子通过钠离子导体在两电极间移动4、某同学做了如下实验:下列说法中正确的是()A.加热铁片I所在烧杯,电流表指针会发生偏转B.用KSCN溶液检验铁片Ⅱ、IV附近溶液,可判断电池的正、负极C.铁片I、Ⅱ的腐蚀速率相等D. “电流计指针未发生偏转”,说明铁片I、铁片Ⅱ均未被腐蚀5、【2017.11浙江模考选考】金属(M)-空气电池的工作原理如图所示。



课题原电池化学电源教案长沙县高三化学一轮复习集体备课教案设计学校名称长沙县七中设计人课时安排2课时课题原电池化学电源教学目标分析高考考纲要求1.了解原电池的工作原理,能写出电极反应和电池反应方程式。
2.了解常见化学电源的种类及其工作原理。
知识目标1.了解原电池的工作原理,能写出电极反应和电池反应方程式。
2.了解常见化学电源的种类及其工作原理。
德育目标重、难点阐释原电池正负极的判断和电极反应式的书写原电池原理的应用学法指导教具设计教学过程问题引导二次备课一、知识点整理知识点一原电池1.概念把________能转化为____能的装置。
2.工作原理:(以锌铜原电池为例)电极名称负极正极电极材料电极反应反应类型电子流向由Zn沿导线流向Cu3.原电池构成条件(1)两个____________的电极。
(2)将电极插入______________中。
(3)用导线连接电极构成____________。
(4)能自发进行的____________________。
总之原电池的工作原理和电子流向可用下列图示表示:1.在原电池中是否较活泼金属一定作负极?2.原电池内部阴、阳离子如何移动?3.怎样判断原电池的正负极?知识点二 化学电源 1.一次电池(1)碱性锌锰干电池负极反应:____________________________________________________________;正极反应:2MnO 2+2H 2O +2e -===2MnOOH +2OH -; 总反应式:Zn +2MnO 2+2H 2O===2MnOOH +Zn(OH)2。
(2)锌银电池负极反应:_____________________________________________________________;正极反应:Ag 2O +H 2O +2e -===2Ag +2OH -; 总反应式:Zn +Ag 2O +H 2O===Zn(OH)2+2Ag 。



考点一原电池的工作原理1.概念和反应本质原电池是把化学能转化为电能的装置,其反应本质是氧化还原反应。
2.原电池的构成条件(1)一看反应:看是否有能自发进行的氧化还原反应发生(一般是活泼性强的金属与电解质溶液反应)。
(2)二看两电极:一般是活泼性不同的两电极。
(3)三看是否形成闭合回路,形成闭合回路需三个条件:①电解质溶液;②两电极直接或间接接触;③两电极插入电解质溶液中。
3.工作原理以锌铜原电池为例(1)反应原理(2)盐桥的组成和作用①盐桥中装有饱和的KCl、KNO3等溶液和琼胶制成的胶冻。
②盐桥的作用:①连接内电路,形成闭合回路;②平衡电荷,使原电池不断产生电流。
(3)图Ⅰ中Zn在CuSO4溶液中直接接触Cu2+,会有一部分Zn与Cu2+直接反应,该装置中既有化学能和电能的转化,又有一部分化学能转化成了热能,装置的温度会升高。
图Ⅱ中Zn和CuSO4溶液分别在两个池子中,Zn与Cu2+不直接接触,不存在Zn与Cu2+直接反应的过程,所以仅是化学能转化成了电能,电流稳定,且持续时间长。
关键点:盐桥原电池中,还原剂在负极区,而氧化剂在正极区。
深度思考1.正误判断,正确的划“√”,错误的划“×”(1)在原电池中,发生氧化反应的一极一定是负极()(2)在原电池中,负极材料的活泼性一定比正极材料强()(3)在原电池中,正极本身一定不参与电极反应,负极本身一定要发生氧化反应()(4)其他条件均相同,带有“盐桥”的原电池比不带“盐桥”的原电池电流持续时间长()(5)在锌铜原电池中,因为有电子通过电解质溶液形成闭合回路,所以有电流产生()答案(1)√(2)×(3)×(4)√(5)×2.能用金属代替盐桥吗?答案不可以,在电路接通的情况下,这个盐桥只是整个回路的一部分,随时要保持电中性,琼胶作为盐桥因其中含有两种离子,可以与溶液中的离子交换,从而达到传导电流的目的,而且琼胶本身可以容纳离子在其中运动;若用金属代替盐桥,电子流向一极后不能直接从另一极得到补充,必然结果就是向另一极释放金属阳离子或者溶液中的金属阳离子在电子流出的那一极得电子析出金属,从而降低了整个电池的电势。
原电池化学电源【考纲要求】1、理解原电池的构成、工作原理及应用,能写出电极反应和总反应方程式。
2、了解常见化学电源的种类及其工作原理【基础知识回顾】一、原电池的概念和反应本质1、原电池的定义:原电池是把化学能转化为电能的装置,其反应本质是氧化还原反应2、组成原电池的条件(1)两个活泼性不同的电极:①其中一个相对较活泼,另一个相对较不活泼,如:金属与金属、金属与非金属、非金属与非金属②燃料电池中两极可同选石墨或铂(2)电解质溶液(溶液或者熔融)(3)电极用导线相连并插入电解液构成闭合回路(两个半电池要用盐桥连接)(4)有自发进行的氧化还原反应4、规避原电池工作原理的4个失分点(1)只有自发进行的氧化还原反应才能通过设计成原电池将化学能转化为电能(2)电解质溶液中阴、阳离子的定向移动与导线中电子的定向移动共同组成了一个完整的闭合回路(3)无论在原电池还是电解池中,电子均不能通过电解质溶液(4)原电池的负极失去电子的总数等于正极得到电子的总数二、原电池的工作原理:如图是两种锌铜原电池示意图1、反应原理电极名称负极正极电极材料锌片铜片电极反应Zn-2e-===Zn2+Cu2++2e-===Cu反应类型氧化反应还原反应电池反应Zn+Cu2+===Zn2++Cu电子流向由Zn沿导线流向Cu(电子由负极经导线流向正极)电流流向由Cu沿导线流向Zn(电流由正极经导线流向负极)离子移向盐桥含饱和KCl溶液,K+移向正极,Cl-移向负极2、原电池中的三个方向(1)电子流动方向:从负极流出沿导线流入正极(2)电流流动方向:从正极沿导线流向负极(3)离子迁移方向:电解质溶液中,阴离子向负极迁移,阳离子向正极迁移3、两个装置的比较:装置Ⅰ中Zn在CuSO4溶液中直接接触Cu2+,会有一部分Zn与Cu2+直接反应,该装置中既有化学能和电能的转化,又有一部分化学能转化成了热能,装置的温度会升高,易造成能量损耗;装置Ⅱ中Zn和CuSO4溶液分别在两个池中,Zn与Cu2+不直接接触,不存在Zn与Cu2+直接反应的过程,所以仅是化学能转化成了电能,能避免能量损耗,且电流稳定,持续时间长。
第18讲原电池化学电源1.理解原电池的构成、工作原理及应用。
2.能书写电极反应和总反应方程式。
3.了解常见化学电源的种类及工作原理。
考点一原电池的工作原理及应用1.概念及本质原电池是把化学能转化为电能的装置,其反应的本质是氧化还原反应。
2.构成条件(1)原电池反应必须是能自发地发生的氧化还原反应(一般是活泼性强的金属与电解质溶液反应)。
(2)原电池的两个电极必须是活泼性不同的电极(材料可以是金属或导电的非金属)。
①活泼性较强的金属作负极。
②活泼性较弱的金属或能导电的非金属作正极。
(3)电极、电解质溶液(或熔融电解质)外电路形成闭合回路,其中形成闭合回路需三个条件:①电解质溶液;②两电极直接或间接接触;③两电极插入电解质溶液(或熔融电解质)中。
[想一想]能自发进行的氧化还原反应一定能设计成原电池吗?提示:不一定。
因为原电池反应是一个释放能量的反应。
所以只有释放能量的、能自发进行的氧化还原反应才能设计成原电池。
3.工作原理以铜锌原电池为例(1)盐桥的组成:盐桥中装有饱和的KCl、KNO3等溶液和琼胶制成的胶冻。
(2)盐桥的作用:①连接内电路,形成闭合回路;②平衡电荷,使原电池不断产生电流。
4.基本应用(1)用于金属的防护使被保护的金属制品作原电池正极而得到保护。
例如,要保护一个铁质的输水管道或钢桥桥梁等,可用导线将其与一块锌块相连,使锌作原电池的负极。
[想一想]如果电工操作上把铜导线与铝导线连接在一起使用,会造成什么后果?说明原因。
提示:铝比铜活泼,铜、铝接触在潮湿的环境中形成原电池,加快了铝的腐蚀,易造成电路断路。
(2)加快氧化还原反应的速率一个自发进行的氧化还原反应,设计成原电池时反应速率增大。
例如,在Zn与稀H2SO4反应时加入少量CuSO4溶液能使产生H2的反应速率加快。
(3)比较金属活泼性强弱两种金属分别作原电池的两极时,一般作负极的金属比作正极的金属活泼。
(4)设计制作化学电源①分析氧化还原反应,找出氧化剂、还原剂、氧化产物和还原产物,将其分成氧化反应和还原反应两个半反应。