肿瘤常见信号通路
- 格式:docx
- 大小:40.85 KB
- 文档页数:15

癌症肿瘤抑制信号通路癌症,作为一种严重威胁人类健康的疾病,一直是全球关注的焦点之一。
而今天,我们要探讨的是癌症肿瘤抑制信号通路,即那些可以抑制肿瘤生长和发展的关键信号传递途径。
了解这些信号通路,对于癌症的治疗和预防具有重要意义。
信号通路是由一系列分子组成的,它们在细胞内传递信息,控制细胞的生长、分化、凋亡等过程。
当这些信号通路受到突变或异常改变时,就会导致细胞失控分裂和癌症的发生。
而抑制癌症发展的信号通路则是一些能够抑制细胞分裂和促进凋亡的重要途径。
一、PI3K/Akt信号通路PI3K/Akt信号通路在许多类型的癌症中起着重要的作用。
PI3K激酶可以激活Akt蛋白激酶,通过磷酸化等方式调节下游靶点,促进细胞存活和增殖。
然而,当PI3K/Akt信号通路过度活化时,会导致细胞的无限增殖和抗凋亡能力增强,从而促进癌症的发生。
因此,针对这一信号通路进行抑制,已经成为癌症治疗的重要策略之一。
二、p53信号通路p53被称为“基因守护者”,它是人体内最重要的抑制癌症的基因之一。
p53信号通路在细胞受到DNA损伤时被激活,可以停止细胞周期、修复DNA或引发细胞凋亡。
然而,在许多类型的癌症中,p53基因突变或丢失会导致信号通路的丧失,使细胞失去了对DNA损伤的应答能力。
因此,寻找复活或修复p53信号通路的策略成为了抑制癌症发展的重要研究方向。
三、RAS/MAPK信号通路RAS/MAPK信号通路参与控制细胞的生长、分化和凋亡等重要过程。
在正常细胞中,RAS蛋白会受到外部信号的激活,并通过激活下游信号分子MAPK来调控细胞的功能。
然而,在许多种癌症中,RAS基因突变会导致该信号通路的过度激活,使细胞不受控制地增殖和分裂,从而导致肿瘤的形成。
因此,研究和开发针对RAS/MAPK信号通路的抑制剂,对于治疗这些癌症具有重要意义。
四、Wnt信号通路Wnt信号通路在胚胎发育和肿瘤的发生中都起着重要作用。
正常情况下,Wnt信号通路会通过调节靶点基因的表达,来调控细胞的增殖和分化。

肿瘤细胞内外信号通路交互机制解析肿瘤是一种严重威胁人类健康的疾病,它的发生和发展是一个复杂而多样化的过程。
研究表明,肿瘤细胞的生长和转移受到细胞内外信号通路的调控。
肿瘤细胞内外信号通路的交互机制对于揭示肿瘤发生发展的分子机制具有重要意义。
首先,肿瘤细胞内信号通路对于肿瘤的发生和发展起着关键作用。
细胞内信号通路可以通过多种途径传递信号,进而调节细胞的生长、分化、凋亡等生物学过程。
其中,一些关键的信号通路如Ras信号通路、PI3K/Akt信号通路、Wnt信号通路和NOTCH信号通路等在肿瘤中被发现异常激活。
这些异常激活的信号通路可以促进肿瘤细胞的增殖、抑制其凋亡,从而推动肿瘤的发生和发展。
与此同时,肿瘤细胞也能够通过与细胞外环境的相互作用,进一步调节信号通路的活性。
细胞外环境中存在大量的细胞因子、细胞外基质和邻近细胞释放的物质,它们可以通过与肿瘤细胞表面的受体结合,触发特定的信号通路。
例如,细胞外因子EGF与其受体EGFR结合后,能够激活Ras信号通路,促进肿瘤细胞的增殖和存活。
类似地,胞外基质的附件也可以通过与肿瘤细胞表面的整合素结合,激活PI3K/Akt信号通路,并参与调节肿瘤细胞的运动和侵袭。
此外,肿瘤细胞内外信号通路之间也可以相互调节和影响,形成复杂的信号网络。
一些细胞因子和受体表达异常会导致信号通路的激活或静默,进而影响肿瘤细胞的生物学行为。
例如,肿瘤细胞上过表达HER2受体的乳腺癌患者对于靶向治疗药物曲妥珠单抗的耐药性较高。
研究发现,HER2受体活化后,会激活细胞内信号通路PI3K/Akt,从而促进肿瘤细胞的存活和复制。
因此,联合使用HER2受体阻断剂和PI3K/Akt抑制剂,可以增加曲妥珠单抗的抗肿瘤疗效。
另外,炎症反应也可以通过影响肿瘤细胞内外信号通路的活性,参与调控肿瘤的发生和发展。
炎症细胞释放的细胞因子和缺氧环境中产生的乙酰化物质可以激活NF-κB信号通路,从而促进肿瘤细胞的存活和侵袭。

肿瘤的细胞增殖信号通路肿瘤是一种导致细胞无限制增殖的疾病,其发展涉及复杂的信号通路调控网络。
了解肿瘤细胞增殖信号通路的机制,可以帮助我们更好地理解肿瘤的发生与发展,并为肿瘤治疗提供新的策略。
本文将重点介绍几个与肿瘤细胞增殖密切相关的信号通路。
一、PI3K-Akt信号通路PI3K-Akt信号通路是一条重要的细胞增殖信号通路,它在多种肿瘤中起到关键作用。
该通路的激活可以促进细胞增殖、增加细胞生存能力,同时抑制细胞凋亡过程。
在正常细胞中,该通路会受到严格的调控,以防止不受控制的细胞增殖。
而在肿瘤细胞中,PI3K-Akt信号通路常常被异常激活,导致细胞无限制增殖。
二、Ras-MAPK信号通路Ras-MAPK信号通路是另一个与肿瘤细胞增殖密切相关的信号通路。
该通路的激活可以促进细胞增殖、增强细胞迁移和侵袭能力。
在正常细胞中,该通路通常处于关闭状态,只有在特定刺激下才会被激活。
然而,在某些肿瘤中,Ras基因突变或过度表达会导致该通路的异常激活,从而推动肿瘤细胞的增殖。
三、Wnt/β-catenin信号通路Wnt/β-catenin信号通路在胚胎发育和成体组织的维持中发挥着重要作用。
研究表明,该通路在多种肿瘤中也起到关键作用。
在正常细胞中,Wnt信号通路处于关闭状态。
然而,在某些肿瘤中,该通路的异常激活导致β-catenin的稳定和核定位增加,从而促进肿瘤细胞的增殖和侵袭。
四、Notch信号通路Notch信号通路是一种高度保守的跨膜受体信号通路,在细胞分化和增殖中发挥着重要作用。
该通路的激活可以启动多种细胞命运的决定,包括细胞增殖和凋亡。
在某些肿瘤中,Notch信号通路的异常激活可以导致细胞增殖能力的提高,进而促进肿瘤的发展。
总结:肿瘤的细胞增殖信号通路涉及多个复杂的信号通路网络,其中包括PI3K-Akt、Ras-MAPK、Wnt/β-catenin和Notch等信号通路。
这些信号通路的异常激活可以导致肿瘤细胞的不受控制增殖,推动肿瘤的发展。
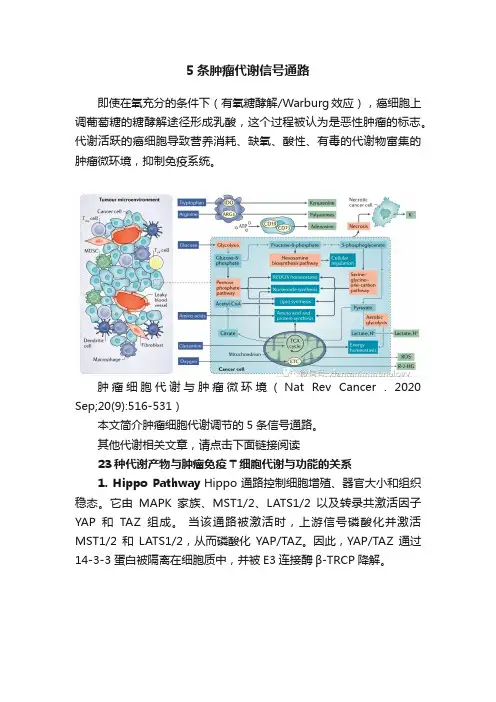
5条肿瘤代谢信号通路即使在氧充分的条件下(有氧糖酵解/Warburg效应),癌细胞上调葡萄糖的糖酵解途径形成乳酸,这个过程被认为是恶性肿瘤的标志。
代谢活跃的癌细胞导致营养消耗、缺氧、酸性、有毒的代谢物富集的肿瘤微环境,抑制免疫系统。
肿瘤细胞代谢与肿瘤微环境(Nat Rev Cancer . 2020 Sep;20(9):516-531)本文简介肿瘤细胞代谢调节的5条信号通路。
其他代谢相关文章,请点击下面链接阅读23种代谢产物与肿瘤免疫T细胞代谢与功能的关系1. Hippo Pathway Hippo通路控制细胞增殖、器官大小和组织稳态。
它由MAPK家族、MST1/2、LATS1/2以及转录共激活因子YAP和TAZ组成。
当该通路被激活时,上游信号磷酸化并激活MST1/2和LATS1/2,从而磷酸化YAP/TAZ。
因此,YAP/TAZ通过14-3-3蛋白被隔离在细胞质中,并被E3连接酶β-TRCP降解。
Annu Rev Pathol. 2021 January 24; 16: 299–322然而,当Hippo信号通路关闭时,YAP/TAZ易位到细胞核,与转录增强相关域(TEAD)转录因子结合,诱导致癌靶基因的表达。
Hippo通路受到广泛的上游调控因子的调控,包括细胞-细胞接触、来自周围环境刺激、Wnt信号传导、GPCR-配体相互作用和各种细胞应激条件。
YAP/TAZ促进糖酵解和谷氨酸代谢YAP/TAZ活性在许多类型的癌症中都是过度活跃。
hHippo通路作为细胞生长的主调节因子,参与了多种代谢过程。
YAP/TAZ活性通过直接和间接提高糖酵解酶活性来促进糖酵解。
特别是,YAP/TAZ的活性增加了TEAD对GLUT3的表达,并通过FOXC2诱导了HK2的表达。
YAP/TAZ还通过Hedgehog信号通路促进LncRNABCAR4的表达,上调HK2和PFKFB3。
YAP/TAZ增强谷氨酰胺代谢,增加乳腺癌细胞中谷氨酰胺转运体SLC1A5和SLC7A5的表达。


1 JAK-STAT信号通路1) JAK与STAT蛋白JAK-STAT信号通路是近年来发现的一条由细胞因子刺激的信号转导通路,参与细胞的增殖、分化、凋亡以及免疫调节等许多重要的生物学过程。
与其它信号通路相比,这条信号通路的传递过程相对简单,它主要由三个成分组成,即酪氨酸激酶相关受体、酪氨酸激酶JAK和转录因子STAT。
(1) 酪氨酸激酶相关受体(tyrosine kinase associated receptor)许多细胞因子和生长因子通过JAK-STAT信号通路来传导信号,这包括白介素2?7(IL-2?7)、GM-CSF(粒细胞/巨噬细胞集落刺激因子)、GH(生长激素)、EGF(表皮生长因子)、PDGF (血小板衍生因子)以及IFN(干扰素)等等。
这些细胞因子和生长因子在细胞膜上有相应的受体。
这些受体的共同特点是受体本身不具有激酶活性,但胞内段具有酪氨酸激酶JAK的结合位点。
受体与配体结合后,通过与之相结合的JAK的活化,来磷酸化各种靶蛋白的酪氨酸残基以实现信号从胞外到胞内的转递。
(2) 酪氨酸激酶JAK(Janus kinase)很多酪氨酸激酶都是细胞膜受体,它们统称为酪氨酸激酶受体(receptortyrosine kinase, RTK),而JAK却是一类非跨膜型的酪氨酸激酶。
JAK是英文Janus kinase的缩写,Janus在罗马神话中是掌管开始和终结的两面神。
之所以称为两面神激酶,是因为JAK既能磷酸化与其相结合的细胞因子受体,又能磷酸化多个含特定SH2结构域的信号分子。
JAK蛋白家族共包括4个成员:JAK1、JAK2、JAK3以及Tyk2,它们在结构上有7个JAK同源结构域(JAK homology domain, JH),其中JH1结构域为激酶区、JH2结构域是“假”激酶区、JH6和JH7是受体结合区域。
(3) 转录因子STAT(signal transducer and activator of transcription) STAT 被称为“信号转导子和转录激活子”。

肝癌的细胞信号通路和抗肿瘤药物细胞信号通路是维持细胞正常功能、调控生长和代谢的关键机制。
在肝癌的发展过程中,多个信号通路异常活化,导致细胞增殖、转移和抵抗药物治疗。
因此,研究肝癌细胞信号通路并发展相应的抗肿瘤药物具有重要意义。
本文将介绍肝癌的常见细胞信号通路,并探讨目前已开发的抗肿瘤药物。
一、Wnt/β-catenin信号通路Wnt/β-catenin信号通路在肝癌中起着重要作用。
正常情况下,Wnt 蛋白家族通过与细胞膜受体Frizzled结合,活化Dishevelled蛋白并进一步激活β-catenin。
在肝癌中,这个信号通路异常激活,导致β-catenin在细胞核内积累,并与转录因子结合,促进癌细胞的增殖和生存。
针对Wnt/β-catenin信号通路的抗肿瘤药物包括IWP-2、XAV939、LGK-974等。
这些药物可以抑制β-catenin的核转位、抑制其与转录因子的结合,从而抑制肝癌细胞的生长和侵袭转移。
二、Ras/Raf/MEK/ERK信号通路Ras/Raf/MEK/ERK信号通路是常见的细胞增殖通路,其异常活化与肝癌的发生和发展密切相关。
在正常情况下,外源性生长因子与受体相结合,激活Ras蛋白,进而激活Raf激酶、MEK激酶和ERK激酶。
而在肝癌中,这个信号通路常常异常活化,导致癌细胞不受调控地生长和分化。
目前,针对Ras/Raf/MEK/ERK信号通路的抗肿瘤药物包括索拉非尼(Sorafenib)、达拉菲尼(Dabrafenib)等。
这些药物通过抑制Raf激酶活性,从而抑制信号通路的传导,减少肝癌细胞的增殖和生存。
三、PI3K/Akt/mTOR信号通路PI3K/Akt/mTOR信号通路在肝癌的发展过程中也起着重要作用。
PI3K被激活后,可以激活蛋白激酶B(Akt),进而活化mTOR激酶,促进癌细胞生长、存活和转移。
目前,已有一些针对PI3K/Akt/mTOR信号通路的抗肿瘤药物问世,如依维莫司(Everolimus)、地西卡素(Deforolimus)等。

肿瘤细胞的信号转导通路信号传导通路是将胞外刺激由细胞表面传入细胞内,启动了胞浆中的信号转导通路,通过多种途径将信号传递到胞核内,促进或抑制特定靶基因的表达。
一、MAPK信号通路MAPK信号通路介导细胞外信号到细胞内反应。
丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)主要位于细胞浆,很多生长因子所激活,活化后既可以磷酸化胞浆内的靶蛋白,也能进入细胞核作用于对应的转录因子,调节靶基因的表达。
调节着细胞的生长、分化、分裂、死亡各个阶段的生理活动以及细胞间功能同步化过程,并在细胞恶变和肿瘤侵袭转移过程中起重要作用,阻断MAPK途径是肿瘤侵袭转移的治疗新方向。
MAPK信号转导通路是需要经过多级激酶的级联反应,其中包括3个关键的激酶,即MAPK激酶激酶(MKKK)→MAPK激酶(MKK)→MAPK。
(一)MKKK:包括Raf、Mos、Tpl、SPAK、MUK、MLK和MEKK等,其中Raf又分为A-Raf、B-Raf、Raf-1等亚型;MKKK是一个Ser/Thr蛋白激酶,被MAPKKKK、小G蛋白家族成员Ras、Rho激活后可Ser/Thr磷酸化激活下游激酶MKK。
MKK识别下游MAPK分子中的TXY序列(“Thr-X-Tyr”模序,为MAPK第Ⅷ区存在的三肽序列Thr-Glu-Tyr、Thr-Pro-Tyr或Thr-Gly-Tyr),将该序列中的Thr和Tyr分别磷酸化后激活MAPK。
注:TXY序列是MKK活化JNK的双磷酸化位点,MKK4和MKK7通过磷酸化TXY 序列的第183位苏氨酸残基(Thr183)和第185位酪氨酸残基(Tyr185)激活JNK1。
(二)MKK:包括MEK1-MEK7,主要是MEK1/2;(三)MAPK:MAPK是一类丝氨酸/苏氨酸激酶,是MAPK途径的核心,它至少由4种同功酶组成,包括:细胞外信号调节激酶(Extracellular signal Regulated Kinases,ERK1/2)、C-Jun 氨基末端激酶(JNK)/应激激活蛋白激酶(Stress-activated protein kinase,SAPK)、p38(p38MAPK)、ERK5/BMK1(big MAP kinase1)等MAPK亚族,并根据此将MAPK 信号传导通路分为4条途径。

细胞信号通路在肿瘤发生发展中的作用中文摘要:细胞信号通路在生物体中发挥着重要的作用。
肿瘤的发生和发展与细胞信号通路的异常有着紧密关联。
细胞信号通路可分为多个分支,其中包括WNT、NOTCH、JAK-STAT、PI3K-Akt和RAS-MAPK等分支。
这些信号通路在肿瘤发生和发展中起着不同的作用,可调控细胞的增殖、分化、凋亡和代谢。
此外,一些调节蛋白、激酶和转录因子也参与了肿瘤的发生和发展。
因此,细胞信号通路可能成为肿瘤治疗的重要靶点。
关键词:细胞信号通路;肿瘤;分支;增殖;凋亡英文摘要:Cell signaling pathways play an important role in the organism.The occurrence and development of tumors are closely related tothe abnormality of cell signaling pathways. Cell signaling pathways can be divided into many branches, including WNT, NOTCH, JAK-STAT, PI3K-Akt, and RAS-MAPK. These signaling pathways play different roles in the occurrence and development of tumors, and can regulate the proliferation, differentiation, apoptosis, and metabolism of cells. In addition, some regulatory proteins, kinases, and transcription factors are also involved in the occurrence and development of tumors. Therefore, cell signaling pathways may become an important target for tumor therapy.Keywords: cell signaling pathways; tumor; branch; proliferation; apoptosis小标题:一、细胞信号通路二、肿瘤的异常分子通路三、肿瘤的治疗靶点——细胞信号通路正文:一、细胞信号通路细胞信号通路是一种涉及细胞内和细胞间的信息传递系统。

肿瘤信号转导基因芯片包含了与肿瘤形成15个信号转导通路特定标志物基因。
这些信号通路包括:MAPK通路、WNT通路、Hedgehog通路、STAT通路、应激通路(DNA损伤通路、p53通路、缺氧通路、热激通路、及p38 / JNK通路)、炎症通路(Cox—2通路与NF—κB通路)、survival通路(NF-κB通路与PI3K / AKT通路)、激素通路(雌激素与雄激素通路),以及抗细胞增殖通路(TGFβ通路)。
肿瘤的特征取决于原发组织及遗传和环境因素.每种肿瘤都是特定的信号通路组合的激活或失活所致。
对多重信号通路的分析可以快速了解决定肿瘤生成的可能路径。
这张芯片不仅用于检测与特定肿瘤相关的信号通路,而且可用于检测肿瘤类型.使用这一芯片试剂盒检测RNA实验标本,操作者通过简便的杂交反应技术,即可同时检测上述和肿瘤形成相关的信号转导通路内标志物基因的表达水平变化.Androgen Pathway:CDK2,CDKN1A (p21Waf1/p21Cip1),EGFR,FOLH1, KLK2 (hGK2),KLK3 (PSA), TMEPAI.Cox—2 Pathway:FOS,HSPA4 (hsp70), MCL1,PPARG, PTGS2 (Cox-2),TNFRSF10B (DR5)。
DNA Damage / p53 Pathways:BAX,BCL2, CDKN1A (p21Waf1/p21Cip1),GADD45A (gadd45),HIF1A,HSPA4 (hsp70), IGFBP3, MDM2, PIG3, TNFRSF6 (Fas),TNFRSF10B (TrailR/DR5), TRAF1, WIG1.Estrogen Pathway:BCL2,BRCA1, CTSD (cathepsin D),EGFR,PGR (PR),ZNF147 (Efp)。
Hedgehog Pathway:BMP2,BMP4,EN1 (engrailed), HHIP,FOXA2 (HNF3B), PTCH,PTCH2, WNT1, WNT2, WSB1.Hypoxia Pathway:ADRA1B,CDKN1A, EDN1,EPO, HK1, HMOX1 (HO—1),IGFBP3, NOS2A (iNOS), SLC2A1, TF,TFRC, VEGF.Inflammation / NF-κB Pathways:ICAM1, IL2,LTA (TNFb),NF—ΚB1 (NF-κB),NF-ΚBIA (IκBa),NOS2A (iNOS),PECAM1, TNF (TNFa), VCAM1。
肿瘤的细胞信号通路与治疗靶点在现代医学领域中,肿瘤的产生和发展是一个复杂的过程,涉及到多个细胞信号通路的异常活化。
了解这些异常信号通路以及相关的治疗靶点对于肿瘤的治疗具有重要意义。
本文将介绍几个常见的肿瘤细胞信号通路,以及相关的治疗靶点。
一、PI3K/AKT/mTOR 通路PI3K/AKT/mTOR 通路是细胞命运决定的关键通路之一,它参与细胞生长、增殖、存活以及代谢等生理过程。
在肿瘤细胞中,这一通路常常被异常激活,导致肿瘤的增长和扩散。
因此,该通路成为肿瘤治疗的重要靶点之一。
目前已经有一些针对该通路的治疗药物问世,如白藜芦醇、雷帕霉素等,它们能够靶向抑制该通路,从而阻断肿瘤的生长和扩散。
二、RAS/MAPK 通路RAS/MAPK 通路是细胞增殖和分化的重要调节通路,它负责细胞对外界环境刺激的响应。
当这一通路发生异常激活时,会导致肿瘤的形成。
因此,该通路也是肿瘤治疗的重要靶点之一。
目前,一些靶向该通路的小分子抑制剂已经在临床上应用,如来那度胺、曲妥珠单抗等,它们能够抑制该通路中的关键蛋白激酶,从而阻断肿瘤细胞的增殖和扩散。
三、Wnt/β-catenin 通路Wnt/β-catenin 通路是细胞极性和细胞命运决定的重要调节通路之一,它对于细胞增殖和分化具有重要作用。
该通路在肿瘤中常常出现异常激活,促进肿瘤的生长和转移。
因此,该通路也成为肿瘤治疗的重要靶点之一。
目前已经有一些靶向该通路的治疗药物问世,如力扑平、以色列方程式等,它们能够抑制该通路的异常活化,从而阻止肿瘤的发展。
四、VEGF/VEGFR 通路VEGF/VEGFR 通路是血管生成的主要调控通路,也是肿瘤的血供来源。
该通路在肿瘤细胞中常常过度表达,导致肿瘤的血管生成和转移。
因此,该通路是肿瘤治疗的重要靶点之一。
一些VEGF或VEGFR的抑制剂已经应用于肿瘤的治疗,如贝伐珠单抗、舒尼替尼等,它们能够抑制该通路的异常活化,从而抑制肿瘤的血管生成和生长。
肿瘤细胞的信号转导通路信号传导通路是将胞外刺激由细胞表面传入细胞内,启动了胞浆中的信号转导通路,通过多种途径将信号传递到胞核内,促进或抑制特定靶基因的表达。
一、MAPK信号通路MAPK信号通路介导细胞外信号到细胞内反应。
丝裂原活化蛋白激酶(mitogen activated protein kinase,MAPK)主要位于细胞浆,很多生长因子所激活,活化后既可以磷酸化胞浆内的靶蛋白,也能进入细胞核作用于对应的转录因子,调节靶基因的表达。
调节着细胞的生长、分化、分裂、死亡各个阶段的生理活动以及细胞间功能同步化过程,并在细胞恶变和肿瘤侵袭转移过程中起重要作用,阻断MAPK途径是肿瘤侵袭转移的治疗新方向。
MAPK信号转导通路是需要经过多级激酶的级联反应,其中包括3个关键的激酶,即MAPK激酶激酶(MKKK)→MAPK激酶(MKK)→MAPK。
(一)MKKK:包括Raf、Mos、Tpl、SPAK、MUK、MLK和MEKK等,其中Raf又分为A-Raf、B-Raf、Raf-1等亚型;MKKK是一个Ser/Thr蛋白激酶,被MAPKKKK、小G蛋白家族成员Ras、Rho激活后可Ser/Thr磷酸化激活下游激酶MKK。
MKK识别下游MAPK分子中的TXY序列(“Thr-X-Tyr”模序,为MAPK第Ⅷ区存在的三肽序列Thr-Glu-Tyr、Thr-Pro-Tyr或Thr-Gly-Tyr),将该序列中的Thr和Tyr分别磷酸化后激活MAPK。
注:TXY序列是MKK活化JNK的双磷酸化位点,MKK4和MKK7通过磷酸化TXY 序列的第183位苏氨酸残基(Thr183)和第185位酪氨酸残基(Tyr185)激活JNK1。
(二)MKK:包括MEK1-MEK7,主要是MEK1/2;(三)MAPK:MAPK是一类丝氨酸/苏氨酸激酶,是MAPK途径的核心,它至少由4种同功酶组成,包括:细胞外信号调节激酶(Extracellular signal Regulated Kinases,ERK1/2)、C-Jun 氨基末端激酶(JNK)/应激激活蛋白激酶(Stress-activated protein kinase,SAPK)、p38(p38MAPK)、ERK5/BMK1(big MAP kinase1)等MAPK亚族,并根据此将MAPK 信号传导通路分为4条途径。
肿瘤微环境相关通路
肿瘤微环境(TME)是指肿瘤细胞周围的环境和细胞。
它包括多种类型的细胞、细胞外基质、血管及免疫细胞等。
肿瘤微环境具有影响肿瘤发展的强大能力,对肿瘤的生长、迁移和耐药性等方面都有重要影响。
本文将介绍几个与肿瘤微环境相关的通路。
1. PI3K/Akt通路
PI3K/Akt通路是一条通过许多信号通路参与调节细胞增殖、存活和代谢的通路。
在TME中,激活PI3K/Akt通路可以促进肿瘤细胞生长和迁移,并且可以减少细胞凋亡。
2. NF-κB通路
NF-κB通路是一个关键的调节因子,可以调节多种细胞过程,包括细胞增殖、存活和炎症反应等。
在TME中,NF-κB通路被激活可以促进肿瘤细胞的增殖和迁移,并抑制肿瘤细胞凋亡。
3. Wnt/β-catenin通路
Wnt/β-catenin通路是一个调节基因转录的信号通路,在TME中起着重要作用。
激活Wnt/β-catenin通路会导致β-catenin进入细胞核并激活Wnt靶基因。
在肿瘤微环境,激活这个通路可以促进肿瘤细胞增殖和迁移,并且抑制肿瘤细胞的凋亡。
4. TGF-β通路
TGF-β是一种影响肿瘤生长和转化的细胞因子,在大多数肿瘤中都有表达。
在TME中,TGF-β可以促进肿瘤细胞的增殖和迁移,并且可以抑制免疫细胞的活性。
总之,肿瘤微环境是一个复杂的生态系统,各种因素相互影响,共同影响肿瘤发展。
上面列举的几个通路是其中的一部分,我们需要深入探究肿瘤微环境的机制,以便更好地抑制肿瘤的生长和转移。
肿瘤微环境中的细胞信号通路及其相关途径的研究肿瘤是当前世界严重威胁人类健康的疾病之一,且发病率呈现上升趋势。
肿瘤细胞不仅仅是孤立生长繁殖的细胞单元,更是微环境中与其他细胞和非细胞因素相互作用形成的复杂生态系统中的关键元素。
肿瘤微环境不仅直接影响细胞增殖、凋亡、侵袭、转移等生物学行为,同时改变免疫细胞、血管内皮细胞、间质细胞的功能和分化状态,导致整个肿瘤异质性明显。
因此,肿瘤微环境对于研究肿瘤生理学、病理学和治疗学具有重要意义。
本文将重点介绍肿瘤微环境中的细胞信号通路及其相关途径的研究进展。
1. 细胞外基质信号通路细胞外基质信号通路是肿瘤微环境中最重要的信号通路之一,包括细胞外基质(ECM)分子、胞外基质受体(ECM receptor)、细胞与ECM之间连接的结构、ECM切割酶及其抑制剂等组分。
ECM分子可以通过分泌、外泌或胞外裸露的方式作用于细胞表面的ECM受体,从而引发复杂的信号转导过程。
研究发现,不同的ECM分子可以分别作用于不同的ECM受体,从而导致细胞生长、凋亡、分化、迁移和转移等生物学行为的不同。
2. 细胞间信号通路肿瘤细胞与周围细胞的相互作用发挥着十分重要的作用,其中最为关键的是细胞间的信号通路。
细胞间信号通路可以是细胞表面受体介导的,也可以是转运体介导的,还可以是细胞质内信号分子调节的。
研究发现,细胞间信号通路在肿瘤增殖、侵袭、转移、逃避免疫系统等方面发挥着重要的作用,这些通路可以通过调节细胞增殖、凋亡、分化、迁移和转移等生物学行为而影响肿瘤的进展。
3. 炎症信号通路炎症反应在肿瘤微环境中扮演着重要角色,炎症信号通路对于肿瘤生成、进展和治疗反应具有影响。
肿瘤细胞可以通过诱导细胞外的炎症物质的产生和分泌来改变微环境功能。
研究表明,炎症信号通路在促进肿瘤细胞增殖、迁移、转移、逃避免疫系统和造成肿瘤微环境的免疫耐受均发挥了至关重要的作用。
4. 免疫信号通路肿瘤细胞对宿主免疫系统的躲避、逃避和颠覆等策略是肿瘤发展的关键因素之一。
1 JAK-STAT信号通路1) JAK与STAT蛋白JAK-STAT信号通路是近年来发现的一条由细胞因子刺激的信号转导通路,参与细胞的增殖、分化、凋亡以及免疫调节等许多重要的生物学过程。
与其它信号通路相比,这条信号通路的传递过程相对简单,它主要由三个成分组成,即酪氨酸激酶相关受体、酪氨酸激酶JAK和转录因子STAT。
(1) 酪氨酸激酶相关受体(tyrosine kinase associated receptor)许多细胞因子和生长因子通过JAK-STAT信号通路来传导信号,这包括白介素2?7(IL-2?7)、GM-CSF(粒细胞/巨噬细胞集落刺激因子)、GH(生长激素)、EGF (表皮生长因子)、PDGF (血小板衍生因子)以及IFN(干扰素)等等。
这些细胞因子和生长因子在细胞膜上有相应的受体。
这些受体的共同特点是受体本身不具有激酶活性,但胞内段具有酪氨酸激酶JAK的结合位点。
受体与配体结合后,通过与之相结合的JAK的活化,来磷酸化各种靶蛋白的酪氨酸残基以实现信号从胞外到胞内的转递。
(2) 酪氨酸激酶JAK(Janus kinase)很多酪氨酸激酶都是细胞膜受体,它们统称为酪氨酸激酶受体(receptor tyrosine kinase, RTK),而JAK却是一类非跨膜型的酪氨酸激酶。
JAK是英文Janus kinase的缩写,Janus在罗马神话中是掌管开始和终结的两面神。
之所以称为两面神激酶,是因为JAK既能磷酸化与其相结合的细胞因子受体,又能磷酸化多个含特定SH2结构域的信号分子。
JAK蛋白家族共包括4个成员:JAK1、JAK2、JAK3以及Tyk2,它们在结构上有7个JAK同源结构域(JAK homology domain, JH),其中JH1结构域为激酶区、JH2结构域是“假”激酶区、JH6和JH7是受体结合区域。
(3) 转录因子STAT(signal transducer and activator of transcription)STAT被称为“信号转导子和转录激活子”。
顾名思义,STAT在信号转导和转录激活上发挥了关键性的作用。
目前已发现STAT家族的六个成员,即STAT1-STAT6。
STAT蛋白在结构上可分为以下几个功能区段:N-端保守序列、DNA结合区、SH3结构域、SH2结构域及C-端的转录激活区。
其中,序列上最保守和功能上最重要的区段是SH2结构域,它具有与酪氨酸激酶Src的SH2结构域完全相同的核心序列“GTFLLRFSS”。
2) JAK-STAT信号通路与其它信号通路相比,JAK-STAT信号通路的传递过程相对简单。
信号传递过程如下:细胞因子与相应的受体结合后引起受体分子的二聚化,这使得与受体偶联的JAK激酶相互接近并通过交互的酪氨酸磷酸化作用而活化。
JAK激活后催化受体上的酪氨酸残基发生磷酸化修饰,继而这些磷酸化的酪氨酸位点与周围的氨基酸序列形成“停泊位点”(docking site),同时含有SH2结构域的STAT蛋白被招募到这个“停泊位点”。
最后,激酶JAK催化结合在受体上的STAT蛋白发生磷酸化修饰,活化的STAT蛋白以二聚体的形式进入细胞核内与靶基因结合,调控基因的转录。
值得一提的是,一种JAK激酶可以参与多种细胞因子的信号转导过程,一种细胞因子的信号通路也可以激活多个JAK激酶,但细胞因子对激活的STAT分子却具有一定的选择性。
例如IL-4激活STAT6,而IL-12却特异性激活STAT4。
2 p53信号1) p53基因的发现p53基因是迄今发现与肿瘤相关性最高的基因。
1979年,Lane和Crawford在感染了SV40的小鼠细胞内分离获得一个与SV40大T抗原相互作用的蛋白,因其分子量为53 kDa,故而取名为p53(人的基因称为TP53)[3]。
起初,p53被误认为是癌基因,直到上个世纪90年代,人们才认识到引起肿瘤形成或细胞癌变的p53蛋白是p53基因的突变产物。
野生型p53基因是一种重要的抑癌基因,它是细胞生长周期中的负调节因子,在细胞周期调控、DNA损伤修复、细胞分化、凋亡和衰老等许多过程中发挥了重要的生物学功能,因而被誉为“细胞卫士”。
随着研究的深入,人、猴、鸡、大鼠、非洲爪蟾和斑马鱼等多种模式动物的p53基因也相继被克隆。
其中,人类TP53基因定位于染色体17P13.1,小鼠p53基因被定位在11号染色体上,并在14号染色体上发现无功能的假基因。
在这些进化程度迥异的动物中,它们的p53基因结构却异常保守,基因全长16-20kb,都由11个外显子和10个内含子组成。
其中第1个外显子不编码结构域,外显子2、4、5、7、8则分别编码5个进化上高度保守的结构域,转录形成约2.5 kb的mRNA。
之后,在基因同源性的基础上又陆续发现了p53家族的其它成员,分别是p73和p63,它们也因各自的分子量而得名,具有和p53相似的结构和功能。
2) p53信号通路p53基因受多种信号因子的调控。
例如:当细胞中的DNA损伤或细胞增殖异常时,p53基因被激活,导致细胞周期停滞并启动DNA修复机制,使损伤的DNA得以修复。
然而,当DNA损伤过度而无法被修复时,作为转录因子的p53还可进一步激活下游促凋亡基因的转录,诱导细胞凋亡并杀死有DNA损伤的细胞。
不然,这些DNA 损伤的细胞就可能逐渐脱离正常的调控,有可能最终形成肿瘤。
虽然正常状态下p53的mRNA水平很高,而且有大量蛋白质合成,但p53蛋白容易降解,所以正常细胞内p53蛋白水平很低。
蛋白的泛素化(ubiquitination)修饰是细胞内蛋白代谢过程中的最普通的降解方式,p53蛋白的降解也是通过泛素化来实现的。
MDM2是一种特异性针对p53的泛素化E3连接酶,它可直接与p53蛋白结合来促进p53蛋白的泛素化降解,并在细胞内p53蛋白动态平衡中发挥关键的作用。
MDM2本身也可被p53蛋白激活,因此MDM2是p53通路中重要的负反馈调节因子(negative feedback regulator)。
3) p53与肿瘤p53基因敲除小鼠虽然可以产生后代,但其生长发育过程中会出现高频率的自发性肿瘤,这提示p53蛋白与肿瘤之间存在密切的关系。
事实上,目前TP53基因是与人类肿瘤的相关性最高的基因,与50%以上的人类恶性肿瘤有关,而且现正已在超过51种人类肿瘤病例中发现TP53基因的异常表达和功能失活。
TP53基因突变是其功能失活的主要原因,至今已发现400多种TP53基因突变类型,其中147种与胃肠道肿瘤有关,而最常见的突变方式是点突变。
通过分析大量肿瘤病例中的TP53突变位点,证实肿瘤中95.1%的p53点突变位点发生在高度保守的DNA结合区,尤以第175、245、248、249、273和282位点的突变率最高。
此外,某些点突变改变了p53的空间构象,影响了p53蛋白与MDM2和p300等蛋白的相互作用。
另一些点突变发生在p53的核定位信号区,使p53无法进入细胞核发挥转录激活的功能。
不同肿瘤的TP53基因突变位点并不一致,例如:结肠癌中G:C→A:T转换占到79%;在乳腺癌中,G→T颠换占到1/4,而这种突变在结肠癌十分少见;淋巴瘤和白血病的TP53基因突变方式与结肠癌相似;在肺癌中G:C→T:A突变最普遍,而食道癌中发生G→T颠换的频率很高。
目前看来,在肿瘤形成的复杂网络和调控体系中,p53是最主要的因素。
有人认为p53是很好的肿瘤诊断标志物,可以作为癌症早期诊断的重要指标。
认识到p53基因的重要作用后,全世界数以千计的分子生物学家正在抛开原来的课题转而研究p53,希望以此作为攻克癌症的突破口。
科学家相信,利用p53基因发现并治疗癌症的前景非常广阔。
除了基因治疗,研究人员正在筛选可以影响p53基因上下游调控的小分子化合物。
罗氏制药公司开发的一种名为nutlins的小分子化合物,能够干扰p53和MDM2之间的调控关系,有望成为一种有效的抗癌药物。
3 NF-κB信号1975年,E. A. Carswell和L. J. Old等人发现已接种卡介苗的小鼠注射脂多糖后,小鼠血清中产生了一种可引起动物肿瘤组织出血坏死的物质,该物质对体外培养的多种肿瘤细胞株都具有细胞杀伤作用,于是他们将这种物质命名为肿瘤坏死因子(tumour necrosis factor, TNF)。
TNF是迄今发现的抗肿瘤效果最强的细胞因子。
1984年起,欧美国家就开始把TNF的基因工程产品应用到癌症临床治疗中,并一度取得轰动的成果,然而最终由于毒副作用严重而被迫终止。
九十年代末以来,随着基础研究的深入和基因工程技术的发展,科学家研制出一些高效、低毒的TNF 变构体,从而重新确立了TNF在抗肿瘤中的重要地位,掀开了TNF在肿瘤研究和治疗中的新篇章。
1) TNF简介TNF是一种糖蛋白,它以两种形式存在:TNF-a和TNF-b。
TNF-a由单核细胞和巨噬细胞产生,它可引起肿瘤组织出血坏死,而脂多糖(Lipopolysaccharides, LPS)是较强的刺激剂。
TNF-b是一种淋巴因子,又称淋巴毒素(lymphotoxin, LT)。
抗原或丝裂原均可刺激T淋巴细胞分泌TNF-b,具有肿瘤杀伤及免疫调节功能。
人的TNF-a基因长2.76 kb,由4个外显子和3个内含子组成,定位在第六号染色体上。
人TNF-a前体由233个氨基酸组成,含有76个氨基酸残基的信号肽,切除信号肽后形成157个氨基酸的成熟型非糖基化的TNF-a。
通过基因工程方法改造后的TNF-a具有更好的生物学活性和抗肿瘤效果。
2) TNF与NF-kB信号通路TNF-a与TNF-b分子结构相似,所发挥的生物学效应相近。
胞外因子TNF-α以三聚体形式发挥信号转导功能,与TNF受体(TNF receptor, TNFR)结合引起受体多聚化,这种多聚化使得TNF受体与细胞质中TRADD分子发生相互作用。
TRADD招募相应蛋白后介导两条转导通路:一条是通过TRAF2和RIP分子诱导NF-κB的活化,参与抗凋亡;另一条是通过FADD分子导致细胞凋亡。
TNFR只有在蛋白合成受阻的情况下才会诱导凋亡,下面我们将着重介绍由TNF激活的NF-kB信号通路。
NF-kB(nuclear factor-kappa B)是1986年从B淋巴细胞的细胞核抽提物中找到的转录因子,它能与免疫球蛋白kappa轻链基因的增强子B序列GGGACTTTCC特异性结合,促进κ轻链基因表达,故而得名。
它是真核细胞转录因子Rel家族成员之一,广泛存在于各种哺乳动物细胞中。
迄今为止,在哺乳动物细胞内共发现5种NF-kB/Rel家族成员,它们分别是RelA(即p65)、RelB、C-Rel、p50/NF-kB1(即p50/RelA)和p52/NF-kB2。