10分钟区分电解质与非电解质 强弱电解质
- 格式:doc
- 大小:20.00 KB
- 文档页数:2

电解质与非电解质的区分与应用电解质和非电解质是化学中的两个重要概念。
电解质指能够在溶液中自由移动,产生电导的物质;而非电解质则不具备这样的特性。
本文将详细介绍电解质和非电解质的区分,以及在实际应用中的具体运用。
一、电解质与非电解质的区分在化学中,电解质与非电解质可以通过它们在溶液中的电离情况来进行区分。
1. 电解质电解质是指在溶液中能够完全或者部分电离,形成离子的物质。
电解质能够导电,并且对电流有明显的影响。
电解质又可分为强电解质和弱电解质两种。
强电解质指在溶液中完全电离的物质,如盐酸(HCl)、硫酸(H2SO4)等。
它们可以迅速产生大量的离子,从而提高溶液的电导率。
弱电解质在溶液中只能部分电离,生成较少的离子,如乙酸(CH3COOH)等。
弱电解质的电离度较低,因此对电流的影响相对较小。
2. 非电解质非电解质是指在溶液中不电离,不生成离子的物质。
它们不具备导电性,并且对电流没有明显的影响。
非电解质通常以分子形式存在,如葡萄糖(C6H12O6)、甲醇(CH3OH)等。
二、电解质与非电解质的应用电解质和非电解质在生活和科学研究中有着广泛的应用。
下面将分别介绍它们在不同领域的具体应用。
1. 电解质的应用电解质在电池、电解槽以及电解过程中起着重要角色。
举例来说,铅蓄电池中的硫酸就是一种电解质,它能够促使电池正负极的反应进行,并产生电能。
此外,电解质也广泛应用于金属提取、电镀、电泳等过程中。
此外,在生物体内,电解质也起着重要的调节作用。
身体内的生理盐水、细胞内外的离子浓度差异等都与电解质有关。
电解质的不平衡可能导致电解质紊乱,如低钾血症、高钠血症等疾病。
2. 非电解质的应用非电解质在生活中有广泛的运用,尤其是在化妆品、药品、食品等行业中。
许多药物和化妆品的成分大多属于非电解质,如维生素C、酒精等。
非电解质的存在使得这些物质能够更好地渗透皮肤,发挥作用。
此外,非电解质也常常被用作溶剂和稀释剂。
举例来说,酒精常被用作清洁剂和消毒剂,苯酚则是一种常用的溶剂。

解读电解质与非电解质强电解质与弱电解质河北省宣化县第一中学栾春武电解质与非电解质、强电解质与弱电解质都就是高中化学中十分重要得概念,正确理解非常重要,因此必须准确把握其内涵与外延,为了让同学们更好地、更准确理解,归纳如下:电解质:在水溶液里或熔融状态下能够导电得化合物,如酸、碱、盐等、非电解质:在水溶液里或熔融状态下都不够导电得化合物,如非金属氧化物、酒精、蔗糖等。
从树状分类这个角度上可以把化合物分为电解质与非电解质两类。
电解质可分为强电解质与弱电解质两类。
一、电解质与非电解质(1)金属能导电,但它们不就是化合物,因此金属即不就是电解质,也不就是非电解质。
(2)SO2、NH3溶于水,能导电,导电离子就是H2SO3、NH3·H2O电离出来得,故SO2、NH3不就是电解质。
HCl、H2SO4等溶于水,能导电,导电离子就是自身电离出来得,故它们就是电解质、酸、碱、盐就是电解质,非金属氧化物都不就是电解质。
(3)活泼金属氧化物,如Na2O、Al2O3等,在熔融状态下能导电,就是因为它们自身能电离出离子,Al2O3(熔) 2 Al3+ + 3O2-,就是电解质、(4)难容物(如CaCO3等)得水溶液导电能力很弱,但熔融状态能导电,就是电解质、(5)酒精、蔗糖等大多数有机物就是非电解质、(6)电解质不一定导电、强碱与盐等离子化合物在固态时,阴、阳离子不能自由移动,所以不能导电,但熔融状态下或溶于水时能够导电。
酸在固态或液态(熔融状态)时只有分子,没有自由移动得离子,因而也不导电,在水溶液里受水分子得作用,电离产生自由移动得离子,而能够导电。
(7)不导电得物质不一定就是非电解质,能导电得物质不一定就是电解质。
电解质、非电解质均指化合物、O2不导电,铁、铝能导电,但它们既不就是电解质,也不就是非电解质。
(8)电解质溶液得导电能力与溶液中离子浓度及离子所带电荷多少有关,离子浓度越大,离子所带电荷越多,导电能力越强。

电解质与非电解质的区别与特性在化学中,电解质和非电解质是两个重要的概念。
它们在物质的性质和行为上存在着明显的差异。
本文将探讨电解质和非电解质的区别与特性。
一、电解质的定义和特性电解质是指在溶液或熔融状态下能够导电的物质。
根据电解质的离解程度,可以将其分为强电解质和弱电解质。
1. 强电解质:强电解质在溶液中完全离解,生成大量的离子。
这些离子能够自由运动,从而导致溶液具有良好的电导性。
常见的强电解质包括盐类和强酸强碱。
2. 弱电解质:弱电解质在溶液中只部分离解,生成少量的离子。
由于离子浓度较低,溶液的电导性较弱。
典型的弱电解质有醋酸、乙醇等。
电解质的溶液通常具有一些特殊的性质。
首先,电解质溶液能够导电。
这是因为离解的离子能够在溶液中传导电流。
其次,电解质溶液具有较高的溶解度。
由于离子与溶剂分子之间的相互作用力较强,电解质能够更好地溶解于溶剂中。
此外,电解质溶液的物理性质如密度、折射率等也会受到离子的影响。
二、非电解质的定义和特性非电解质是指在溶液或熔融状态下不能导电的物质。
非电解质分子在溶液中不会离解,因此溶液中没有自由移动的离子。
与电解质不同,非电解质的溶液通常不具有导电性。
这是因为非电解质分子在溶液中不会分解成离子,因此无法传导电流。
此外,非电解质的溶解度通常较低,因为溶质分子与溶剂分子之间的相互作用力较弱。
非电解质的溶液在物理性质上与纯溶剂相似。
溶液的密度、折射率等物理性质通常与纯溶剂相近。
此外,非电解质的溶液通常不会改变溶质分子的化学性质。
三、电解质与非电解质的区别电解质和非电解质之间存在着明显的区别。
首先,电解质能够导电,而非电解质不能导电。
这是由于电解质能够产生离子,而非电解质不能产生离子。
其次,电解质的溶液通常具有较高的溶解度,而非电解质的溶解度较低。
这是因为电解质的离子与溶剂分子之间的相互作用力较强,有利于溶解。
而非电解质的分子之间的相互作用力较弱,溶解度较低。
另外,电解质的溶液通常具有一些特殊的性质,如导电性、电解质浓度与电导率之间的关系等。
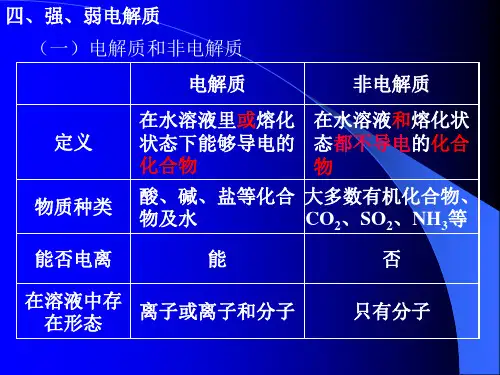

考点7 强、弱电解质的判断【考点定位】本考点考查强、弱电解质的判断,提升对电解质概念及电解质电离理论的理解,涉及电解质与非电解质、强弱电解质的判断及实验证明。
【精确解读】1.电解质和非电解质:非电解质:在熔融状态或水溶液中都不能导电的化合物.电解质:溶于水溶液中或在熔融状态下能够导电(自身电离成阳离子与阴离子)的化合物.可分为强电解质和弱电解质.电解质不一定能导电,而只有在溶于水或熔融状态时电离出自由移动的离子后才能导电.离子化合物在水溶液中或熔化状态下能导电;某些共价化合物也能在水溶液中导电,但也存在固体电解质,其导电性来源于晶格中离子的迁移2.强电解质和弱电解质:强电解质是在水溶液中或熔融状态中几乎完全发生电离的电解质,弱电解质是在水溶液中或熔融状态下不完全发生电离的电解质.强弱电解质导电的性质与物质的溶解度无关.强电解质一般有:强酸强碱,活泼金属氧化物和大多数盐,如:碳酸钙、硫酸铜.也有少部分盐不是电解质;弱电解质(溶解的部分在水中只能部分电离的化合物,弱电解质是一些具有极性键的共价化合物)一般有:弱酸、弱碱,如;醋酸、一水合氨(NH3•H2O),以及少数盐,如:醋酸铅、氯化汞.另外,水是极弱电解质。
3.弱电解质的判断方法(以盐酸和醋酸为例):(1)通过测定同浓度、同体积的溶液的导电性强弱来鉴别实验:等体积、浓度均为0。
5mol•L—1的盐酸和CH3COOH溶液的导电性实验表明,盐酸的导电能力比CH3COOH溶液的导电能力大得多.因为溶液导电能力的强弱是由溶液里自由移动离子的浓度的大小决定的.规律1:同物质的量浓度的酸溶液,酸越弱,其溶液的导电能力越弱;(2)通过测定同浓度溶液的pH大小来鉴别实验:在常温下,用pH试纸的测定0.1mol•L-1的盐酸和CH3COOH溶液的pH,盐酸的pH为1,CH3COOH溶液的pH 约为3.这就表明盐酸是完全电离的强酸,CH3COOH是部分电离的弱酸;规律2:同物质的量浓度的酸溶液,酸性越弱,溶液的pH越大.若两种酸溶液的pH相同,酸越弱,溶液的浓度越大;(3)通过比较同浓度、同体积的溶液与同一种物质反应的速率快慢来鉴别实验:分别用3.25g锌与体积都为200mL、浓度都为1mol•L—1的盐酸和CH3COOH溶液反应,观察到锌与盐酸反应剧烈,产生H2的速率快,锌很快反应完;锌与CH3COOH溶液反应慢,产生H2的速率缓慢,锌在较长一段时间内才消耗完.这表明盐酸是强酸,CH3COOH是弱酸.规律3:等物质的量浓度的酸,酸越弱,其c (H+)越小,反应速率越慢(4)通过测定同浓度的酸所对应的钠盐溶液的pH大小来鉴别实验:在常温下,用pH试纸测定0。


电解质与非电解质的区别与实验验证电解质和非电解质是化学中常用的两个概念。
了解它们的区别并通过实验进行验证,可以更好地理解化学反应和溶液的性质。
本文将详细介绍电解质和非电解质的概念、区别以及一种简单的实验验证方法。
一、电解质的概念和特点电解质是指在水或其他溶液中能够产生离子的化合物。
通常,电解质可以分为强电解质和弱电解质两类。
1.1 强电解质强电解质在溶液中能完全解离为离子,形成高度电离的溶液。
这些离子能够自由移动并导电。
典型的强电解质包括盐类(如NaCl)、酸和碱。
1.2 弱电解质相比之下,弱电解质在溶液中只有部分解离,形成低度电离的溶液。
这些离子的浓度相对较低,导电能力较弱。
典型的弱电解质有某些酸和碱,如醋酸和氨水。
二、非电解质的概念和特点非电解质是指在溶液中不产生离子的化合物。
它们通常以分子形式存在于溶液中,不具备导电性。
常见的非电解质包括葡萄糖、乙醇和甘油等。
三、电解质与非电解质的区别电解质和非电解质之间存在以下几个主要区别:3.1 解离程度电解质在溶液中的解离程度较高,能够完全或部分解离成离子。
而非电解质则以分子形式存在,不发生解离。
3.2 导电性由于电解质在溶液中能够形成离子,所以能够导电。
与此不同,非电解质无法在溶液中产生离子,因此不具备导电性。
3.3 反应性电解质由于产生离子,具备一定的化学反应性。
它们能够与其他物质发生化学反应,并产生明显的物理性质变化。
相比之下,非电解质的反应活性较低。
四、电解质与非电解质的实验验证为了验证物质是否为电解质或非电解质,我们可以通过导电性实验来进行判断。
以下是一种简单的实验方法:实验材料:- 铜电极- 碳电极- 电池- 目标物质样品- 导线- 夹子实验步骤:1.将铜电极和碳电极分别连接到电池的正负极。
2.将目标物质样品溶解在适量的水中,搅拌均匀使其充分溶解。
3.将导线分别连接到样品溶液和电极上。
4.将两个电极分别浸入样品溶液中,并观察电路中的流动情况。


电解质和非电解质的判断方法
电解质和非电解质的判断方法
电解质和非电解质是化学中一个重要的概念,电解质是指在水中可被水分解电离的化合物,而非电解质是指在水中不能被水分解电离的化合物。
一般来说,电解质的判断方法有以下几种:
1. 根据化学式来判断。
一般来说,常见的电解质有硫酸根、氢氧化物离子、氯化物离子等。
如果化学式中有这些离子,则可以判定为电解质;
2. 通过电离现象来判断。
电解质在水中可以被水分解电离,产生离子,可通过电离现象来判断某种物质是否为电解质,如果物质可被电离,则可以判定为电解质;
3. 根据溶解度来判断,电解质的溶解度一般都比较大,非电解质的溶解度一般都较小;
4. 根据离子的交换反应来判断,电解质的溶质可以交换离子,而非电解质的溶质则不能交换离子。
此外,还可以通过测定溶液的电导率来判断一种物质是否为电解质。
电解质的溶液的电导率一般会比较大,而非电解质的溶液的电导率一般会比较小。


电解质和非电解质电解质和非电解质是化学中常用的两个概念。
它们之间有着明显的区别,对于理解溶液的性质和物质的导电性具有重要作用。
本文将介绍电解质和非电解质的定义、特点和常见的应用。
一、电解质的定义和特点电解质是在溶液或熔融状态下能够导电的化合物。
它们在溶解或熔融后会分解成带电离子,使溶液能够导电。
电解质可分为强电解质和弱电解质。
1. 强电解质强电解质是指在溶解或熔融时完全离解,生成大量的离子。
它们具有很高的电导率,能够有效地导电。
常见的强电解质有盐酸、硫酸、氢氧化钠等。
2. 弱电解质弱电解质是指在溶解或熔融时只部分离解,生成少量的离子。
相对于强电解质,它们的电导率较低。
常见的弱电解质有醋酸、甲酸等。
二、非电解质的定义和特点非电解质是指在溶解或熔融时不会离解成离子,不能导电的物质。
非电解质通常是由分子组成的,溶解时分子间的作用力较强,不易分解。
常见的非电解质有水、乙醇等。
三、电解质和非电解质的应用1. 电解质的应用电解质在生活和工业中有着广泛的应用。
例如,电解质溶液可以用于电池中,通过离子的移动实现电能的转化;电解质还可用于电刷和导线涂料中,用于保护金属表面;此外,电解质在化学分析和实验中也有重要的作用。
2. 非电解质的应用非电解质在生活和科学研究中也有各种应用。
例如,非电解质水在饮用和烹饪中是必不可少的;非电解质溶液常用于实验室中,用于储存和溶解不耐水的物质;此外,非电解质还可以用于某些合成反应的反应介质。
结论电解质和非电解质是化学中重要的概念,对于理解溶液的性质以及物质的导电性具有重要作用。
电解质在溶解或熔融后能够完全或部分离解成离子,从而导致溶液具有导电性;非电解质则不会离解成离子,不能导电。
两者在生活和实验中都有广泛的应用,发挥着不同的作用。
对于化学学习者来说,理解电解质和非电解质的特点和应用是非常重要的。
电解质是什么和⾮电解质有哪些区别
电解质是溶于⽔溶液中或在熔融状态下就能够导电的化合物。
根据其电离程度可分为强电解质和弱电解质,⼏乎全部电离的是强电解质,只有少部分电离的是弱电解质。
电解质是什么
电解质都是以离⼦键或极性共价键结合的物质。
化合物在溶解于⽔中或受热状态下能够解离成⾃由移动的离⼦。
离⼦化合物在⽔溶液中或熔化状态下能导电;某些共价化合物也能在⽔溶液中导电,但也存在固体电解质,其导电性来源于晶格中离⼦的迁移。
强电解质是在⽔溶液中或熔融状态中⼏乎完全发⽣电离的电解质,完全电离,不存在电离平衡。
弱电解质是在⽔溶液中或熔融状态下不完全发⽣电离的电解质。
强弱电解质导电的性质与物质的溶解度⽆关。
电解质和⾮电解质的区别
电解质是在⽔溶液或熔融状态下可以导电的化合物;⾮电解质是在⽔溶液和熔融状态下都不能导电的化合物。
单质、混合物不管在⽔溶液中或熔融状态下是否能够导电,都不是电解质或⾮电解质。
如所有的⾦属既不是电解质,也不是⾮电解质。
因它们并不是化合物,不符合电解质的定义。
1、是否能电离(本质区别):电解质是在⼀定条件下可以电离的化合物,⽽⾮电解质不能电离。
2、常见物质类别:电解质⼀般为酸、碱、盐、典型的⾦属氧化物和某些⾮⾦属氢化物。
⾮电解质通常为⾮⾦属氧化物、某些⾮⾦属氢化物和绝⼤多数有机物。
3、化合物类别:电解质为离⼦化合物和部分共价化合物,⾮电解质全部为共价化合物。
看那么多概念,还是晕,最好的方法,死记硬背。
嘿嘿大体的思路是:首先列出电解质常见种类(包括强和弱电解质);然后是非电解质的常见种类;最后是使劲背。
一、强电解质①强酸,(常见的是六大强酸,你背会了吧?)HClO4、H2SO4、HI、HBr、HCl、HNO3。
②强碱,(还用想吗?)四大强碱K、Na、Ba、Ca (即氢氧化钠、氢氧化钾、氢氧化钙、氢氧化钡)③绝大多数盐:高中见到的盐全部是强电解质。
注:在高中阶段,可以认为所有的酸碱盐都是电解质,因为少量铅化物在大学中会接触到,并不是电解质。
如果出考题说“酸碱盐都是电解质”你一定要认为是对的。
二、弱电解质①弱酸:碳酸H2CO3、亚硫酸H2SO3、醋酸CH3COOH;氢硫酸H2S、氢氟酸HF、硅酸H2SiO3。
②弱碱:首先是一水合氨(NH3·H2O)其次是除四大强碱(K、Na、Ba、Ca)所有的氢氧化金属 R(OH)如、Al(OH)3、Cu(OH)2、Fe(OH)2、Fe(OH)3、Zn(OH)2、AgOH等。
③ H2O 水也是弱电解质。
三、非电解质①非金属氧化物:一氧碳CO、二氧化碳CO2、一氧化氮NO、二氧化氮NO2、二氧化硫SO2、三氧化硫SO3...②大多数有机物:甲烷CH4、乙醇、蔗糖(有机酸和有机盐除外,因为所有的酸碱盐都是电解质)③非金属化合物:氨气 NH3...例题:以下物质属于非电解质的是()属于电解质的是()。
①NaCl晶体②干冰③液态的醋酸④铜⑤BaSO4固体⑥蔗糖⑦酒精⑧熔融的KNO3 ⑨浓HNO3答案:非电解质是:2干冰、4铜、6蔗糖、7酒精、9浓硝酸电解质是:1NaCl晶体、3液态的醋酸、5BaSO4固体、8熔融的KNO3解析:1、NaCl晶体生成钠离子和氯离子。
2、干冰溶于水中时与水反应,生成碳酸,但他本身不是电解质,而是他的生成物为电解质。
3、液态的醋酸为氢离子和醋酸根离子,而不是指醋酸与水的混合物,只是状态为液态。
高考化学基础知识点——电解质、非电解质,强弱电解质的
比较
3.强弱电解质通过实验进行判断的方法(以HAc为例):
(1)溶液导电性对比实验:相同条件下,HAc溶液的导电性明显弱于强酸(盐酸、硝酸)
(2)测0.01mol/LHAc溶液的pH>2
(3)测NaAc溶液的pH值:常温下,PH>7
(4)测pH= a的HAc稀释100倍后所得溶液pH<a +2
(5)将物质的量浓度相同的HAc溶液和NaOH溶液等体积混合后溶液呈碱性(6)中和10mLpH=1的HAc溶液消耗pH=13的NaOH溶液的体积大于10mL (7)将pH=1的HAc溶液与pH=13的NaOH溶液等体积混合后溶液呈酸性
(8)比较物质的量浓度相同的HAc溶液与盐酸,分别与同样的锌粒反应产生气体的速率,后者快。
特别提醒:
1.SO2、NH3、CO2的水溶液虽然能导电,但它们仍属于非电解质
2.电解质强弱的判断,关键是看电解质在水溶液中是否完全电离。
电解质电离程度与溶解度无直接关系,溶解度大的不一定是强电解质(如醋酸),溶解度小的不一定是弱电解质(如硫酸钡)。
3.电解质溶液导电性取决于溶液中自由移动离子浓度和离子所带电荷数的多少。
一般来说,相同浓度的强电解质的导电性明显强于弱电解质。
弱酸(碱)与弱碱(酸)反应生成了强电解质,溶液的导电性明显增强。
4.电解质的强弱与溶液的导电性没有直接的关系。
如难溶物BaCO3,它溶于水的部分能完全电离,故属于强电解质,但溶液的导电性几乎为零。
电解质与非电解质的区别与举例导言:电解质和非电解质是化学中常用的概念,用以区分物质在溶液中的电离性质。
本文将从理论与实例两个方面,详细介绍电解质与非电解质的区别和举例。
一、理论解析1. 电解质电解质是指在溶剂中能够电离成带电粒子(离子)的物质。
它可以通过电解质的导电性质进行检验,即在电解质溶液中能够导电。
电解质按照其能够完全电离成离子的程度分为强电解质和弱电解质。
2. 非电解质非电解质是指在溶剂中不能电离成离子的物质。
与电解质不同,非电解质溶液中无法形成自由移动的离子,因此它不具备导电性质。
二、区别与举例1. 区别(1)电离性质电解质在溶解时会发生电离,形成带电的离子。
而非电解质则不会发生电离,不产生离子。
(2)导电性质电解质能够在溶液中导电,因为其产生了自由移动的离子。
非电解质则不能导电,因为其分子无法形成离子。
(3)溶解度电解质的溶解度通常较高,因为其离子在溶液中可以迅速与溶剂分子进行反应和交换。
非电解质的溶解度较低,因为其分子在溶液中通常以非离子形式存在。
2. 举例(1)电解质- 强电解质:盐酸、硫酸、氢氧化钠等。
它们在水中能够完全离解成离子,形成高度电离的溶液。
- 弱电解质:乙酸、苯酚、甲酸等。
它们在水中只能部分离解,形成低度电离的溶液。
(2)非电解质- 有机物:醇类、脂类、糖类等。
这些物质在水中不会电离,因此不能导电。
- 无机物:甲烷、乙烷等。
这些单质或者多原子分子也属于非电解质。
结论:电解质与非电解质的区别在于其在溶液中的离子化和导电性质。
电解质能够电离形成离子,能够导电;非电解质则不发生电离,无法导电。
通过举例,我们可以更好地理解和区分这两种物质。
参考文献:1. 张某某. 电解质与非电解质. 化学前沿, 20XX, (X): X-X.2. 王某某, 李某某. 电解质与非电解质的区别与应用. 化学知识,20XX, (X): X-X.。
电解质与非电解质的性质与区别电解质和非电解质是物质分类的重要标准,它们在化学和生物学中具有不同的性质和应用。
本文将深入探讨电解质和非电解质的性质和区别。
一、电解质的性质与特点电解质是指在溶液或熔融状态下能够导电的物质。
根据电离程度的不同,电解质可以分为强电解质和弱电解质。
1. 强电解质:强电解质在水溶液中能够完全电离产生离子,并能有效导电。
强电解质的特点是溶液中离子浓度高,并且溶液能够充分导电。
典型的强电解质包括盐类和强酸、强碱。
例如,氯化钠在水中完全电离,产生钠离子Na+和氯离子Cl-,溶液可以很好地导电。
2. 弱电解质:弱电解质在溶液中只能部分电离,生成离子和未电离的分子。
弱电解质的特点是溶液中离子浓度较低,溶液电导性较弱。
弱电解质常见的代表有乙酸和氨水。
例如,乙酸在水中只部分电离,产生乙酸离子CH3COO-和氢离子H+,溶液的电导率相对较低。
二、非电解质的性质与特点非电解质是指在溶液或熔融状态下不能导电的物质。
非电解质一般由分子组成,并且不会电离生成离子。
非电解质的特点是不会在水溶液中产生游离离子,因此溶液中没有带电荷的粒子可以传导电流。
典型的非电解质有脂肪、糖类和醇类等有机物质。
例如,乙醇在水中溶解后不会电离,溶液不能导电。
三、电解质与非电解质的区别电解质和非电解质在性质上有明显的区别,主要体现在以下几个方面:1. 导电性区别:电解质在溶液或熔融状态下能够导电,而非电解质不能导电。
这是由于电解质能够电离生成离子,在溶液中电离的离子可以带电传导电流,而非电解质由于不发生电离,因此不能导电。
2. 分子构成区别:电解质在溶液中以离子形式存在,非电解质以分子形式存在。
电解质的化学键较强,能够在水溶解时产生离子,而非电解质的化学键较弱,不能产生离子。
3. 溶液电导性区别:电解质所生成的离子数量较多,溶液电导性较强;非电解质溶液中没有离子,电导性较弱。
4. 物质种类区别:电解质主要包含离子化合物,如酸、碱、盐等;非电解质主要是有机物质,如脂肪、糖类、醇类等。
看那么多概念,还是晕,最好的方法,死记硬背。
嘿嘿
大体的思路是:
首先列出电解质常见种类(包括强和弱电解质);
然后是非电解质的常见种类;
最后是使劲背。
一、强电解质
①强酸,(常见的是六大强酸,你背会了吧?)HClO4、H2SO4、HI、HBr、HCl、HNO3。
②强碱,(还用想吗?)四大强碱K、Na、Ba、Ca (即氢氧化钠、氢氧化钾、氢氧化钙、氢氧化钡)
③绝大多数盐:高中见到的盐全部是强电解质。
注:在高中阶段,可以认为所有的酸碱盐都是电解质,因为少量铅化物在大学中会接触到,并不是电解质。
如果出考题说“酸碱盐都是电解质”你一定要认为是对的。
二、弱电解质
①弱酸:
碳酸H2CO3、亚硫酸H2SO3、醋酸CH3COOH;
氢硫酸H2S、氢氟酸HF、硅酸H2SiO3。
②弱碱:
首先是一水合氨(NH3·H2O)
其次是除四大强碱(K、Na、Ba、Ca)所有的氢氧化金属 R(OH)
如、Al(OH)3、Cu(OH)2、Fe(OH)2、Fe(OH)3、Zn(OH)2、AgOH等。
③ H2O 水也是弱电解质。
三、非电解质
①非金属氧化物:一氧碳CO、二氧化碳CO2、一氧化氮NO、二氧化氮NO2、二氧化硫SO2、三氧化硫SO3...
②大多数有机物:
甲烷CH4、乙醇、蔗糖(有机酸和有机盐除外,因为所有的酸碱盐都是电解质)
③非金属化合物:氨气 NH3...
例题:
以下物质属于非电解质的是()属于电解质的是()。
①NaCl晶体②干冰③液态的醋酸④铜⑤BaSO4固体⑥蔗糖⑦酒精⑧熔融的KNO3 ⑨浓HNO3
答案:非电解质是:2干冰、4铜、6蔗糖、7酒精、9浓硝酸
电解质是:1NaCl晶体、3液态的醋酸、5BaSO4固体、8熔融的KNO3
解析:1、NaCl晶体生成钠离子和氯离子。
2、干冰溶于水中时与水反应,生成碳酸,但他本身不是电解质,而是他的生成物为电解质。
3、液态的醋酸为氢离子和醋酸根离子,而不是指醋酸与水的混合物,只是状态为液态。
4、铜,电解质必须是化合物,同为单质。
5、不解释。
6、蔗糖溶解在水中时以分子的形式存在。
7、原因与6同。
8、不解释。
9、浓硝酸为混合物,当然不可能为电解质。
补充下什么叫正盐,我再网上看到的。
化学中的盐分为正盐、酸式盐和碱式盐、复盐。
在酸跟碱完全中和生成的盐中,不会有酸中的氢离子,也不会有碱中的氢氧根离子,只有金属阳离子和酸根离子,呈中性的盐。
就是正盐。