鸡肝过氧化氢酶的提取、分离和纯化
- 格式:docx
- 大小:207.94 KB
- 文档页数:12

猪肝过氧化氢酶提取条件的研究
猪肝过氧化氢酶是一种重要的酶,它在细胞膜脂质的氧化降解过程中发挥着重
要作用。
因此,猪肝过氧化氢酶的提取和纯化是生物化学研究的关键。
最近,多种新的提取和纯化技术的研究将有助于发掘和应用猪肝过氧化氢酶。
一方面,猪肝过氧化氢酶的提取可以采用常用的体外抽提法。
例如,微波辐射
法可以抽取脂肪同时保护蛋白质,而酸洗法则可以最大限度地抽取猪肝过氧化氢酶以进行进一步的分离与纯化。
另一方面,对猪肝过氧化氢酶的纯化可以采用分子筛、柱纯化或电泳等技术,
以实现高纯度的猪肝过氧化氢酶抽提和纯化。
例如,分子筛可以提取出含有猪肝过氧化氢酶的催化特异性材料,然后通过柱纯化或电泳分离得到纯度较高的物质。
另外,在猪肝过氧化氢酶的提取和纯化过程中,有必要控制参与反应的条件。
不仅要确保反应的稳定性,而且要控制反应温度,pH值,盐度等环境因素。
如果
这些因素不能正确控制,将会影响抽提和纯化的效果,而纯度和产率也会受到影响。
综上所述,猪肝过氧化氢酶的抽提和纯化过程是一个比较复杂的过程,必须合
理控制反应条件,并采用合适的提取和纯化技术,才能获得较高纯度和较高的产率。


实验目的:本实验旨在从新鲜动物肝脏中分离、提取并纯化某种酶,并通过一系列纯化步骤得到高纯度的酶蛋白,以进行后续的鉴定和分析。
实验材料:1. 新鲜动物肝脏2. 丙酮3. 三氯甲烷4. 氨水溶液5. 乙酸溶液6. 硫酸铵7. 磷酸盐缓冲液8. 阴、阳离子交换层析柱9. 凝胶层析柱10. 微孔滤膜11. 超滤装置12. 冻干机13. pH计14. 离心机15. 研磨器16. 过筛器17. 实验记录本实验步骤:1. 脱脂肝粉制备:- 将新鲜动物肝脏切成碎块,搅碎后充分匀浆。
- 向匀浆中加入丙酮,充分搅拌后离心,收集沉淀。
- 将沉淀干燥,研磨、过筛后收集细粉。
- 将肝粉颗粒加入三氯甲烷,充分搅拌后抽滤,重复两次,收集滤饼并干燥。
2. 酶粗品制备:- 将干燥的肝粉用氨水溶液恒温抽提两次,合并滤液。
- 将所得水溶液用乙酸溶液酸化,离心后收集上清液。
- 将上清液调pH至中性,用硫酸铵初次盐析,离心后收集上清。
- 再次用硫酸铵盐析,收集沉淀,得到酯酶粗品。
3. 精制:- 将粗品用磷酸盐缓冲液溶解,经过阴、阳离子交换层析柱纯化,接收主峰。
- 将接收的主峰浓缩,再经过凝胶层析柱分离,接收主产物峰。
4. 超滤、浓缩、冻干:- 将收集的溶液用微孔滤膜预过滤后,进行超滤和浓缩。
- 将浓缩后的溶液在冻干机中冻干,得到纯化的酶蛋白。
实验结果:通过上述实验步骤,成功从肝组织中提取并纯化了某种酶。
纯化后的酶蛋白经过鉴定,其纯度达到了预期目标。
实验分析:1. 脱脂肝粉的制备过程中,丙酮和三氯甲烷的使用有助于去除脂质杂质,提高酶的提取效率。
2. 酶粗品的制备过程中,氨水溶液的抽提和硫酸铵的盐析是提高酶蛋白纯度的重要步骤。
3. 精制过程中,阴、阳离子交换层析柱和凝胶层析柱的应用进一步提高了酶蛋白的纯度。
4. 超滤、浓缩和冻干等步骤有助于去除溶剂和低分子量杂质,提高酶蛋白的稳定性。
实验结论:本实验成功地从新鲜动物肝脏中分离、提取并纯化了某种酶,为后续的酶学研究和应用奠定了基础。


感谢那些把自己的ppt放到网上的学长学姐!!要不然这实验怎么做!!设计实验报告12级七年儿科实验名称从动物肝组织样品中分离提取纯化鉴定一种酶实验目的1.掌握从肝细胞中分离提取纯化鉴定某种酶的实验方法2.培养灵活选择并综合使用各种生物学实验方法的能力3.培养探索精神和团队合作意识实验原理(一)材料的选择因动物肝脏中的酶往往结合较多的脂质、核酸的物质,所以取饥饿24小时的动物肝脏为实验材料。
(二)细胞破碎细胞破碎可选用三种方法:机械破碎法,物理破碎法,化学破碎法。
本次使用机械破碎法。
机械破碎法:可选匀浆法。
使用匀浆法时应先将大块的组织或者细胞团用组织捣碎机或研磨器械捣碎分散。
加入蛋白酶抑制剂的目的是防止蛋白酶的水解作用。
常用的蛋白酶抑制剂有苯甲基磺酰氟(PMSF)、二异丙基氟磷酸;金属蛋白酶抑制剂有EDTA和EGTA(乙二醇四乙酸)一般微生物和植物的粗酶液中有大量的核酸污染。
除核酸的常用方法是沉淀法,沉淀剂的选择需要大量的试验来选定,已知的有1%~2%的链霉素硫酸盐、PEG、溶菌酶等。
由于该酶的位置未知。
故应用超速离心分离技术分离胞液中的酶体和微粒体,细胞核和线粒体。
对三种成分分开研究,使得提取物中杂志减少。
(三)超速离心分离技术悬浮液静止不动时,由于重力场作用,悬浮颗粒就要逐渐的沉降下来,颗粒越重,下沉越快,反之则上浮。
但是颗粒在重力场中的沉降速度并不只与重量有关,还与密度,大小,形状有关。
但当颗粒大小小于几微米时沉降速度很慢而扩散现象非常严重。
所以必须用高速离心的方法,产生出强大的离心场,就产生了超速离心分离技术。
医保内不同结果的比重,大小,形态不同,在同一离心场中沉降速度不同。
可根据这一原理将亚细胞组分分离。
(四)酶的提取常用方法:盐溶液提取、酸溶液提取、碱溶液提取和有机溶剂提取。
本实验中因缺乏酶的更多信息,故采用盐溶液提取法。
盐溶液提取法盐溶液提取:适用于大多数酶。
盐溶现象:大多数P酶在低浓度的盐存在的条件下,酶的溶解度随盐浓度的升高而增加。

鸡肝过氧化氢酶的提取、分离和纯化孙文刚云南民族大学化学与生物技术学院云南昆明摘要:新鲜鸡肝经匀浆、磷酸缓冲溶液抽提、硫酸铵分级沉淀、DEAE Sepharose离子交换层析、Sepharcy1 S -200凝胶过滤层析、得到鸡肝过氧化氢酶电泳纯制品。
回收率为18.23%,比活达4780.38U/mg,纯化倍数为66.15,最适温度为40℃,最适PH为7.0。
该酶在20~40℃,PH 5~8内稳定。
经凝胶过滤和SDS-PAGE测得该酶的全分子量为250KD,亚基分子量为62.5KD。
关键词:家鸡;肝脏;过氧化氢酶;分离纯化;性质Chicken liver Catalase of Extraction, Separation and PurificationWengang SunYunnan Minzu UniversityAbstract: A catalase was purified from Anas Chicken homogenation ,n-butanol disposal, ammo-nium sulfate precipitation, ion-exchange chromatography on DEAE-Sepharose Fast Flow column and gelfiltration chromatography on Sephacryl S-200.The purity of the purified catalase was confirmed by thepresence of a single band on SDS-PAGE.18.23% of the catalase activity was recovered. The specific activ-ity was 4 780.38 U/mg. The optimum pH and optimum temperature were 7.0 and 40℃ ,respectively. The catalase appeared to be stable at 20~40℃and pH 5~8,and it was 66.15-fold purified. Sephacryl S-200 chromatography and SDS-PAGE showed that the molecular weight of this catalase was 250 KD and itssubunit was about 62.5 KD.Key words: Anas Chicken; liver; catalase; purification; property引言过氧化氢酶(Catalase,EC1.11.1.6,简称CAT)是一类广泛存在于动物、植物和微生物体内的末端氧化酶,酶分子结构中含有铁卟啉环,1个酶蛋白分子中含有4个铁原子[1]。

一种嗜热嗜碱过氧化氢酶的分离纯化及鉴定摘要:试图从嗜热嗜碱的嗜热子囊菌中分离纯化过氧化氢酶,以得到具有嗜热嗜碱性质的过氧化氢酶。
根据研究表明,嗜热嗜碱的嗜热子囊菌中的过氧化氢酶该酶为双亚基结构,分子量约为1·9×105,亚基分子量约为9·5×104,。
并且嗜热嗜碱过氧化氢酶均在广泛的pH 范围内表现稳定,酶亚基分子量较大,而大分子亚基被发现有更好的温度、pH 稳定性, H2O2耐受性[19]。
现在通过对酶的盐析及透析除盐、DEAE-Sepharose 离子交换层析、Superdex-200 凝胶过滤层析等方法对其进行分离纯化,通过对其分子质量的测定、酶活力的测定,等对其进行鉴定。
关键词:过氧化氢酶 分离纯化 鉴定1 实验流程图2 实验步骤2.1 菌种培养从-20 ℃冰箱保藏的嗜热子囊菌菌种挑取一环接入盛有70 mL种子培养基中(糖度为6°P的天然麦芽汁,pH 7.5)的250 mL 摇瓶中,在37 ℃、200 r/min 培养12 h. 然后以6%接种量接种至装有80 mL 发酵培养基的500 mL 摇瓶中,在37 ℃、200r/min 培养30 h.2.2 酶的盐析及透析除盐取发酵液,过滤去除菌体,加硫酸铵至饱和度50%, 5℃下过夜,10000 r ·min-1离心15 min,除去沉淀(除去其他不溶性杂质),上清液继续加入硫酸铵至饱和度90%, 5℃下静置12 h,离心收集沉淀,用少量10 mmol ·L-1的Tris-HCl(pH 8·0)缓冲液溶解,蒸馏水透析48 h (除去硫酸铵等小分子离子杂质),透析后的酶液5℃下保存,得到嗜热嗜碱过氧化氢酶的粗提取物。
2.3 DEAE-Sepharose 离子交换层析DEAE-Sepharose 离子交换层析柱经 0.05mol/L 磷酸缓冲液(pH7.2)平衡后,初酶液上样5mL ,用0~1mol/L 的NaCl 溶液(用0.05mol/L ,pH7.2 的磷酸缓冲液配制)进行线性梯度洗脱,流速 30mL/h ,每管收集 5mL ;然后测定各管 CAT 活力和蛋白质含量,收集活性较高的各管酶液(得到嗜热嗜碱过氧化氢酶的细提取物),4℃蒸馏水透析脱盐过夜。



大肠杆菌中质粒的小量提取及核酸电泳纲要:采纳碱裂解法将大肠杆菌中的质粒DNA分子进行分离和纯化,将分离纯化后的质粒DNA分子进行琼脂糖凝胶电泳,并在紫外成像仪中察看DNA条带,以测定所获取的质粒DNA片段的分子量大小。
结果说明,成功从大肠杆菌中提拿出质粒DNA分子,其分子量大小约为2000bp。
重点词:质粒DNA分子;碱裂解法;分子量;电泳前言质粒存在于很多细菌以及酵母菌等生物中,是细胞染色体外能够自主复制的很小的环状DNA分子。
碱裂解法是一种应用最为宽泛的制备质粒DNA的方法,碱变性抽提质粒DNA是鉴于染色体DNA与质粒DNA的变性与复性的差别而抵达分离目的。
在碱性电泳缓冲液中带负电荷,所以在外加电场作用下会向正极迁徙。
将提取到的DNA分子提取液中参加核酸染色剂,经过琼脂糖凝胶电泳后,利用紫外灯照耀即可察看到所提取的DNA条带,第一泳道参加适合的Marker与之进行比对,即可较为正确地估测出所提拿出的质粒DNA分子量。
资料与方法实验资料含质粒Psd-T19的大肠杆菌试剂:细菌质粒小量提取试剂盒、琼脂糖,电泳缓冲液〔TAE〕,核酸电泳上样缓冲液〔6×〕,标准分子量的DNA等。
实验仪器微量移液器、试管、微波炉、离心计、电泳仪、凝胶成像系统、天平。
质粒的提取〔小量试剂盒提取〕第一取混匀的菌液于离心管中,台式离心计中12000r/m离心1min,弃上清液获取大肠杆菌菌体;(2)依照试剂盒提取的步骤提拿出大肠杆菌质粒DNA。
核酸电泳制备1%琼脂糖凝胶,并增添GoldViedI核酸染料;加样:在离心管中混淆DNA样品2-3ul和1ul上样缓冲液。
采纳梯度上样,上样量分别为2ul、4ul、6ul、8ul和5ulDNA分子量标志;电泳:120V,40min;察看:将电泳后的凝胶搁置于透射紫外光下进行察看,比较分子量标志判断DNA样品的分子量大小。
实验结果与剖析大肠杆菌在37℃恒温摇床中220r/min培育24h,离心采集菌液采集菌液,以后依照试剂盒的操作步骤进行质粒提取纯化,最后进行核酸电泳,电泳图如图1-1所示。
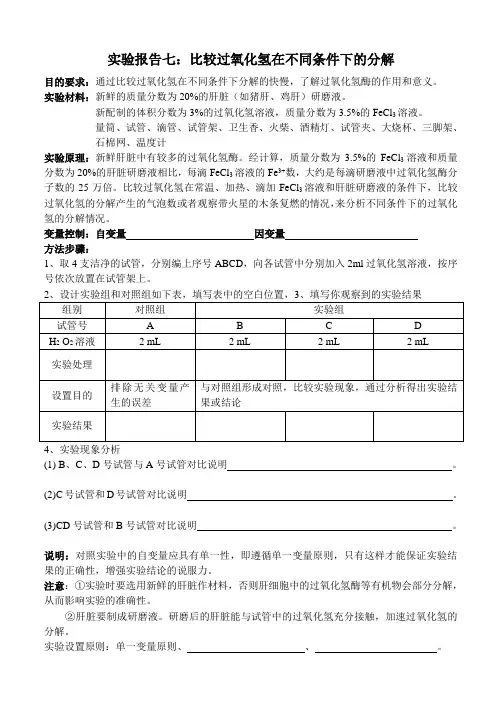
实验报告七:比较过氧化氢在不同条件下的分解
目的要求:通过比较过氧化氢在不同条件下分解的快慢,了解过氧化氢酶的作用和意义。
实验材料:新鲜的质量分数为20%的肝脏(如猪肝、鸡肝)研磨液。
新配制的体积分数为3%的过氧化氢溶液,质量分数为3.5%的FeCl3溶液。
量筒、试管、滴管、试管架、卫生香、火柴、酒精灯、试管夹、大烧杯、三脚架、
石棉网、温度计
实验原理:新鲜肝脏中有较多的过氧化氢酶。
经计算,质量分数为3.5%的FeCl3溶液和质量分数为20%的肝脏研磨液相比,每滴FeCl3溶液的Fe3+数,大约是每滴研磨液中过氧化氢酶分子数的25万倍。
比较过氧化氢在常温、加热、滴加FeCl3溶液和肝脏研磨液的条件下,比较过氧化氢的分解产生的气泡数或者观察带火星的木条复燃的情况,来分析不同条件下的过氧化氢的分解情况。
变量控制:自变量因变量
方法步骤:
1、取4支洁净的试管,分别编上序号ABCD,向各试管中分别加入2ml过氧化氢溶液,按序号依次放置在试管架上。
(1) B、C、D号试管与A号试管对比说明。
(2)C号试管和D号试管对比说明。
(3)CD号试管和B号试管对比说明。
说明:对照实验中的自变量应具有单一性,即遵循单一变量原则,只有这样才能保证实验结果的正确性,增强实验结论的说服力。
注意:①实验时要选用新鲜的肝脏作材料,否则肝细胞中的过氧化氢酶等有机物会部分分解,从而影响实验的准确性。
②肝脏要制成研磨液。
研磨后的肝脏能与试管中的过氧化氢充分接触,加速过氧化氢的分解。
实验设置原则:单一变量原则、、。
猪肝过氧化氢酶提取条件及应用研究研究过氧化氢酶是一种重要的酶类,在医药、制浆造纸、食品、环境等领域有着广泛的应用。
猪肝过氧化氢酶是一种高效的过氧化氢降解酶,具有较高的催化效率和稳定性。
因此,研究猪肝过氧化氢酶的提取条件及应用具有重要的理论和应用价值。
提取条件实验材料猪肝组织、磷酸盐缓冲液(pH 7.0)、甲醇、乙腈、丙酮、氮气、色谱柱实验过程1.猪肝切片,并在冰上磨成细粉2.加入10倍磷酸盐缓冲液,充分振荡,浸泡10分钟3.离心15分钟,取上清液4.将上清液慢慢加入氮气中,使其脱除氧气5.在氮气的保护下,加入甲醇、乙腈、丙酮等有机溶剂,使沉淀物稳定6.沉淀物加入色谱柱进行分离纯化结果分析通过实验,发现在磷酸盐缓冲液(pH 7.0)条件下,甲醇、乙腈、丙酮等有机溶剂可以有效地提取出猪肝过氧化氢酶,并通过色谱柱的分离纯化,可以得到较纯的过氧化氢酶。
应用研究抗菌性研究研究人员采用实验室常见的二氧化氯消毒方法,对不同浓度的猪肝过氧化氢酶溶液进行试验。
实验结果表明,猪肝过氧化氢酶具有一定的抑菌效果,当浓度为5mg/mL时,对大肠杆菌的抑菌率达到了50%以上。
应用于纤维素酶系统的增强猪肝过氧化氢酶可以通过氧化作用增强纤维素酶的催化效果,提高纤维素的降解效率。
实验结果表明,将0.2%的猪肝过氧化氢酶与0.5%纤维素酶混合使用,可以使纤维素的降解率提高25%以上。
应用于食品添加剂猪肝过氧化氢酶可以在食品加工过程中作为添加剂,去除食品中的过氧化物,具有良好的保鲜效果。
实验结果表明,在生鲜果蔬中添加适量的猪肝过氧化氢酶后,可以将其保鲜时间延长3-5天。
猪肝过氧化氢酶是一种重要的酶类,在医药、制浆造纸、食品、环境等领域有着广泛的应用。
通过实验可以发现,在磷酸盐缓冲液(pH 7.0)条件下,甲醇、乙腈、丙酮等有机溶剂可以有效地提取出猪肝过氧化氢酶,同时发现该酶具有一定的抑菌效果、可以增强纤维素酶的催化效果、可以在食品加工过程中作为添加剂,去除食品中的过氧化物,具有良好的保鲜效果。
鸡肝过氧化氢酶的提取、分离和纯化孙文刚云南民族大学化学与生物技术学院云南昆明摘要:新鲜鸡肝经匀浆、磷酸缓冲溶液抽提、硫酸铵分级沉淀、DEAE Sepharose离子交换层析、Sepharcy1 S -200凝胶过滤层析、得到鸡肝过氧化氢酶电泳纯制品。
回收率为18.23%,比活达4780.38U/mg,纯化倍数为66.15,最适温度为40℃,最适PH为7.0。
该酶在20~40℃,PH 5~8内稳定。
经凝胶过滤和SDS-PAGE测得该酶的全分子量为250KD,亚基分子量为62.5KD。
关键词:家鸡;肝脏;过氧化氢酶;分离纯化;性质Chicken liver Catalase of Extraction, Separation and PurificationWengang SunYunnan Minzu UniversityAbstract: A catalase was purified from Anas Chicken homogenation ,n-butanol disposal, ammo-nium sulfate precipitation, ion-exchange chromatography on DEAE-Sepharose Fast Flow column and gelfiltration chromatography on Sephacryl S-200.The purity of the purified catalase was confirmed by thepresence of a single band on SDS-PAGE.18.23% of the catalase activity was recovered. The specific activ-ity was 4 780.38 U/mg. The optimum pH and optimum temperature were 7.0 and 40℃ ,respectively. The catalase appeared to be stable at 20~40℃and pH 5~8,and it was 66.15-fold purified. Sephacryl S-200 chromatography and SDS-PAGE showed that the molecular weight of this catalase was 250 KD and itssubunit was about 62.5 KD.Key words: Anas Chicken; liver; catalase; purification; property引言过氧化氢酶(Catalase,EC1.11.1.6,简称CAT)是一类广泛存在于动物、植物和微生物体内的末端氧化酶,酶分子结构中含有铁卟啉环,1个酶蛋白分子中含有4个铁原子[1]。
过氧化氢酶是在生物演化过程中建立起来的生物防御系统的关键酶之一[2],催化细胞内过氧化氢的分解。
过氧化氢酶已成为农业及相关食品业、乳制品业、造纸业以及农业环保业中有价值的酶之一。
CAT主要以与细胞器,如线粒体、过氧化物酶体结合的形式存在,而在红细胞中则以可溶状态存在。
过氧化氢酶几乎普遍存在于所有能呼吸的生物体内,在哺乳动物的肝与红细胞中含量较高,国内外学者多从动物肝中提取[1,3-6],也有从血液、胎盘、贻贝、苹果以及微生物中提取的研究[7-13]。
但从鸡肝中分离纯化过氧化氢酶的研究未见报道。
为此,本文尝试从鸡肝中分离纯化过氧化氢酶并研究其相关的酶学特性。
1. 材料与方法1.1 实验材料家鸡肝脏取自健康活鸡,杀死后立即取肝脏于冰箱中冰冻保存备用[14]。
1.2 实验仪器紫外分光光度计、冷冻离心机、超声波破碎仪、可见分光光度计、离子交换柱、SDS-PAGE电泳装置、冰箱、酶标仪等。
1.3实验试剂Tris试剂、甘油、KCl、HCl、硫酸铵、牛血清蛋白、磷酸缓冲液、考马斯亮蓝G-250、95﹪乙醇、钼酸铵、过氧化氢、30%丙烯酰胺凝胶贮存液、SDS 聚丙烯酰胺等。
2.实验方法2.1 粗酶液的制备称取新鲜鸡肝100g,用自来水洗净,再用消毒双蒸水漂洗干净。
按1∶5(M∶V)的比例加入预冷的0.05mol/L的磷酸缓冲液(pH7.2),用高速组织捣碎机捣碎,置于4℃冰箱抽提2h;离心(6000r/min,4℃,30min),收集上清液;加入硫酸铵至40%饱和度,离心(6000r/min,4℃,30min)去沉淀,上清中再加硫酸铵至60%饱和度,离心收集沉淀;将沉淀重溶于0.05 mol/L的磷酸缓冲液(pH 7.2)中,4℃透析夜,然后按1∶1(V∶V)的比例向透析液中加入预冷的正丁醇进行脱脂,4℃静置过夜.然后6000r/min离心,弃去沉淀以及正丁醇层,重复2次,得粗酶液。
2.2 DEAE-Sepharose离子交换层析DEAE-Sepharose离子交换层析柱为通用安玛西亚公司生产的DEAE Sepharose Fast Flow 5mL预装柱,用磷酸缓冲液(0.05mol/L,pH7.2)平衡至少4倍柱体积(20mL),上样5mL。
用0~1mol/L NaCl溶液(含0.05 mol/L,pH7.2的磷酸缓冲液)进行梯度洗脱,流速30mL/h,每管收集5mL,紫外监测波长为280nm;测定各管过氧化氢酶活性和蛋白含量;收集活性较高的各管酶液,4℃透析过夜,冷冻干燥后进行凝胶过滤。
2.3 SephacrylS-200凝胶过滤柱层析SephacrylS-200凝胶柱按产品说明书要求处理,装柱(16mm×835mm)后,用磷酸缓冲液(0.05mol/L,pH7.2)冲洗一定体积,上样2mL。
用磷酸缓冲液(0.05mol/L,pH7.2)进行洗脱,流速18mL/h,每管收集3mL;测定每管过氧化氢酶活性和蛋白含量;收集活性较高的各管酶液,4℃透析、冷冻干燥,得到过氧化氢酶纯品。
2.4 过氧化氢酶活性测定以过氧化氢为底物,采用钼酸铵终止法[15]:取0.16 mol/L的过氧化氢溶液0.2mL,加入 1.29mL磷酸缓冲液(0.05mol/L,pH7.2)中,37℃温浴5min,再加入0.01mL过氧化氢酶液,立即混匀并计时1min,然后加入1.5mL 32.4mmol/L钼酸铵溶液终止反应,405nm测定其OD值;以先加钼酸铵,再加酶液的为对照.过氧化氢酶活性单位定义为:每分钟分解1μmol过氧化氢所需的酶量为一个酶活力单位。
2.5 蛋白质含量测定按Lowry法[16]和分光光度法[17]进行测定,以牛血清白蛋白为标准样品。
2.6 蛋白质分子量测定用凝胶过滤[18]和SDS-PAGE测量其全分子量和亚基分子量,SDS-PAGE的分离胶浓度为12%,电泳后用考马斯亮蓝R-250染色。
2.7 最适pH及pH稳定性37℃下,分别测定过氧化氢酶在不同pH(3~12)[19]缓冲液下的酶活性以及4℃放置48 h后的酶活性。
2.8 最适温度及热稳定性分别测定过氧化氢酶在不同温度(25~70℃)[20]下的酶活性,以及在上述不同温度下分别保温10,30,60min后酶的活力。
的测定2.9 反应初速度V在最适条件下,在1~2 min内,每隔20s测定一次过氧化氢酶活性,以时间为横坐标,以底物浓度的减少量为纵坐标作图,得一直线,其斜率即是酶促反应的[21]。
初速度V2.10 酶Km值及Vm的测定在最适条件下,以不同浓度的过氧化氢为底物,测定其酶活性,并按双倒数法(Lineweaver-Burk法)作图[22],求出Km以及Vmax,底物浓度范围设置为4.7~37.5mmol/L。
2.11 金属离子对酶活性的影响在测活体系中加入不同的金属离子,使金属离子的终浓度达到 1 mmol/L,4℃放置48h后,37℃下测定活性,以不加金属离子的酶活力为100%.金属离子分别为:Pb2+,Ba2+,Cu2+,As3+,Mg2+,Mn2+,K+,Cr3+,Ag+,Fe2+。
2.12 化学试剂对酶活性的影响在体系中分别加入不同浓度的化学试剂EDTA、抗坏血酸、尿素,4℃放置48h后,37℃下测定活性,以不加化学试剂的酶活力为100%。
3. 结果与分析3.1 鸭肝过氧化氢酶的分离纯化粗酶液经DEAE-Sepharose离子交换层析柱后,所得结果如(图1)所示,收集有活性的各管洗脱液,经透析、浓缩后,再经过Sephacryl S-200凝胶柱,所得结果如(图2)所示.纯化后的过氧化氢酶经SDS-PAGE,显示为一条带(图3),说明该酶纯化已经达到电泳纯,酶的整个分离纯化结果见表1.图1. 鸡肝过氧化氢酶的DEAE Sepharose离子交换柱层析图2. 鸡肝过氧化氢酶的Sephacryl S-200凝胶柱层析M.分子标准样品marker;1.鸡蛋清溶菌酶14.4KD;2.胰蛋白酶抑制剂20.1KD;3.牛碳酸酐酶31KD;4.兔肌动蛋白43KD;5.牛血清蛋白66.2KD;6.兔磷酸化酶B 97.4KD;S.过氧化氢酶图3.鸡肝过氧化氢酶SDS-PAGE电泳表1.鸡肝过氧化氢酶的分离纯化3.2 鸡肝过氧化氢酶分子量测定SephacrylS-200凝胶层析测得鸭肝过氧化氢酶的全分子量为250KD,SDS-PAGE法测定其多肽链分子量为62.5KD,表明鸭肝过氧化氢酶由4条相同的多肽链组成。
3.3 过氧化氢酶的最适pH与pH稳定性实验结果表明,鸡肝过氧化氢酶在pH 7.0左右时活性最强,pH 5.0~7.5活力较高,超出其范围活力较低(图4)。
鸡肝过氧化氢酶在pH 3~8的范围内是比较稳定的,在pH 5~8的范围内活性基本保留原有活性的90%以上,pH 9.0时,残余酶活力不到60%(图5)。
图4. PH对鸡肝过氧化氢酶活力的影响图5.鸡肝过氧化氢酶的PH稳定性3.4 过氧化氢酶的最适温度与热稳定性实验结果表明,鸡肝过氧化氢酶的最适温度为40℃左右(图6),20~40℃具有较好的热稳定性,保温60min活性保留原有活性的90%以上。
该酶60℃保温60min活性丧失50%以上,65℃保温10min活性损失殆尽(图7)。
图6.温度对鸡肝过氧化氢酶活力的影响图7.鸡肝过氧化氢酶温度稳定性的测定3.5 酶促反应初速度V过氧化氢酶催化过氧化氢的反应初速度的测定结果见图8,得出回归方为373.60μmol/(L·min)。
程:y=46.111x+70.713,可求出其反应初速度V图8.酶促反应初速度3.6 米氏常数Ks以及Vm的测定在最适条件下,测定底物浓度为 4.69,9.38,14.06,18.75,28.13,37.50 mmol/L的反应速度,按测定结果计算1/[S]和1/V,并按双倒数法作图,得到线性回归方程:y=5.9853x+0.1606,求得过氧化氢酶的Km值为37.29mmol/L(图9)。