第四章 酶的提取与分离纯化
- 格式:doc
- 大小:120.00 KB
- 文档页数:9










酶的提取、分离、纯化及其活力测定一、实验目的酶是植物体内具有催化作用的蛋白质,植物体内的生化反应,一般都是在酶的作用下进行的,没有酶的催化反应,植物的生命也就停止了,因此对酶的研究是阐明生命现象本质中十分重要的部分。
为要研究酶首先要将酶从组织中提取出来,加以分离、纯化,不同的研究目的对酶制剂的纯度要求也不相同,有些工作只需要粗的酶制剂即可,而有些工作则要求较纯的酶制剂,需根据不同情况区别对待。
在酶的提取和纯化过程中,自始至终都需要测定酶的活性,通过酶活性的测定以监测酶的去向。
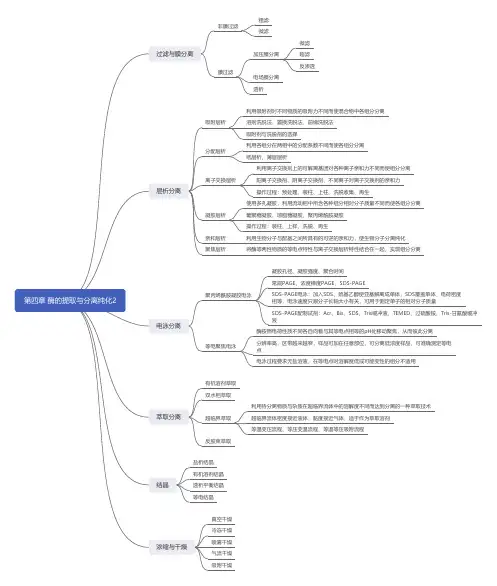
二、实验原理(一)酶的提取1.酶的存在位置?存在于动植物以及微生物的细胞的各个部位。
2.如何将酶从细胞中分离?从高等植物中提取酶常遇到一些实际问题,首先是细胞中含有许多种酶,每种酶的浓度又很低,只占细胞总蛋白质中的极小部分(叶中的双磷酸核酮糖羧化酶除外),而许多植物组织中蛋白质的含量又很低。
此外,各种酶的存在状态不同,有在细胞外的外酶,在细胞内的内酶,内酶中又有与细胞器一定结构相结合的结合酶,也有的存在于细胞质中,提取时都应区别对待,作不同处理。
如果酶仅存在于细胞质中,只要将细胞破碎,酶就会转移到提取液中;但如果是与细胞器(如细胞壁、细胞核、线粒体、原生质膜、微粒体等)紧密结合的酶,这时如仅仅破碎细胞还不够,还需要用适当的方法将酶从这些结构上溶解下来。
其次,细胞中存在抑制物质,如酚,酸,离子等,它们通常在液泡中,当细胞破碎时,这些物质象蛋白质一样从细胞中释放出来,进入提取液中,特别是酚类物质,具有游离的酚羟基,能与蛋白质肽键的氧原子形成强的氢键,不能为一般的实验方法,如透析和凝胶过滤所解离。
酚易氧化产生醌,醌为一种强氧化剂,会使蛋白质的功能团发生氧化或发生聚合,使蛋白质上的反应基团,如—SH,—NH2,通过1,4—加成反应而发生不可逆的聚合作用,使酶失活,也使植物组织和提取液产生棕色,以致影响酶活性的测定。
因此如果没有特殊需要,一般常选用植物的非绿色部分或者黄化的幼苗,在这些组织中一般酚类化合物含量较低。
酶提取和分离纯化的大致流程下载温馨提示:该文档是我店铺精心编制而成,希望大家下载以后,能够帮助大家解决实际的问题。
文档下载后可定制随意修改,请根据实际需要进行相应的调整和使用,谢谢!并且,本店铺为大家提供各种各样类型的实用资料,如教育随笔、日记赏析、句子摘抄、古诗大全、经典美文、话题作文、工作总结、词语解析、文案摘录、其他资料等等,如想了解不同资料格式和写法,敬请关注!Download tips: This document is carefully compiled by theeditor. I hope that after you download them,they can help yousolve practical problems. The document can be customized andmodified after downloading,please adjust and use it according toactual needs, thank you!In addition, our shop provides you with various types ofpractical materials,such as educational essays, diaryappreciation,sentence excerpts,ancient poems,classic articles,topic composition,work summary,word parsing,copy excerpts,other materials and so on,want to know different data formats andwriting methods,please pay attention!酶提取和分离纯化的大致流程。
1. 细胞破裂。
机械法,例如匀浆、研磨。
第四章酶的提取与分离纯化1、细胞破碎的目的、方法。
•大多数酶都存在于细胞内部,为了获得细胞内的酶,首先要收集细胞并进行细胞破碎,使细胞的外层结构破坏,然后进行酶的提取与分离纯化。
•机械法•物理法•化学法•酶促破碎法(酶解)2 选择细胞破碎方法的依据。
•(1)细胞的处理量:大规模用机械法,小规模用非机械法。
•(2)细胞壁的强度与结构•(3)目标产物对破碎条件的影响。
机械法考虑剪切力,酶法考虑对目标产物是否具有降解作用。
•(4)破碎程度:高压匀浆法,细胞碎片细小,固液分离困难。
•(5)提取分离的难易3. 酶抽提的目标及方法。
提取目标:• a. 将目的酶最大限度地溶解出来。
• b. 保持生物活性。
提取原则• a. 相似相溶。
• b. 远离等电点的pH值,溶解度增加。
4.三种离心方法(差速离心、密度梯度离心和等密度梯度离心)的特点。
(1)差速离心特点:用于分离大小和密度差异较大的颗粒。
(2)密度梯度离心特点::•区带内的液相介质密度小于样品物质•颗粒的密度。
•适宜分离密度相近而大小不同的固相•物质。
(3)等密度梯度离心特点:•介质的密度梯度范围包括所有待分离物质的密度。
•适于分离沉降系数相近,但密度不同的物质。
5. 酶的分离纯化过程中常用沉淀法的种类及原理。
种类:⑴中性盐沉淀(盐析法)基本原理(盐溶和盐析)向蛋白质或酶的水溶液中加入中性盐,可产生两种现象:1) 盐溶(salting in):低浓度的中性盐增加蛋白质的溶解度。
2) 盐析(salting out):高浓度的中性盐降低蛋白质的溶解度。
⑵有机溶剂沉淀利用酶等蛋白质在有机溶剂中的溶解度不同而使之分离的方法。
1. 沉淀机理降低溶液的介电常数部分地引起蛋白质脱水2. 常用有机溶剂丙酮>乙醇>甲醇,用量一般为酶液体积的2倍左右,终浓度为70%。
⑶选择性沉淀(热变性和酸碱变性)选择一定的条件使溶液中存在的某些杂蛋白质变性沉淀而不影响所需蛋白质的方法。
⑴热变性几乎所有的蛋白质都因加热变性而凝固,加热升高温度使杂蛋白变性沉淀而保留目的物在溶液中。
⑵ pH变性等电点沉淀法是pH变性法中的一种变体。
⑶有机溶剂变性使那些对有机溶剂敏感的杂蛋白变性沉淀。
⑷等电点沉淀原理:蛋白质在等电点时溶解度最低不同的蛋白质具有不同的等电点⑸有机聚合物沉淀作用机理:与有机溶剂类似,是发展较快的一种新方法。
沉淀剂:常用聚乙二醇(简写 PEG )多用分子量为6000~20000的 PEG。
6. 双水相萃取、超临界流体萃取的概念。
•超临界萃取,又称为超临界流体萃取,是利用欲分离物质与杂质在超临界流体中的溶解度不同而达到分离的一种萃取技术。
•利用溶质在两个互不相溶的水相中的溶解度不同而达到分离。
7. 膜分离的原理及应用。
•膜分离过程中,薄膜的作用是选择性地让小于其孔径的物质颗粒或分子通过,而把大于其孔径的颗粒截留。
•应用(自己整理)超滤法在蛋白质溶液除盐、浓缩及分离纯化中有广泛的应用。
•反渗透:海水淡化•电场膜分离:脱盐,海水淡化,纯水制备,从发酵液中分离柠檬酸、谷氨酸及凝胶电洗脱。
8. 比较吸附层析、疏水层析、离子交换层析、凝胶过滤、亲和层析,高效液相色谱的概念及原理上的不同点。
•吸附层析是利用吸附剂对不同物质的吸附力不同而使混合物中各组分分离的层析方法。
•离子交换层析是利用离子交换剂上的可解离基团(活性基团)对各种离子的亲和力不同而达到分离目的的一种层析分离方法。
•凝胶层析又称为凝胶过滤、分子排阻层析、分子筛层析等,是指以各种凝胶为固定相,利用流动相中所含各种组分的相对分子质量不同而达到物质分离的一种层析技术。
•亲和层析是利用生物分子与配基之间所具有的可逆的亲和力,使生物分子分离纯化的层析技术。
•HPLC是利用样品中的溶质在固定相和流动相之间分配系数的不同,进行连续的无数次的交换和分配而达到分离的过程。
9. 比较连续与非连续、变性与非变性聚丙烯酰胺凝胶电泳区别。
连续电泳:采用相同孔径的凝胶和相同的缓冲系统,只有分离胶;不连续电泳:采用不同孔径的凝胶和不同缓冲体系,有分离胶和浓缩胶。
连续PAGE:电荷效应、分子筛效应不连续PAGE:电荷效应、分子筛效应、浓缩效应1)电荷效应 : 分离胶中,蛋白质表面净电荷不同,迁移率不同。
2)分子筛效应:大小和形状不同的样品分子通过一定孔径的分离胶时,受阻滞的程度不同而表现出不同的迁移率。
3)浓缩效应:使样品在浓缩胶中被浓缩成一条窄带,然后再进入分离胶进行分离。
系统的不连续性表现在以下几个方面:1.凝胶由上、下两层凝胶组成,两层凝胶的孔径不同,上层为大孔径的浓缩胶,下层为小孔径的分离胶。
2.缓冲液离子组成及各层凝胶的pH不同。
电极缓冲液为pH8.3的Tris-甘氨酸缓冲液,浓缩胶为pH6.7的Tris-HCl缓冲液,而分离胶为pH8.9的Tris-HCl缓冲液。
3.在电场中形成不连续的电位梯度。
因此,在这样一个不连续的系统里,存在三种物理效应,即样品的浓缩效应,凝胶的分子筛效应和电荷效应,提高了分辨率。
变性聚丙烯酰胺凝胶电泳:加了SDS非变性聚丙烯酰胺凝胶电泳:不加SDS10. 蛋白质浓度测定方法及酶活力测定方法。
蛋白质浓度测定1.紫外吸收法:酪氨酸、色氨酸残基中苯环有共轭双键,在A280有最大吸收。
特点:简便、快速、不损耗样品,但干扰因素多。
2. 双缩脲法:具有两个或两个以上肽键的化合物均有双缩脲反应。
优点:快速;缺点:灵敏度差3. 酚试剂(Folin-酚)测定法:繁琐,但灵敏度、准确度高。
4. 染料结合法(考马斯亮蓝染色法):又称Bradford法,灵敏、简便、快速、干扰少,是近年来常用的检测法。
11. 比活力、提纯倍数、回收率的含义及用途。
酶的比活力(纯度)=活力单位数/毫克蛋白比活力越高,酶纯度也越好。
表示酶制剂纯度的一个指标。
纯化倍数=提纯后比活力/提纯前比活力表示提纯过程中纯度提高的倍数。
提纯倍数越大,表示该方法纯化效果越好。
总活力=酶活力单位数 酶液总体积即样品中全部酶活力。
回收率=提纯后酶总活力/提纯前酶总活力×100%表示提纯过程中酶损失程度的大小。
回收率越高,损失越小。
判断一个分离纯化方法的优劣,常用总活力的回收率和比活力的提纯倍数两个指标。
回收率:反映酶的损失情况。
提纯倍数:表示方法的有效程度。
一个好的纯化步骤是回收率较高,提纯倍数也较大。
12. 电泳的基本原理是什么?在一定pH条件下(用buffer),不同大小、形状及带电颗粒在电场中的移动速度不同(用迁移率表示),各自集中到特定的位置上而形成紧密的泳动带。
13. 凝胶过滤层析有哪四个方面的应用。
1)脱盐2)生物大分子物质的分离纯化3)分子量的测定4)溶液浓缩14. 影响凝胶过滤分辨率的因素有哪些?分配系数的含义及作用。
凝胶对溶质的排阻程度可用分配系数Kd表示:Ve-VoKd=————ViVo——外水体积,层析柱内凝胶颗粒之间空隙的体积(ml)Vi——内水体积,层析柱内凝胶颗粒内部各微孔体积的总和(ml)Ve——某组分的洗脱体积,从加进层析柱到流出液中该组分出现高峰时的洗脱液体积(ml)分配系数Kd的意义:1) 可定量地衡量各组分的流出顺序。
2) 判断分离效果,Kd差异大,分离效果好,Kd差异小,分离效果差。
15 .酶的分离纯化中,纯化方法的排序.先选用粗放、快速、有利于缩小样品体积的方法。
精确、费时、需样品少的方法,宜后选用。
16. 酶结晶的主要方法有哪些?•1、盐析结晶法 ;•2、有机溶剂结晶法;•3、等电点结晶法•4、透析平衡结晶法•5、温度差结晶法•6、金属离子复合结晶法2. 提高过滤性能的方法●1)絮凝和凝聚●2)稀释、加热●3)加助滤剂,常用硅藻土、纤维素、石棉粉、珍珠岩和淀粉等。
●4)反应剂●5)酶降解(三)细胞破碎确认1.直接测定破碎前后的细胞数:破碎前,用显微镜或电子微粒计数器直接计数;破碎后,用染色法区分破碎细胞与完整细胞。
2.测定导电率:利用破碎前后导电率的变化测定破碎程度。
3.测定释放的蛋白质量或酶活力:测定破碎液中胞内蛋白质或目的酶的释放量,估算破碎率。
三、酶的提取(extraction)把酶从生物组织或细胞中以溶解状态释放出来的过程,即将尽可能多的酶,尽量少的杂质从原料中引入溶液。
提取目标:a. 将目的酶最大限度地溶解出来。
b. 保持生物活性。
注意:温度升高,溶解度加大。
但为防止酶失活,一般采用低温下(0~10℃)操作。
提取原则a. 相似相溶。
b. 远离等电点的pH值,溶解度增加。
提取方法:(一)盐溶液提取:常用稀盐(常用NaCl)溶液(盐溶),对酶稳定性好、溶解度大,最常用。
(二)酸、碱溶液提取(三)有机溶剂提取:乙醇、丙酮和丁醇各种微生物细胞壁的结构与组成●初步纯化(rough fractionation)(提取):除去与目的产物性质差异很大的杂质。
●高度纯化(fine fractionation)(精制):除去与产物性质相似的杂质。
●浓缩与干燥(concentration and desiccation)(成品加工):使酶与溶剂分离的过程。
(三)常用离心方法差速离心法沉降速度法:密度梯度离心沉降平衡法:等密度梯度离心1.差速离心采用不同的离心速度和离心时间,使沉降速度不同的颗粒分批分离的方法。
特点:用于分离大小和密度差异较大的颗粒。
优点:操作简单。
缺点:1)分离效果较差,不能一次得到纯颗粒。
2)壁效应严重。
3)沉降的颗粒受到挤压。
2.密度梯度离心样品在密度梯度介质中进行离心,使沉降系数比较接近的组分得以分离的一种区带分离方法。
常用的密度梯度溶液是蔗糖溶液。
特点:•区带内的液相介质密度小于样品物质颗粒的密度。
•适宜分离密度相近而大小不同的固相物质。
3. 等密度梯度离心又称沉降平衡离心根据颗粒的密度不同而进行分离。
离心时,在离心介质的密度梯度范围内,不同密度的物质颗粒或向下沉降,或向上漂浮,达到与其相同的密度时不再移动,形成区带。
常用氯化铯(CsCl)作为梯度介质。
特点:•介质的密度梯度范围包括所有待分离物质的密度。
•适于分离沉降系数相近,但密度不同的物质。
沉降速度离心和沉降平衡离心的特点总结:•等密度梯度离心是一种测定颗粒浮力密度的静力学方法,关键在于选择氯化铯浓度,使之包括待分离物的密度范围。
•差速离心是一种动力学方法,关键在于选择适合于各分离物的离心力。
•密度梯度离心兼有以上两种方法的特点,关键在于制备优质的密度梯度溶液。
(四)应用根据不同离心目的,分为•制备性离心:分离纯化和制备•分析性离心:测分子量、沉降系数、密度、纯度五、沉淀分离(根据溶解度的不同)使溶液中的溶质由液相转变为固相析出古老、实用、简单的初步分离方法•在生物大分子制备中最常用的几种沉淀方法:•⑴中性盐沉淀(盐析法)•⑵有机溶剂沉淀•⑶选择性沉淀(热变性和酸碱变性)•⑷等电点沉淀•⑸有机聚合物沉淀影响迁移率的因素:1)颗粒性质:Q越大、r 越小、形状越接近球形,v 越快。