第2讲气体实验定律热力学第一定律
- 格式:docx
- 大小:85.25 KB
- 文档页数:8

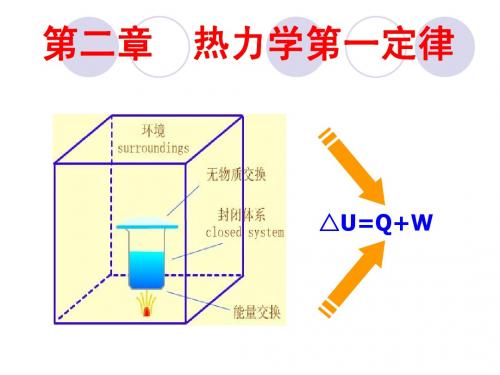
第二章 热力学第一定律一.基本要求1.掌握热力学的一些基本概念,如:各种系统、环境、热力学状态、系统性质、功、热、状态函数、可逆过程、过程和途径等。
2.能熟练运用热力学第一定律,掌握功与热的取号,会计算常见过程中的和的值。
3.了解为什么要定义焓,记住公式的适用条件。
4.掌握理想气体的热力学能和焓仅是温度的函数,能熟练地运用热力学第一定律计算理想气体在可逆或不可逆的等温、等压和绝热等过程中,的计算。
5.掌握等压热与等容热之间的关系,掌握使用标准摩尔生成焓和标准摩尔燃烧焓计算化学反应的摩尔焓变,掌握与之间的关系。
6.了解Hess定律的含义和应用,学会用Kirchhoff定律计算不同温度下的反应摩尔焓变。
二.把握学习要点的建议学好热力学第一定律是学好化学热力学的基础。
热力学第一定律解决了在恒定组成的封闭系统中,能量守恒与转换的问题,所以一开始就要掌握热力学的一些基本概念。
这不是一蹴而就的事,要通过听老师讲解、看例题、做选择题和做习题等反反复复地加深印象,才能建立热力学的概念,并能准确运用这些概念。
例如,功和热,它们都是系统与环境之间被传递的能量,要强调“传递”这个概念,还要强调是系统与环境之间发生的传递过程。
功和热的计算一定要与变化的过程联系在一起。
譬如,什么叫雨?雨就是从天而降的水,水在天上称为云,降到地上称为雨水,水只有在从天上降落到地面的过程中才被称为雨,也就是说,“雨”是一个与过程联系的名词。
在自然界中,还可以列举出其他与过程有关的名词,如风、瀑布等。
功和热都只是能量的一种形式,但是,它们一定要与传递的过程相联系。
在系统与环境之间因温度不同而被传递的能量称为热,除热以外,其余在系统与环境之间被传递的能量称为功。
传递过程必须发生在系统与环境之间,系统内部传递的能量既不能称为功,也不能称为热,仅仅是热力学能从一种形式变为另一种形式。
同样,在环境内部传递的能量,也是不能称为功(或热)的。
例如在不考虑非膨胀功的前提下,在一个绝热、刚性容器中发生化学反应、燃烧甚至爆炸等剧烈变化,由于与环境之间没有热的交换,也没有功的交换,所以。








理想气体与热力学第一定律一、理想气体模型与克拉珀龙方程。
⒈气体实验定律。
玻‐马定律pV = p0V0= C pV查理定律 p = p0(1+αp t)盖·吕萨克定律 V = V0(1+αV t)αp、αV分别为气体压强系数和体胀系数,且αp≈αV≈1/273.15℃⒉克拉珀龙方程。
比较气体实验定律中的查理定律和盖·吕萨克定律,可以很容易地看到共同之处。
如果我们改变温标的零点,令纯水的三相点为273.16K(1K=1℃),αp=αV=1/T0,则p = p0 T/T0V = V0 T/T0即p/T=p0/T0=C pT,V/T=V0/T0=C VT∴pV/T=p0V0/T0= C这样我们就得出了理想气体状态方程,即克拉珀龙方程pV=nRT。
例⒈⑴计算空气泡在水下多深处不会上浮(忽略温度变化)。
⑵试定量分析半杯水加纸盖后翻转的平衡态。
⒊理想气体模型。
实验表明,温度高、压强低的气体与气体实验定律符合得较好。
可以引入一个理想化模型,称为理想气体,它严格服从气体实验定律,且αp=αV=1/273.15℃。
理想气体被描述为这样一群粒子:⑴永不停歇地进行着无规则热运动。
⑵具有无限的可压缩性,即粒子本身的体积忽略不计。
⑶粒子间作用力为零。
⑷粒子不断相互碰撞或与器壁碰撞(产生压力),两次碰撞间粒子做匀速直线运动。
由理想气体模型可以得出理想气体状态方程。
考虑一边长为l的立方体容器,内盛N个质量为m的粒子,其平均速度为u,分子数密度为n*=N/l3。
粒子与器壁碰撞后动量改变量mu-(-mu)=2mu在t时间内与容器某一个面碰撞的粒子数n*utl2/6粒子与器壁碰撞产生压强p=2mu·n*utl2/6tl2=n*mu2/3=2n*(mu2/2)/3=2n*E K/3 粒子平动动能E K=3kT/2∴p=n*kT∵k=R/N A,n*=N/V∴pV=NRT/N A=nRT理想气体模型也可以类比于拥有大量运动粒子的系统,例如所谓的电子气、光子气等;在宇宙尺度上可与星系运动类比。





1第二章热力学第一定律2.1 热力学概论2.2 热力学的一些基本概念2.3 热力学第一定律2.4 焓和热容2.5 理想气体的热力学能和焓2.6 几种热效应2.7 化学反应的焓变22.1 热力学概论1. 热力学的研究对象2. 热力学的研究方法和局限性化学热力学是用热力学基本原理研究化学过程或与化学有关的物理过程。
热力学是研究宏观系统的热与其他形式能量之间的相互转换关系及其转换过程中所遵循的规律。
32.1.1 热力学的研究对象1. 研究化学过程及其与化学密切相关的物理过程中的能量转换关系。
2. 判断某条件下指定的热力学过程如相变、化学变化等的变化方向以及可能达到的最大限度。
根据第一定律计算变化过程中的能量变化,根据第二定律判断变化的方向和限度。
42. 1.2 热力学的研究方法和局限性研究方法•研究对象是大数量分子的集合体,研究宏观性质,所得结论具有统计意义。
•只考虑变化前后的净结果,不考虑物质的微观结构和反应机理。
•不研究系统的宏观性质与微观结构之间的关系局限性•不知道反应的机理、速率和微观性质•只讲可能性,不讲现实性•能判断变化能否发生以及进行到什么程度,但不考虑变化所需要的时间。
52.2 热力学的一些基本概念1. 系统和环境2. 系统的宏观性质3. 热力学平衡态4. 状态函数5. 过程和途径62.2.1 系统和环境系统(system )在科学研究中,把被划定的研究对象称为系统,亦称为物系或体系。
环境(surroundings)与系统密切相关、有相互作用或影响所能及的部分称为环境。
系统环境系统与环境72.2.1 系统和环境根据系统与环境之间的关系,把系统分为三类:(1)敞开系统(open system )系统与环境之间既有物质交换,又有能量交换。
环境有物质交换有能量交换敞开系统经典热力学不研究敞开系统82.2.1 系统和环境(2)封闭系统(closed system )系统与环境之间无物质交换,但有能量交换。

第2讲气体实验定律热力学第一定律
基础梳理
1.气体的三个实验定律
(1)等温变化——玻意耳定律
①内容:一定质量的某种气体,在温度不变的情况下,压强与体积成.
②公式:或PV=C(常数).
(2)等容变化——查理定律
①内容:一定质量的某种气体,在体积不变的情况下,压强与热力学温度成.
②公式:或与=C(常数).
(3)等压变化——盖一吕萨克定律
①内容:一定质量的某种气体,在压强不变的情况下,其体积与热力学温度成.
②公式:或*=C(常数).
4.理想气体及其状态方程
(1)理想气体
①宏观上讲,理想气体是指在任何条件下始终遵守气体实验定律的气体.实际气体在压强、温度的条件下,可视为理想气体.
②微观上讲,理想气体的分子间除碰撞外无其他作用力,分子本身没有体积,即它所占据的空间认为都是可以被压缩的空间.
(2)状态方程:或牛=C(常数).
5.改变物体内能的两种方式
(1)∙(2).
6.绝热过程
系统不从外界,也不向外界.
7.热传递
热量从物体传到物体.热传递有三种方式:、和
8.热力学第一定律
一个热力学系统的内能增量等于外界向它_______ 与外界对它.公式为AU=
考点1三个气体实验定律的应用)
1、一定质量的理想气体经历了温度缓慢升高的变化,如图所示,P-T和V,图像各记录了其部分变化过程.
(1)求温度600K时气体的压强.
(2)在p-T图像上将温度从400K升高到600K的变化过程补充完整.
2、(2020•新课标”卷)如图所示,两侧粗细均匀、横截面积相等、高度均为H=18cm的U 形管,左管上端封闭,右管上端开口.右管中有高%=4cm的水银柱,水银柱上表面离管口的距离/=12cm.管底水平段的体积可忽略.环境温度为Ti=283K.大气压强po=76cmHg.
(1)现从右侧端口缓慢注入水银(与原水银柱之间无气隙),恰好使水银柱下端到达右管底部.此时水银柱的高度为多少?
(2)再将左管中密封气体缓慢加热,使水银柱上表面恰与右管口平齐,此时密封气体的温度为多少?
考点2探究等温情况下一定质量气体压强与体积关系)
3、(2020•宿迁期末)用气体压强传感器探究“一定质量气体在温度不变
时压强与体积关系”的实验装置如图所示,实验步骤如下:
A.将注射器活塞移动到适当的位置,逐一连接注射器、压强传感器、数
据采集器和计算机.
B.手握住注射器筒的空气柱部分,开始缓慢推拉活塞改变气体体积.
C.记录此时注射器内封闭气体的体积Vi和由计算机显示的气体压强值0.
D.多测几组V、P数据,记录并作出相应图像,分析得出结论.
(1)该同学对器材操作错误的步骤是,因为该操作会直接影响气体的(填“温度”“压强”或“体积”).
(2)某小组在一次实验过程中,环境温度明显升高,其他操作均规范,则该小组最后得
C
(3)在不同温度环境下,某小组重复了上述实验,实验操作和数据处理均正确.环境温度分别
为△、τ2f且。
>不.在如图所示的四幅图中,可能正确反映相关物理量之间关系的是
著点3_对热力学第一定律的理解)
4、一定质量的理想气体在某一过程中,外界对气体做功7.0X1()4J,气体内能减少
1.3X105J,则此过程()
A.气体从外界吸收热量2.0XIO5J
B.气体向外界放出热量2.0XIO5J
C.气体从外界吸收热量6.0X104j
D.气体向外界放出热量6.0X104j
考点4对热力学第二定律的理解)
5、关于第二类永动机,下列说法中错误的是()
A.第二类永动机是指没有冷凝器,只有单一的热源,能将从单一热源吸收的热量全部用来做功而不引起其他变化的热机
B.第二类永动机违背了能量守恒定律,所以不可能制成
C.第二类永动机违背了热力学第二定律,所以不可能制成
D.第二类永动机不可能制成,说明机械能可以全部转化为内能,但内能却不能全部转化为机械能,而不引起其他变化
考点5热力学第一定律与气体实验定律的综合)
6、某汽车的四冲程内燃机利用奥托循环进行工作.该循环由两个绝热过程和两个等容过程组成.如图所示为一定质量的理想气体所经历的奥托循环,则该气体()
A.在状态。
和C时的内能可能相等“飞
B.在。
一b过程中,外界对其做的功全部用于增加内能\
C.b』过程中增加的内能小于d-a过程中减少的内能"卜士≥T z
D.在一次循环过程中吸收的热量小于放出的热量OLJ ------------------ ,
7、(2020•徐州三校联考)如图所示为一密闭内壁光滑太阳能集热汽缸,下底面及侧面为可导热的集热材料,顶面为质量为机的透明玻璃活塞,已知活塞横截面积为5,外界大气压强为⑷,缸内气体温度为兀现将汽缸静置于阳光下,气体体积由口增大到该过程中气体吸收的热量为勒,之后保持体积%不变,已知气体内能U与温度T的关系为U=αT,求:(1)停止加热时缸内气体的温度. 「「
8、(2020•泰州二模)一定质量的理想气体,其内能跟热力学温度成正比.在初始状态4时,体积为%,压强为po,温度为To,此时其内能为Uo.该理想气体从状态A经由一系列变化,最终返回到原来状态A,其变化过程的V-T图如图所示,其中CA延长线过坐标原点,8、A点在同一竖直线上.求:
(1)该理想气体在状态3时的压强.
(2)该理想气体从状态B经由状态。
回到状态A的过程中,气体向外界放出的热量.
脸堂验收及时风g),课M钎价
1.(2020•泰州期中)关于下列四幅图的说法正确的是()
A.图甲中,显微镜下看到的三颗微粒运动位置连线是它们做布朗运动的轨迹
B.烧热的针尖,接触涂上薄蜂蜡层的云母片背面上某点,经一段时间后形成图乙的形状,则说明云母为非晶体
C.图丙中分子间距离为小时,分子间作用力尸最小,分子势能也最小
D.图丁中水电停在水面上的原因是水电受到了水的浮力作用
2.(2020•扬州中学)下列现象中,不是由于液体的表面张力造成的是()
A.船浮于水面上
B.硬币或钢针浮于水面上
C.绸布伞有缝隙但不漏雨水
D.锋利的玻璃片,用酒精灯烧一段时间后变钝了
3.如图所示,一汽缸固定在水平地面上,用重力不计的活塞封闭着一定质量的气体.已知汽缸不漏气,活塞移动过程中与汽缸内壁无摩擦.初始时,外界大气压强为po,活塞紧压小挡板.现缓慢升高汽缸内气体的温度,则下列图中能反映汽缸内气体的压强P随热力学温
4.在探究“气体压强与体积的关系”的实验中,用同一个注射器在实验室前后做了两次实验,探究气体压强与体积的关系,操作完全正确.
(1)根据实验数据在P-V图上画出了两条不同双曲线,如图所示.造成这种情况的可能原
因是 _______
A.两次实验中空气质量不同
B.两次实验中温度不同
C.其中一次实验时活塞受到的摩擦力太大
D.其中一次实验时活塞受到的摩擦力太小
(2)实验中为了保持封闭气体的温度不变,下列采取的措施比较合理的是.
A.在活塞上涂上润滑油,保持良好的密封性
B.推拉活塞时要缓慢
C.不要用手直接握在注射器有气体的部分上
D.实验前注射器内要吸入尽量多的空气
5.气体膨胀对外做功I(X)J,同时从外界吸收了120J的热量,它的内能的变化是()
A.减小20J
B.增大20J
C.减小220J
D.增大220J
6.当把打足气的车胎内的气体迅速放出时,会发现气嘴处的温度明显降低,这是因为()
A.气体对外做功,同时向外放出热量
B.气体对外做功,胎内气体温度降低,从外界吸热
C.外界对气体做功,胎内气体向外传递热量
D.外界对胎内气体做功,同时向胎内气体传递热量
7.关于两类永动机和热力学的两个定律,下列说法中正确的是()
A.第二类永动机不可能制成是因为违反了热力学第一定律
8.第一类永动机不可能制成是因为违反了热力学第二定律
C.由热力学第一定律可知做功不一定改变内能,热传递也不一定改变内能,但同时做功和热传递一定会改变内能
D.由热力学第二定律可知热量从低温物体传向高温物体是可能的,从单一热源吸收热量,完全变成功也是可能的
8.(2019∙新课标Il卷)如P-V图所示,1、2、3三个点代表某容器中一定量理想气体的三个不同状态,对应的温度分别是△、T2、73.用M、N2、M分别表示这三个状态下气体分子在单
位时间内撞击容器壁上单位面积的次数,则M N"73,MM.(填“大
于,,“小于”或“等于”)
9.(2019・江苏卷)如图所示,一定质量理想气体经历A-B的等压过程,BfC的绝热过程(气体与外界无热量交换),其中BfC过程中内能减少900J.求AfBfC过程中气体对外界做的总功.。