共价型分子结构式、电子式
- 格式:docx
- 大小:212.43 KB
- 文档页数:8

中学化学中常见的电子式大全原子离子单质分子共价化合物离子化合物形成过程电子式书写的常见错误及纠正措施物质的电子式可体现其构成元素之间的结合方式,也决定着该物质的化学性质;对于简单微粒还可以通过电子式推导其空间结构。
因此电子式是近几年高考的考查热点之一。
但由于高中教材中未涉及电子亚层、分子轨道等理论知识,学生难以较系统理解微粒最外层电子的排布,而只能靠记忆、知识积累来处理这一类问题,错误率较高, 如将氧原子的电子式写成 (正确应为 )。
典型错误归纳有以下两类:一、无法正确排列微粒中原子或离子的顺序。
例如HClO 的电子式写成: ; MgCl 2的电子式写成: 。
二、不能正确表达共价键的数目。
例如混淆O 2和H 2O 2中氧原子间的共用电子对数目。
针对以上问题,笔OO H Cl O Mg 2+ Cl 2者总结了三种书写短周期元素形成的微粒的电子式的小技巧,供大家参考。
一:“异性相吸、电荷交叉”让原(离)子快乐排队。
“异性相吸、电荷交叉”是指在书写电子式时让微粒中带(部分)正电荷的离(原)子与带负电荷的离(原)子交错排列。
如次氯酸的分子式常被约定俗成为HClO ,但根据H 、Cl 、O 个三原子的氧化性(或电负性)差异可知该分子中H 、Cl 带部分正电荷,O 带部分负电荷,因此HClO 的电子式应为 :。
对于离子化合物Mg 3N 2,先可判断出式中Mg 为+2价,N 为-3价,根据“异性相吸、电荷交叉”的规律其电子式为 。
这条规律几乎适用于所有的离子化合物,运用时要求大家首先能正确判断化学式含有的微粒种类和它们所带的电荷的正负。
如MgCl 2由Mg 2+和Cl -以1:2的比例构成,Na 2O 2由Na +和O 22-以2:1的比例构成。
而对于共价微粒、只有少数氧化性(电负性)相差很小的非金属原子形成的共价体有例外,例如HCN (其中C 为+4价、N 为-3价,电子式为 )。
高中阶段涉及的常见共价微粒(由短周期元素原子形成的共价微粒)的电子式基本都可以采用该规律来解决。

电子式电子式(electron-dot structure)是G.N Lewis(路易斯)在1916年发表和讲授他的化学键理论时用点·表示价电子及成键情况的结构式,所以电子式又被称为路易斯式(Lewis dot structure 或Lewis electronic formula)。
与元素符号在世界通用不同,电子式各国书写并不完全相同,国际纯粹和应用化学联合会(International union of pure and applied chemistry或IUPAC)在1997年出版的化学术语综述(第二版)这样描述电子式:电子式是用点·来表示价电子的分子结构式。
在分子两原子间的两个点表示一个共价键,双键则用两对点表示,依次类推。
原子未成键的最外层电子(价电子)‥排放在它自已旁边,但不能放在它的原子和其他原子之间,如H:Cl:。
当核内质子数与核外‥电子总数(内层电子与外层电子和)不同时,要在原子或原子团右上角标明所带电荷,如2-,3+等,成键的两个电子要写在一条线上,表明电子对。
根据这一原则,我们书写电子时要注意:⑴电子式上的点·是最外层电子,如果是阴离子电子式上点数是所有最外层电子数和加所带电荷数,阳离子要减去所带电荷数,如SO42-要有三十二个点,NH4+只有10个点。
⑵要分清离子和原子,根和基,离子化合物和共价化合物,要标明阴阳离子所带电荷和正确使用括号。
原子、基、和共价化合物分子不能用括号,离子和离子化合物有点的要加括号。
⑶书写电子式的方法:原子的电子式只需将最外层电子排列在原子周围,通常要表达出原.子的成键情况,如·Mg·表示将成为+2价,·C·表示将形成4价。
˙复杂离子和分子要首先确定框架(分子构型)。
通常以化合价高的原子作为中心原子,特殊情况需要记忆。
如含氧酸一般是H和O形成羟基,再跟中心原子成键,如HclO中原子排列次序是HOCl。

⾼⼆化学电⼦式书写复习及对应习题讲解、练习学员编号:年级:⾼⼆课时数: 2学员姓名:辅导科⽬:化学学科教师:授课类型T 电⼦式 C 结构式T化学键授课⽇期及时段教学内容引导回顾知识点解题⽅法1.电⼦式书写 1. 熟悉元素周期表及原⼦结构2.结构式 2. 熟悉电⼦式书写3.离⼦化合物与供价化合物 3. 离⼦键和共价键4.化合物形成过程书写 4. 离⼦化合物与供价化合物同步讲解微粒电⼦式书写正确与否的判断⽅法⼀、根据化合物类型判断电⼦式是否正确。
1.离⼦化合物正负电荷的代数和为零,查看阳离⼦、阴离⼦所带电荷数是否相等,相等就有可能正确。
2.阴离⼦和复杂的阳离⼦要⽤中括号括起来。
3.⾮⾦属原⼦周围要符合8电⼦稳定结构(H、B例外)。
4.共价化合物要注意极性共价键的共⽤电⼦对要偏向呈负价的元素,⾮极性共价键共⽤电⼦对在中央,孤对电⼦不要忘。
⼆、注意辨别“根”“基”的区别。
5.“根”中的原⼦⼀般都符合8电⼦稳定结构,“根”是带电荷的;例如:OH-、NH4+。
6.“基”中⾄少有⼀个原⼦是不符合8电⼦稳定结构,“基”是不显电性的,例如:-CH3、-OH 。
三、注意微粒间的排列⽅式。
7.离⼦化合物多离⼦微粒阴阳离⼦交替排列。
8.共价化合物(有机物除外)多原⼦微粒正负价原⼦交替排列。
9.注意:过氧离⼦和过氧原⼦团不能拆开。
四、中学理科学⽣化学必会的电⼦式如下:1.原⼦的电⼦式:H、C、N、O、Na、Mg、Al、S、Cl。
2.离⼦的电⼦式:O2-、O22-、S2-、Cl-、Na+、Mg2+、Al3+。
3.“基”的电⼦式:-CH3、-CH2CH3、-OH 、-CHO 、-COOH 。
4.“根”的电⼦式:OH-、ClO- 、HCOO-、CH3COO-、NH4+。
5.单质分⼦的电⼦式:H2、Cl2、N2、(CN)2。
6.共价化合物的电⼦式:(1)氢化物:HCl 、H2O 、NH3、CH4 、C2H4、C2H4 。
(2)氧化物:CO2 、H2O2 。


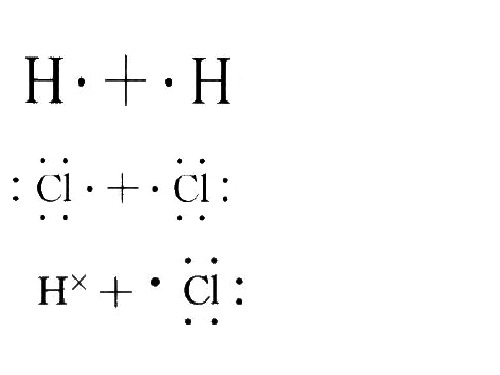
共价型分子结构式、电子式学校:___________姓名:___________班级:___________考号:___________一、单选题1.化学用语是国际化学界统一规定的用来表示物质的组成、结构和变化规律的特殊符号,同时也是学习化学的一种专用工具。
下列有关化学用语正确的是()A.NH4Cl中Cl−的结构示意图:ClB.质子数为17、中子数为20的氯原子:2017C.新制氯水中会有少量次氯酸,其电子式为:D.明矾可用于净水,其化学式为:KAl(SO4)2 ∙12H2O2.下列有关化学用语表示正确的是()A.HClO的结构式:H-O-ClB.对硝基甲苯的结构简式:C.CH2F2的电子式:D.CO2的比例模型:3.下列化学用语或模型正确的是()A.乙烯的结构简式:CH2CH2B.甲烷分子的填充(比例)模型:C.羟基的电子式:D.乙酸的官能团:H+4.下列有关化学用语不能表示2-丁烯的是()A.B.CH3CH=CHCH3C.D.5.下列有关化学用语表示正确的是()A.239Pu比235U原子核内多4个中子B.肼(N2H4)的电子式为:C.硫酸氢钠熔融时的电离方程式:NaHSO4=Na++HSO4-D.过氧化氢的电子式:6.下列化学用语正确的是()A.羟基的电子式:B.甲醇的球棍模型:C.是3﹣甲基﹣1,3﹣丁二烯的键线式D.聚丙烯的结构简式:7.下列电子式书写正确的是()A.氯化氢的电子式:B.CCl4的电子式:C.HClO的电子式:D.KBr的电子式:二、填空题8.下列粒子(分子或离子)均含有18个电子:请回答下列问题:(1)A 的元素符号是____________,B2-的结构示意图是________。
(2)C与D混合,发生反应的化学方程式为_____________________________________。
(3)E的电子式是________;F的水溶液常用于消毒剂,F的化学式是________。
9.电子式的运用(1)用电子式表示粒子:①氢氧根离子________;②羟基________;③二氧化碳分子_________。
(2)用电子式表示化合物的形成过程④MgF2___________________________;⑤H2O _________________________。
10.(1)写出下列物质的电子式:Na2O2____________;CO2______;HClO_________ 。
(2)画出下列各微粒的结构示意图:①与Ne原子电子层结构相同的-2价阴离子的离子结构示意图_______________;②质量数为23,中子数为12的原子的原子结构示意图______________。
请仔细校对后使用,答案仅供参考。
参考答案1.D【解析】【详解】A.NH4Cl中Cl−最外层达到8电子稳定结构,离子结构示意图为,故A错误;Cl,故B B.质子数为17、中子数为20的氯原子的质量数为17+20=37,原子符号为:3717错误;C.新制氯水中会有少量次氯酸,次氯酸中氯原子只能形成1对共用电子对,氧原子形成2对共用电子对,其电子式为:,故C错误;D.明矾是十二水合硫酸铝钾的俗名,其化学式为:KAl(SO4)2 ∙12H2O,故D正确;故选D。
【点睛】本题的易错点为B,要注意原子符号中各位置的数字的含义的识别。
2.A【解析】【详解】A. 次氯酸分子中氢原子和氧原子共用一个电子对,氯原子和氧原子共用一个电子对,所以其结构简式为:H-O-Cl,故A正确;B. 硝基写在苯环左边应该表示为:O2N-,对硝基甲苯的结构简式为,故B错误;C. CH2F2分子中,C、F原子最外层都达到8电子稳定结构,电子式为,故C错误;D.CO2中,C原子较大,2个O成对称排布在C两侧,比例模型应该是:,故D 错误;正确答案是A。
3.B本卷由系统自动生成,请仔细校对后使用,答案仅供参考。
【解析】【详解】A. 乙烯的官能团是碳碳双键,在结构简式中不能省略,结构简式:CH2=CH2,A错误;B.甲烷分子为正四面体结构,C原子在正四面体几何中心,四个H原子在正四面体的四个顶点上,由于C原子半径比H原子大,所以其比例模型为,B正确;C.O原子最外层有6个电子,其中一个成单的电子与H原子的电子形成一对共用电子对,因此羟基的电子式为,C错误;D.乙酸结构简式为CH3COOH,其官能团为羧基—COOH,D错误;故合理选项是B。
4.C【解析】【详解】A.是2﹣丁烯的键线式形式,故A正确;B.CH3CH=CHCH3是2﹣丁烯的结构简式形式,故B正确;C.表示的是1﹣丁烯的球棍模型形式,故C错误;D.是2﹣丁烯的电子式形式,故D正确。
故答案为C。
5.C【解析】【详解】A.U:中子数=质量数-质子数=235-92=143,Pu:中子数=质量数-质子数=239-94=145,145-143=2,故A错误;B.N2H4中含有1个N-N键和4个N-H键,正确的电子式为,故B错误;C.电解质加热熔时只能破坏离子键,则硫酸氢钠熔融时的电离方程式为NaHSO4=Na++HSO4-,故C正确;D.过氧化氢为共价化合物,过氧化氢的电子式为,故D错误;请仔细校对后使用,答案仅供参考。
故答案为C。
6.B【解析】【详解】A. 羟基的电子式是,故A错误;B. 甲醇的结构简式是CH3OH,球棍模型:,故B正确;C. 是2﹣甲基﹣1,3﹣丁二烯的键线式,故C错误;D. 丙烯的结构简式为CH2=CH—CH3,聚丙烯的结构简式是,故D错误。
7.C【解析】【详解】A、氯化氢是共价化合物,所以其电子式为,故A错误;B、氯原子未成键的孤对电子对未标出,四氯化碳的电子式为:,故B错误;C、HClO为共价化合物,含有-OH,电子式为,故C正确;D、溴化钾为离子化合物,钾离子与溴离子通过离子键结合,电子式为,故D错误。
答案选C。
【点睛】书写电子式时,要先判断物质类型,若是离子化合物,则把阴阳离子的电子式相间排列,若是共价型分子,则重点分析共用电子对的对数,再标出孤电子对。
8.K F2+2HCl===2HF+Cl2H2O2【解析】本卷由系统自动生成,请仔细校对后使用,答案仅供参考。
【分析】18e-微粒来源大体分三个部分:一是第三周期元素的气态氢化物及去H+的对应离子,二是第四周期的金属阳离子,三是由第二周期气态氢化物去掉氢原子后,两两结合得到的分子,共16种,阳离子K+、Ca2+;阴离子P3-、S2-、HS-、Cl-;分子有Ar、HCl、H2S、PH3、SiH4、F2、H2O2、C2H6、CH3OH、N2H4等,结合题目所给条件解答。
(1)阳离子中,原子序数=核外电子数+电荷数=核内质子数,阴离子中,原子序数=核外电子数-电荷数=核内质子数,含有18e-的A+、B2-、分别为K+、S2-,据此书写B2-的结构示意图;(2)单质,双核分子为F2,氧化能力最强,化合物,双核分子有HCl,氟气和氯化氢发生置换反应;(3)由两种元素组成的三原子分子为H2S,硫化氢为共价化合物,根据共价化合物的电子式表示方法书写,F为四核分子,水溶液常用于消毒剂为H2O2。
【详解】(1)含有18e-的A+、B2-、分别为K+、S2-,所以A元素为K,B元素为S,S2-的结构示意图为,故答案为:K;。
(2)18e-微粒,为单质双核分子,所以182=9,为F2,氧化能力最强,化合物,双核分子有HCl,氟气和氯化氢发生置换反应F2+2HCl═2HF+Cl2,故答案为:F2+2HCl═2HF+Cl2。
(3)由两种元素组成的三原子分子为H2S,硫化氢为共价化合物,分子中存在两个H-S键,电子式为,含有18e-的过氧化氢为常用的消毒剂,所以F为四核分子,水溶液常用于消毒剂为H2O2,故答案为:;H2O2。
9.请仔细校对后使用,答案仅供参考。
【解析】【详解】(1)①氢氧根离子中O原子与H原子之间形成1对共用电子对,且带一个单位负电荷,故氢氧根离子电子式为:;②羟基是9电子的,电子式为;③CO2是由极性键形成的直线型分子,分子式为;(2)④氟离子和镁离子通过离子键形成离子化合物氟化镁,MgF2的形成过程为;⑤H2O为共价化合物,分子中存在两个H-O键,用电子式表示其形成过程为:。
10.O2-【解析】【分析】(1)Na2O2是离子化合物,二氧化碳为共价化合物,HClO为共价化合物;(2)①与Ne原子电子层结构相同的-2价阴离子是O2-;②质量数为23,中子数为12的是Na原子。
【详解】(1)Na2O2是离子化合物,由Na+离子和O2-离子构成,电子式为;二氧化碳为共价化合物,分子中存在两对碳氧共用电子对,电子式为:;HClO 为共价化合物,分子中存在1个氧氢键和1个Cl-O键,电子式为:,故答案为:;;;本卷由系统自动生成,请仔细校对后使用,答案仅供参考。
(2)①与Ne原子电子层结构相同的-2价阴离子是O2-,O2-的离子结构示意图为,故答案为:;②质量数为23,中子数为12的是Na原子,其质子数为11和电子数为11,原子结构示意图为,故答案为:。