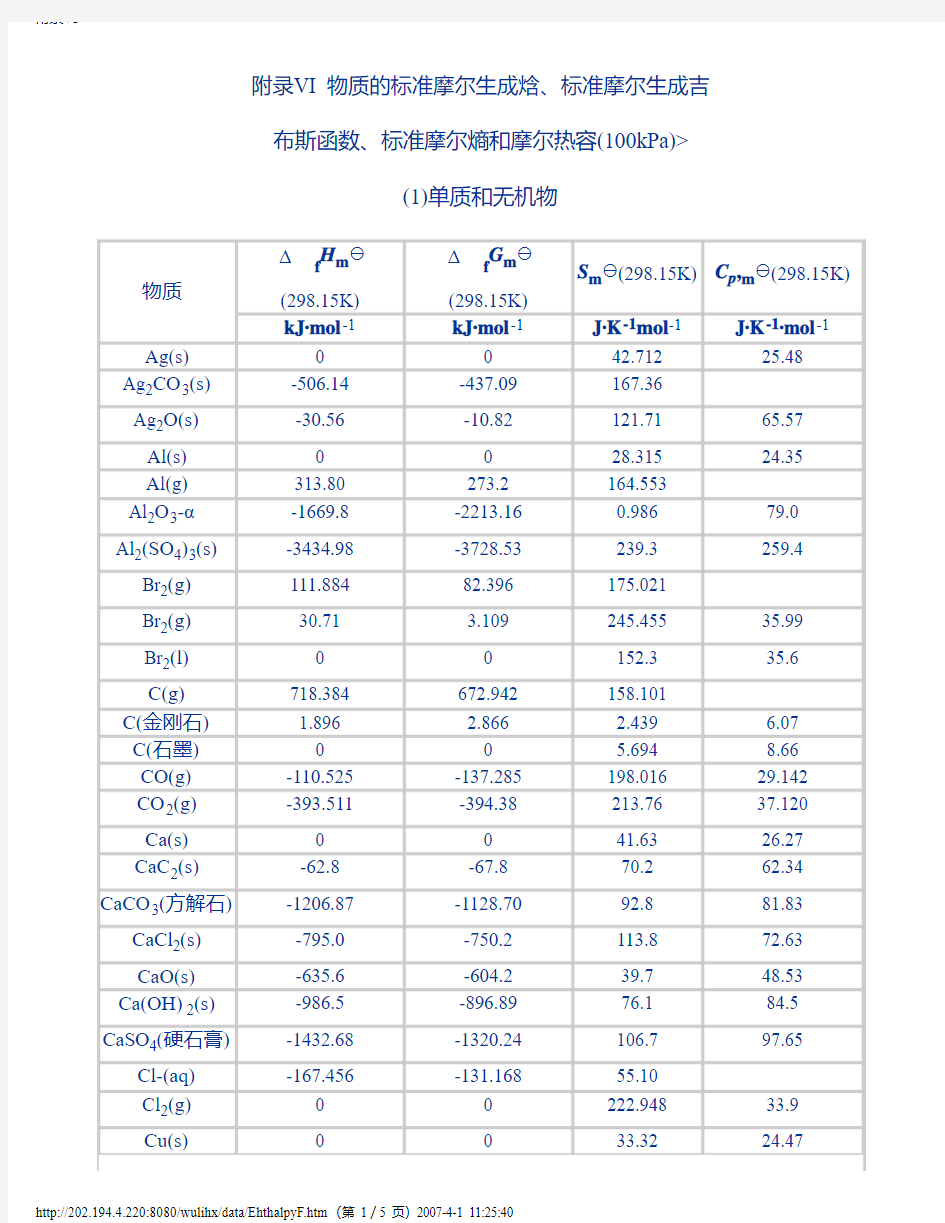

附录Ⅵ 物质的标准摩尔生成焓、标准摩尔生成吉布斯函数、标准摩尔熵和摩尔热容(100kPa)>
(1)单质和无机物
物质 Δ
f
H m y
(298.15K)
Δ
f
G m y
(298.15K)
S m y(298.15K)C p,m y(298.15K) kJ·mol-1kJ·mol-1J·K-1mol-1J·K-1·mol-1
Ag(s)0042.71225.48 Ag2CO3(s)-506.14-437.09167.36
Ag2O(s)-30.56-10.82121.7165.57 Al(s)0028.31524.35 Al(g)313.80273.2164.553
Al2O3-α-1669.8-2213.160.98679.0 Al2(SO4)3(s)-3434.98-3728.53239.3259.4 Br2(g)111.88482.396175.021
Br2(g)30.71 3.109245.45535.99 Br2(l)00152.335.6 C(g)718.384672.942158.101
C(金刚石) 1.896 2.866 2.439 6.07 C(石墨)00 5.6948.66 CO(g)-110.525-137.285198.01629.142 CO2(g)-393.511-394.38213.7637.120 Ca(s)0041.6326.27 CaC2(s)-62.8-67.870.262.34 CaCO3(方解石)-1206.87-1128.7092.881.83 CaCl2(s)-795.0-750.2113.872.63 CaO(s)-635.6-604.239.748.53 Ca(OH)2(s)-986.5-896.8976.184.5 CaSO4(硬石膏)-1432.68-1320.24106.797.65 Cl-(aq)-167.456-131.16855.10
Cl2(g)00222.94833.9 Cu(s)0033.3224.47
CuO(s)-155.2-127.143.5144.4 Cu2O-α-166.69-146.33100.869.8 F2(g)00203.531.46 Fe-α0027.1525.23 FeCO3(s)-747.68-673.8492.882.13 FeO(s)-266.52-244.354.051.1 Fe2O3(s)-822.1-741.090.0104.6 Fe3O4(s)-117.1-1014.1146.4143.42 H(g)217.94203.122114.72420.80 H2(g)00130.69528.83 D2(g)00144.88429.20 HBr(g)-36.24-53.22198.6029.12 HBr(aq)-120.92-102.8080.71
HCl(g)-92.311-95.265186.78629.12 HCl(aq)-167.44-131.1755.10
H2CO3(aq)-698.7-623.37191.2 Hl(g)-25.94-1.32206.4229.12 H2O(g)-241.825-228.577188.82333.571 H2O(l)-285.838-237.14269.94075.296 H2O(s)-291.850(-234.03)(39.4)
H2O2(l)-187.61-118.04102.2682.29 H2S(g)-20.146-33.040205.7533.97 H2SO4(l)-811.35(-866.4)156.85137.57 H2SO4(aq)-811.32
HSO4(aq)-885.75-752.99126.86
l2(g)00116.755.97 I2(g)62.24219.34260.6036.87 N2(g)00191.59829.12 NH3(g)-46.19-16.603192.6135.65 NO(g)89.86090.37210.30929.861 NO2(g)33.8551.86240.5737.90 N2O(g)81.55103.62220.1038.70 N2O4(g)9.66098.39304.4279.0
N2O5(g) 2.51110.5342.4108.0 O(g)247.521230.095161.06321.93 O2(g)00205.13829.37 O3(g)142.3163.45237.738.15 OH-(aq)-229.940-157.297-10.539
S(单斜)0.290.09632.5523.64 S(斜方)0031.922.60
(g)124.9476.08227.7632.55
S(g)222.80182.27167.825
SO2(g)-296.90-300.37248.6439.79 SO3(g)-395.18-370.40256.3450.70 SO42- (aq)-907.51-741.9017.2
(2)有机化合物
物质 Δ
f
H m y(298.15K) Δ
f
G m y(298.15K)S
m
y(298.15K)C p,m y(298.15K) kJ·mol-1kJ·mol-1J·K-1mol-1J·K-1·mol-1 烃 类
CH4(g), 甲烷-74.84750.827186.3035.715 C2H2(g), 乙炔226.748209.200200.92843.928 C2H4(g), 乙烯52.28368.157219.5643.56 C2H6(g),? 乙烷-84.667-32.821229.6052.650 C3H6(g), 丙烯20.41462.783267.0563.89 C3H6(g), 丙烷-103.847-23.391270.0273.51 C4H6(g), 1,3-丁二烯110.16150.74278.8579.54 C4H8(g), 1-丁烯-0.1371.60305.7185.65 C4H8(g), 顺-2-丁烯-6.9965.96300.9478.91 C4H8(g), 反-2-丁烯-11.1763.07296.5987.82 C4H8(g), 2-甲基两烯-16.9058.17293.7089.12 C4H10(g), 正丁烷-126.15-17.02310.2397.45 C4H10(g), 异丁烷-134.52-20.79294.7596.82
C6H6(g), 苯82.927129.723269.3181.67
C6H6(l), 苯49.028124.597172.35135.77
C6H12(g), 环己烷-123.1431.92298.51106.27
C6H14(g), 正己烷-167.19-0.09388.85143.09
C6H14(l), 正己烷-198.82-4.08295.89194.93
C6H5CH3(g),甲苯49.999122.388319.86103.76
C6H5CH3(l),甲苯11.995114.299219.58157.11
C6H4(CH2)(g)?邻二甲苯18.995122.207352.86133.26
C6H4(CH3)2(l), 邻二甲苯-24.439110.495246.48187.9
C6H4?(CH3)2(g),?间二甲苯17.238118.977357.80127.57
C6H(CH3)2(l), 间二甲苯-25.418107.817252.17183.3
C6H4(CH3)2(g),?对二甲苯17.949121.266352.53126.86
C6H4(CH3)2(l), 对二甲苯-24.426110.244247.36183.7
含 氧 化 合 物
HCOH(g), 甲醛-115.90-110.0220.235.36 HCOOH(g), 甲酸-362.63-335.69251.154.4 HCOOH(l), 甲酸-409.20-345.9128.9599.04 CH3OH(g), 甲醇-201.17-161.83237.849.4
CH3OH(l), 甲醇-238.57-166.15126.881.6
CH2COH(g), 乙醛-166.36-133.67265.862.8
CH3COOH(l), 乙酸-487.0-392.4159.8123.4
CH3COOH(g), 乙酸-436.4-381.5293.472.4
C2H5OH(l), 乙醇-277.63-174.36160.7111.46
C2HOH(g), 乙醇-235.31-168.54282.171.1
CH3COCH3(l),丙酮-248.283-155.33200.0124.73
CH3COCH3(g),丙酮-216.69-152.2296.0075.3
C2H5OC2H5(l),乙醚-273.2-116.47253.1
CH3COOC2H5(l), 乙酸乙酯-463.2-315.3259
C6H5COOH(s), 苯甲酸-384.55-245.5170.7155.2
卤 代 烃
CH3Cl(g), 氯甲烷-82.0-58.6234.2940.79
CH2Cl2(g), 二氯甲烷-88-59270.6251.38
CHCl3(l), 氯仿-131.8-71.4202.9116.3 CHCl3(g), 氯仿-100-67296.4865.81 CCl4(l), 四氯化碳-139.3-68.5214.43131.75 CCl4(g), 甲氯化碳-106.7-64.0309.4185.51 C6H5Cl(l), 氯苯116.3-198.2197.5145.6
含 氮 化 合 物
NH(CH3)2(g), 二甲胺-27.659.1273.269.37 C5H5N(l), 吡啶78.87159.9179.1
C6H5NH2(l), 苯胺35.31153.35191.6199.6 C6H5NO2,(l)硝基苯15.90146.36244.3
本附录数据主要取自Handbook of Chemistry and Physics, 70 th Ed., 1990; Editor John A.Dean,Lange's Handbook of Chemistry, 1967。
最全的物理化学名词解释 材料人考学 饱和蒸汽压:单位时间内有液体分子变为气体分子的数目与气体分子变为液体分子数目相同,宏观上说即液体的蒸发速度与气体的凝结速度相同的气体称为饱和蒸汽,饱和气体所具有的压力称为饱和蒸汽压。 敞开体系:体系与环境之间既有物质交换,又有能量交换。 封闭体系:体系与环境之间无物质交换,但有能量交换 孤立体系:体系与环境之间既无物质交换,又无能量交换,故又称为隔离体系。 广度量和强度量:是指与物质的数量成正比的性质,如系统物质的量,体积,热力学能,熵等。具有加和性,在数学上是一次齐函数,而是指与物质无关的性质,如温度压力等 平衡态:系统内部处于热平衡、力平衡、相平衡、化学平衡 状态函数:体系的一些性质,其数值仅取决于体系所处的状态,而与体系的历史无关;它的变化值仅取决于体系的始态和终态,而与变化的途径无关。具有这种特性的物理量称为状态函数。 热:体系与环境之间由于温度的不同而传递的能量称为热。 功:体系与环境之间传递的除热以外的其它能量都称为功。 摩尔相变焓:是指单位物质的量的物质在恒定温度T及该温度平衡压力下发生相变时对应的焓变 标准摩尔生成焓:在温度为T的标准态下,由稳定相态的单质生成化学计量数VB=1的β相态的化合物B 该生成反应的焓变称为该化合物B在温度T时的标准摩尔生成焓。 标准摩尔燃烧焓:在标准压力下,反应温度时,1摩尔反应物质B完全氧化成相同温度的指定产物时的标准摩尔反应焓。 可逆过程:我们把某一体系经过某一个过程,如果能使体系和环境都完全复原,则该过程称为“可逆过程”。 反应热当体系发生反应之后,使产物的温度回到反应前始态时的温度,体系放出或吸收的热量,称为该反应的热效应。 溶解热:在恒定的T、p下,单位物质的量的溶质B溶解与溶剂A中,形成B的摩尔分数xB=0.1的溶液时,过程的焓变。 稀释热:在恒定的T、p下,某溶剂中质量摩尔浓度b1的溶液用同样的溶剂稀释成为质量摩尔浓度b2的溶液时,所引起的每单位物质的量的溶质之焓变。 准静态过程:在过程进行的每一瞬间,体系都接近于平衡状态,以致在任意选取的短时间dt内,状态参量在整个系统的各部分都有确定的值,整个过程可以看成是由一系列极接近平衡的状态所构成。 卡诺循环:1恒温可逆膨胀2绝热可逆膨胀3恒温可逆压缩,4绝热可逆压缩 卡诺定理:在两个不同温度的热源之间工作的所有热机,以可逆热机效率最大 热力学基本方程:1dU=Tds—pdV 2dH=TdS+Vdp 3dA=-SdT-pdV 4dG=-SdT+Vdp(记忆方法见后)拉乌尔定律:稀溶液中溶剂的蒸汽压等于同一温度下纯溶剂的饱和蒸汽压与溶液中溶剂的摩尔分数的乘积PA=PA*xA 亨利定律:一般来说,气体在溶剂中的溶解度很小,所形成的溶液属于稀溶液范围。气体B 在溶剂A中溶液的组成无论是由B的摩尔分数XB,质量摩尔浓度bB,浓度cB等表示时,均与气体溶质B的压力近似成正比。 偏摩尔量:在温度、压力及除了组分B以外其余组分的物质的量均不变的条件下,广度量X 随组分B的物质的量nB变化率XB称为组分B的偏摩尔量。
第六节数据处理的基本方法 前面我们已经讨论了测量与误差的基本概念,测量结果的最佳值、误差和不确定度的计算。然而,我们进行实验的最终目的是为了通过数据的获得和处理,从中揭示出有关物理量的关系,或找出事物的内在规律性,或验证某种理论的正确性,或为以后的实验准备依据。因而,需要对所获得的数据进行正确的处理,数据处理贯穿于从获得原始数据到得出结论的整个实验过程。包括数据记录、整理、计算、作图、分析等方面涉及数据运算的处理方法。常用的数据处理方法有:列表法、图示法、图解法、逐差法和最小二乘线性拟合法等,下面分别予以简单讨论。 列表法是将实验所获得的数据用表格的形式进行排列的数据处理方法。列表法的作用有两种:一是记录实验数据,二是能显示出物理量间的对应关系。其优点是,能对大量的杂乱无章的数据进行归纳整理,使之既有条不紊,又简明醒目;既有助于表现物理量之间的关系,又便于及时地检查和发现实验数据是否合理,减少或避免测量错误;同时,也为作图法等处理数据奠定了基础。 用列表的方法记录和处理数据是一种良好的科学工作习惯,要设 计出一个栏目清楚、行列分明的表格,也需要在实验中不断训练,逐步掌握、熟练,并形成习惯。 一般来讲,在用列表法处理数据时,应遵从如下原则:
(1) 栏目条理清楚,简单明了,便于显示有关物理量的关系。 (2) 在栏目中,应给出有关物理量的符号,并标明单位(一般不重复写在每个数据的后面)。 (3) 填入表中的数字应是有效数字。 (4) 必要时需要加以注释说明。 例如,用螺旋测微计测量钢球直径的实验数据列表处理如下。 用螺旋测微计测量钢球直径的数据记录表 从表中,可计算出 D i D = n = 5.9967 ( mm)
物理化学实验Ⅰ 课程名称:物理化学实验Ⅰ 英文名称:Experiments in Physical Chemistry 课程代码:147012 学分:0.5 课程总学时:16 实验学时:16 (其中,上机学时:0) 课程性质:?必修□选修 是否独立设课:?是□否 课程类别:?基础实验□专业基础实验□专业领域实验 含有综合性、设计性实验:?是□否 面向专业:高分子材料科学与工程、材料科学与工程(无机非金属材料科学与工程、材料化学) 先修课程:物理、物理化学、无机化学实验、有机化学实验、分析化学实验等课程。 大纲编制人:课程负责人张震实验室负责人刘仕文 一、教学信息 教学的目标与任务: 该课程是本专业的一门重要的基础课程,物理化学实验的特点是利用物理方法来研究化学系统变化规律,是从事本专业相关工作必须掌握的基本技术课程。其任务是通过本课程的学习,使学生达到以下三方面的训练: (1)通过实验加深学生对物理化学原理的认识,培养学生理论联系实际的能力; (2)使学生学会常用的物理化学实验方法和测试技术,提高学生的实验操作能力和独立工作能力; (3)培养学生查阅手册、处理实验数据和撰写实验报告的能力,使学生受到初步的物理性质研究方法的训练。 教学基本要求: 物理化学实验的特点是利用物理方法来研究化学系统变化规律,实验中常用多种物理测量仪器。因此在物理化学实验教学中,应注意基本测量技术的训练及初步培养学生选择和配套仪器进行实验研究工作的能力。 物理化学实验包括下列内容: (1)热力学部分量热、相平衡和化学平衡实验是这部分的基本内容。还可以选择稀溶液的依数性、溶液组分的活度系数或热分析等方面的实验。
物化实验总结与心得 闽江学院化学与化学工程系120101202242 朱家林 时间过的很快,一个学期的物化实验已经结束了。经过一个学期的物化实验的学习,学到了很多专业知识和实验基本操作,以及很多做人做事的技巧和态度。物化实验是有用的,也是有趣的,物理化学实验涉及到了化学热力学、化学动力学、电化学、表面化学。一下,简单的回顾一下本学期的十四个物化实验。 实验一、燃烧热的测定 用氧弹卡计测定萘的燃烧热;了解恒压燃烧热与恒容燃烧热的区别;了解卡计中主要部分的作用。掌握卡计的实验技术;学会用雷诺图解法校正温度变化。热是一个很难测定的物理量,热量的传递往往表现为温度的改变。而温度却很容易测量。如果有一种仪器,已知它每升高一度所需的热量,那么,我们就可在这种仪器中进行燃烧反应,只要观察到所升高的温度就可知燃烧放出的热量。根据这一热量我们便可求出物质的燃烧热。试验中要注意:压片时应将Cu-Ni合金丝压入片内;氧弹充完氧后一定要检查确信其不漏气,并用万用表检查两极间是否通路;将氧弹放入量热仪前,一定要先检查点火控制键是否位于“关”的位置。点火结束后,应立即将其关上。氧弹充氧的操作过程中,人应站在侧面,以免意外情况下弹盖或阀门向上冲出,发生危险。 实验二、液体饱和蒸汽压的测定 明确纯液体饱和蒸气压的定义和气液两相平衡的概念,深入了解纯液体饱和蒸气压和温度的关系棗克劳修斯-克拉贝龙方程式;用等压计测定不同温度下苯的饱和蒸气压。初步掌握真空实验技术;学会用图解法求被测液体在实验温度范围内的平均摩尔气化热与正常沸点。测定前必须将平衡管a,b段的空气驱赶净。冷却速度不应太快,否则测得的温度将偏离平衡温度。如果实验过程中,空气倒灌,则实验必须重做。在停止实验时,应该缓慢地先将三通活塞打开,使系统通大气,再使抽气泵通大气(防止泵中油倒灌),然后切断电源,最后关闭冷却水,使装置复原
《物理化学》(下) (南京大学第五版)总结 第八章 电解质溶液 一、基本概念与定义 1. 离子迁移数t 电解质溶液导电时,溶液中的i 离子运载的电流I i 与总电流之比(即i 离子所承担的导电任务的分数)。 1i i i i i i i i Q I u t t Q I u = ===∑∑ 2. 离子电迁移率(离子淌度)u i :单位电位梯度时离子的运动速率。 3. 电导与电导率 电导G(Ω-1 ):电阻R 的倒数。a 电导率κ(Ω-1 ·m -1 ):电阻率ρ的倒数。 电导池常数K cell :K cell = L/A L: 电极之间的距离;A:电极的面积 4. 摩尔电导率Λm (S ·m 2 ·mol -1 ) 含1mol 电解质的溶液置于相距单位距离的2个平行电极之间的电导池所具有的电导。 m c κ Λ= 5.电解质的平均活度和平均活度因子 对于任意价型的强电解质M ν+B ν- 平均活度因子 γ± =[ (γ+)ν+ (γ-)ν-] 1/(ν + + ν- ) a ± = m ±γ± m ± =[ (m +)ν+ (m -)ν-] 1/(ν + + ν- ) m + = ν+m ;m - = ν-m 电解质活度a = (a ±)( ν+ + ν- ) 6. 离子强度I 21 2i i i I m z = ∑ 7. 离子氛 电解质溶液中环绕在某一离子B 周围电荷与B 相反、电荷数量与B 相等的异号离子构成的球体。 8. 基本摩尔单元 发生1mol 电子转移电极反应的物质的量1/zM n+ + e → 1/z M 二、基本公式 1. Faraday 电解定律 往电解池通电,在电极上发生化学反应的物质的量与通入的电量成正比。 Q = It = znF z :电极反应M n+ + ze → M 中电子转移的计量数。
《大学化学基础实验2》实验报告 课程:物理化学实验 专业:环境科学 班级: 学号: 学生姓名:邓丁 指导教师:谭蕾 实验日期:5月24日
实验一、溶解焓的测定 一、实验名称:溶解焓的测定。 二、目的要求:(1)学会用量热法测定盐类的积分溶解焓。 (2)掌握作图外推法求真实温差的方法。 三、基本原理: 盐类的溶解通常包含两个同时进行的过程:一是晶格的破坏,为吸热过程;二是离子的溶剂化,即离子的水合作用,为放热过程。溶解焓则是这两个过程热效应的总和,因此,盐类的溶解过程最终是吸热还是放热,是由这两个热效应的相应大小所决定的。影响溶解焓的主要因素有温度、压力、溶质的性质以及用量等。热平衡式: △sol H m=-[(m1C1+m2C2)+C]△TM/m2 式中, sol H m 为盐在溶液温度及浓度下的积分溶解焓, J·mol , m1 , m2 分别为水和溶质的质量, M 为溶质的摩尔质量,kg·mol -1 ;C1 ,C 2 分别为溶剂水, kg; 溶质的比热容,J·kg -1;T 为溶解过程中的真实温差,K;C 为量热计的热容, J·K- 1 ,也称热量计常数.本实验通过测定已知积分溶解焓的标准物质 KCl 的 T ,标定出量热计热容 C 的值. 四、实验主要仪器名称: NDRH-2S型溶解焓测定实验装置1套(包括数字式温度温差测量仪1台、300mL简单量热计1只、电磁搅拌器1台);250mL容量瓶1个;秒表1快;电子 ;蒸馏水 天平1台;KCl;KNO 3 五、实验步骤: (1)量热计热容 C 的测定 ( 1 ) 将仪器打开 , 预热 . 准确称量 5.147g 研磨好的 KCl , 待用 . n KCl : n水 = 1: 200 (2)在干净并干燥的量热计中准确放入 250mL 温室下的蒸馏水,然后将温度传感器的探头插入量热计的液体中.打开搅拌器开关,保持一定的搅拌速度,待温差变化基本稳定后,读取水的温度 T1 ,作为基温. (3)同时, 每隔30s就记录一次温差值,连续记录8 次后, 将称量好的 5.174g KCl 经漏斗全部迅速倒入量热计中,盖好.10s记录一次温度值,至温度基本稳定不变,再每隔 30s记录一次温度的数值,记录 8 次即可停止. (4)测出量热计中溶液的温度,记作 T2 .计算 T1 , T2 平均值,作为体系的温度.倒出溶液,取出搅拌子,用蒸馏水洗净量热计. KNO3 熔解热的测定:标准称量 3.513g KNO3 ,代替 KCl 重复上述操作.
实验数据处理基本方法 实验必须采集大量数据,数据处理是指从获得数据开始到得出最后结 论的整个加工过程,它包括数据记录、整理、计算与分析等,从而寻找出 测量对象的内在规律,正确地给出实验结果。因此,数据处理是实验工作 不可缺少的一部分。数据处理涉及的内容很多,这里只介绍常用的四种方 法。 1列表法 对一个物理量进行多次测量,或者测量几个量之间的函数关系,往往 借助于列表法把实验数据列成表格。其优点是,使大量数据表达清晰醒目, 条理化,易于检查数据和发现问题,避免差错,同时有助于反映出物理量 之间的对应关系。所以,设计一个简明醒目、合理美观的数据表格,是每 一个同学都要掌握的基本技能。 列表没有统一的格式,但所设计的表格要能充分反映上述优点,应注意以下几点:1.各栏目均应注明所记录的物理量的名称(符号 )和单位; 2.栏目的顺序应充分注意数据间的联系和计算顺序,力求简明、齐全、有条理; 3.表中的原始测量数据应正确反映有效数字,数据不应随便涂改,确实要修改数据时, 应将原来数据画条杠以备随时查验; 4.对于函数关系的数据表格,应按自变量由小到大或由大到小的顺序排列,以便于判 断和处理。 2图解法 图线能够明显地表示出实验数据间的关系,并且通过它可以找出两个 量之间的数学关系,因此图解法是实验数据处理的重要方法之一。图解法 处理数据,首先要画出合乎规范的图线,其要点如下: 1.选择图纸作图纸有直角坐标纸 ( 即毫米方格纸 ) 、对数坐标纸和 极坐标纸等,根据 作图需要选择。在物理实验中比较常用的是毫米方格纸,其规格多为17 25 cm 。 2.曲线改直由于直线最易描绘 , 且直线方程的两个参数 ( 斜率和截距 ) 也较易算得。所以对于两个变量之间的函数关系是非线性的情形,在用图解法时 应尽可能通过变量代换 将非线性的函数曲线转变为线性函数的直线。下面为几种常用的变换方法。 ( 1) xy c ( c 为常数 ) 。 令 z 1,则 y cz,即 y 与 z 为线性关系。 x ( 2) x c y ( c 为常x2,y 1 z ,即 y 与为线性关系。
物理化学实验数据处理 实验一 电极的制备及电池电动势的测定与应用 一、实验数据记录 二、数据处理 1饱和甘汞电极电动势的温度校正 )298/(1061.72415.0/4-?-=-K T V SCE ? 15.273+=t T t 组成饱和甘汞电极的KCl 溶液的温度,℃。 2测定温度下锌、铜电极电动势的计算 1) 测定温度下锌电极电势的计算 Zn Zn SCE Hg Zn E /2)(+-=-??平均值 )(/2平均值Hg Zn SCE Zn Zn E --=∴+?? 2) 测定温度下铜电极电势的计算 SCE Cu Cu Hg Cu E ??-=+-/2)(平均值 S C E Hg Cu Cu Cu E ??+=∴-+)(/2平均值 3) 测定温度下标准锌电极电极电势的计算 ++ + +±++=+=2222ln 2)(ln 2/2//Zn Zn Zn Zn Zn Zn Zn m F RT Zn F RT γ?α??θ θ +++ ±-=∴222ln 2//Zn Zn Zn Zn Zn m F RT γ??θ(±γ参见附录五表V-5-30,11.02-?=+l mol m Zn ) 4) 测定温度下标准铜电极电极电势的计算 ++ + +±++=+=2222ln 2)(ln 2/2//Cu Cu Cu Cu Cu Cu Cu m F RT Cu F RT γ?α??θ θ +++ ±-=∴222ln 2//Cu Cu Cu Cu Cu m F RT γ??θ(±γ参见附录五表V-5-30,11.02-?=+l mol m Cu ) 2 298K 时锌、铜电极标准电极电势的计算 1)锌电极标准电极电势的计算 )298/(000016.0)298(/)(//22-?-=+ +K T K V T Zn Zn Zn Zn θθ?? )298/(000016.0/)()298(//22-?+=∴++ K T V T K Zn Zn Zn Zn θ θ?? 1)铜电极标准电极电势的计算 2 6//)298/(1031.0)298/(0001.0)298(/)(22-?+-?+=-+ +K T K T K V T Cu Cu Cu Cu θθ?? 2 6//)298/(1031.0)298/(0001.0)()298(22-?+-?-=∴-+ +K T K T T K Cu Cu Cu Cu θθ?? 15.273+=t T t 组成相应电极的电解质溶液的温度,℃。
图1 量热氧弹 实验四 燃烧焓的测定 冷向星 2010011976 材03班(同组实验者:琦) 实验日期:2012-4-5 带实验的老师:春 1 引言 有机化合物的生成焓难以直接从实验中测定,然而有机化合物易于燃烧,含碳、氢和氧等三种元素的有机化合物完全燃烧时生成二氧化碳和水。从有机化合物燃烧的热效应数据也可以估算反应热效应。 通常燃烧焓在等容条件下测定(即称为“氧弹”的不锈钢容器中燃烧),所得数据为值,经换算后可得出值。 1.1实验目的 1.使用弹式量热计测定萘的燃烧焓。 2.了解量热计的原理和构造,掌握其使用方法。 3.掌握热敏电阻测温的实验技术。 1.2实验原理 当产物的温度与反应物的温度相同,在反应过程中只做体积功而不做其它功时,化学反应吸收或放出的热量,称为此过程的热效应,通常亦称为“反应热”。热化学中定义:在指定温度和压力下,一摩尔物质完全燃烧成指定产物的焓变,称为该物质在此温度下的摩尔燃烧焓,记作ΔC H m 。通常,C 、H 等元素的燃烧产物分别为CO 2(g)、H 2O(l)等。由于上述条件下ΔH=Q p ,因此ΔC H m 也就是该物质燃烧反应的等压热效应Q p 。 在实际测量中,燃烧反应常在恒容条件下进行(如在弹式量热计中进行),这样直接测得的是反应的恒容热效应Q V (即燃烧反应的摩尔燃烧能变ΔC U m )。若反应系统中的气体物质均可视为理想气体,根据热力学推导,ΔC H m 和ΔC U m 的关系为: p V Q Q nRT =+? (1) 测量热效应的仪器称作量热计,量热计的种类很多,一般测量燃烧焓用弹式量热计。本实验是用氧弹式量热计进行萘的燃烧焓的测定,结构如图1。实验过程中外水套保持恒温,水桶与外水套之间以空气隔热。同时,还把水桶的外表面进行了电抛光。这样,水桶连同其中的氧弹、测温器件、搅拌器和水便近似构成了一 个绝热系统。 将待测燃烧物质装入氧弹中,充入足够的氧气。氧弹放入装有一定量 水的桶中,盖好外桶盖。以电控部分各开关控制搅拌并实现燃烧点火,用 热敏电阻作为测温元件,用电子自动平衡记录仪连续记录桶水温度的变化。 当某样品连同辅助物质棉线、金属丝燃烧后,下式成立:
实验数据处理的几种方法 物理实验中测量得到的许多数据需要处理后才能表示测量的最终结果。对实验数据进行记录、整理、计算、分析、拟合等,从中获得实验结果和寻找物理量变化规律或经验公式的过程就是数据处理。它是实验方法的一个重要组成部分,是实验课的基本训练内容。本章主要介绍列表法、作图法、图解法、逐差法和最小二乘法。 1.4.1 列表法 列表法就是将一组实验数据和计算的中间数据依据一定的形式和顺序列成表格。列表法可以简单明确地表示出物理量之间的对应关系,便于分析和发现资料的规律性,也有助于检查和发现实验中的问题,这就是列表法的优点。设计记录表格时要做到:(1)表格设计要合理,以利于记录、检查、运算和分析。 (2)表格中涉及的各物理量,其符号、单位及量值的数量级均要表示清楚。但不要把单位写在数字后。 (3)表中数据要正确反映测量结果的有效数字和不确定度。列入表中的除原始数据外,计算过程中的一些中间结果和最后结果也可以列入表中。 (4)表格要加上必要的说明。实验室所给的数据或查得的单项数据应列在表格的上部,说明写在表格的下部。 1.4.2 作图法 作图法是在坐标纸上用图线表示物理量之间的关系,揭示物理量之间的联系。作图法既有简明、形象、直观、便于比较研究实验结果等优点,它是一种最常用的数据处理方法。 作图法的基本规则是: (1)根据函数关系选择适当的坐标纸(如直角坐标纸,单对数坐标纸,双对数坐标纸,极坐标纸等)和比例,画出坐标轴,标明物理量符号、单位和刻度值,并写明测试条件。 (2)坐标的原点不一定是变量的零点,可根据测试范围加以选择。,坐标分格最好使最低数字的一个单位可靠数与坐标最小分度相当。纵横坐标比例要恰当,以使图线居中。 (3)描点和连线。根据测量数据,用直尺和笔尖使其函数对应的实验点准确地落在相应的位置。一张图纸上画上几条实验曲线时,每条图线应用不同的标记如“+”、“×”、“·”、“Δ”等符号标出,以免混淆。连线时,要顾及到数据点,使曲线呈光滑曲线(含直线),并使数据点均匀分布在曲线(直线)的两侧,且尽量贴近曲线。个别偏离过大的点要重新审核,属过失误差的应剔去。 (4)标明图名,即做好实验图线后,应在图纸下方或空白的明显位置处,写上图的名称、作者和作图日期,有时还要附上简单的说明,如实验条件等,使读者一目了然。作图时,一般将纵轴代表的物理量写在前面,横轴代表的物理量写在后面,中间用“~”
特色训练9化学实验数据的分析、处理专题训练1.(2013·苏州检测)某化学兴趣小组用如图装置进行“市售锌粒和硫酸反应制取氢气的条件选择”的探究:当B中的化学反应趋于平稳后,每间隔一分钟收集一次氢气。不同条件下,每分钟收集到氢气的体积如下表: 请回答: (1)关闭K2、打开K1,观察到________,说明B中反应达到平稳。 (2)实验1、2是对比实验,分析上表,说明该对比实验的目的是____________ ____________________________________________________________。 (3)细口瓶C的容积为V(mL),为了使加入的锌(质量b g)不浪费,在C中还留有2 5 的水时,则V=________[与b的代数关系式,气体摩尔体积是 V m(mL·mol-1)]。 (4)实验4是探究饱和硫酸铜溶液的体积对实验的影响,a值应为________(填选项)。
A.20 B.30 C.27 D.40 (5)分析上表,市售锌粒和硫酸反应制取氢气的条件应该选择实验________(填实验序号)。 (6)从实验后的废液中回收皓矾(ZnSO4·7H2O)所需的实验操作步骤是________、蒸发浓缩、________、过滤、洗涤、晾干。 (7)查资料得知:Cu++Cl-===CuCl↓。湿法冶锌工艺中,硫酸锌溶液中常含有少量的氯离子,往其中加硫酸铜溶液和金属锌,可除去氯离子,其离子反应方程式是______________________________________________________ __ _________________________________________________________________。 解析(1)装置B中硫酸与锌反应制备氢气,关闭K2,打开K1,则生成的氢气进入装置A中,当烧杯中逸出的气泡均匀时表明B中生成氢气的反应达到平稳。(3)Zn与硫酸反应制备氢气的化学方程式中,Zn和H2的系数相同,故 b g÷65 g〃mol-1=3 5V÷V m,即V= bV m 39。(4)对比实验2、实验3和实验4的 第1分钟、第2分钟、第3分钟收集的气体体积,相同时间内实验4收集的气体比实验2多,但比实验3少。为了测定饱和硫酸铜溶液的体积对实验的影响,需要固定硫酸的浓度,该硫酸浓度应为30%。(5)实验3反应速率最大,故应该选择实验3的条件。(6)反应后的废液中往往含有不溶解的物质,故先过滤,除去不溶物,然后蒸发浓缩、冷却结晶,再过滤、洗涤、晾干即得皓矾。 答案(1)A中均匀(或连续)地冒出气泡 (2)探究滴加0.5 mL的饱和硫酸铜溶液对生成氢气速率的影响(或其他合理答案) (3)bV m 39(或0.025bV m,0.025 6bV m) (4)B (5)3 (6)过滤冷却结晶 (7)Zn+2Cu2++2Cl-===2CuCl+Zn2+ 2.(2013·安庆质检)为测定草酸晶体(H2C2O4·x H2O)的组成(即x的值)进行下述实验:
物理化学公式集合 kent 第一章 热力学第一定律 一、基本概念 系统与环境,状态与状态函数,广度性质与强度性质,过程与途径,热与功,内能与焓。 二、基本定律 热力学第一定律:ΔU =Q +W 。 焦耳实验:ΔU =f (T ) ; ΔH =f (T ) 三、基本关系式 1、体积功的计算 δW = -p e d V 恒外压过程:W = -p e ΔV 可逆过程: W =nRT { EMBED Equation.3 |1221ln ln p p nRT V V 2、热效应、焓 等容热:Q V =ΔU (封闭系统不作其他功) 等压热:Q p =ΔH (封闭系统不作其他功) 焓的定义:H =U +pV ;
d H=d U+d(pV) 焓与温度的关系:ΔH= 3、等压热容与等容热容 热容定义:; 定压热容与定容热容的关系: 热容与温度的关系:C p=a+bT+c’T2 四、第一定律的应用 1、理想气体状态变化 等温过程:ΔU=0 ; ΔH=0 ; W=-Q=p e d V 等容过程:W=0 ; Q=ΔU= ; ΔH= 等压过程:W=-p eΔV ; Q=ΔH= ; ΔU= 可逆绝热过程: Q=0 ; 利用p1V1γ=p2V2γ求出T2, W=ΔU=;ΔH= 不可逆绝热过程:Q=0 ; 利用C V(T2-T1)=-p e(V2-V1)求出T2, W=ΔU=;ΔH= 2、相变化 可逆相变化:ΔH=Q=nΔ_H; W=-p(V2-V1)=-pV g=-nRT; ΔU=Q+W 3、热化学
物质的标准态;热化学方程式;盖斯定律;标准摩尔生成焓。 摩尔反应热的求算: 反应热与温度的关系—基尔霍夫定律: 。 第二章热力学第二定律 一、基本概念 自发过程与非自发过程 二、热力学第二定律 1、热力学第二定律的经典表述 克劳修斯,开尔文,奥斯瓦尔德。实质:热功转换的不可逆性。 2、热力学第二定律的数学表达式(克劳修斯不等式) “=”可逆;“>”不可逆 三、熵 1、熵的导出:卡若循环与卡诺定理 2、熵的定义: 3、熵的物理意义:系统混乱度的量度。 4、绝对熵:热力学第三定律 5、熵变的计算
有效数字 1、有效数字不同的数相加减时,以参加运算各量中有效数字最末一位位数最高的为准,最后结果与它对其,余下的尾数按舍入规则处理。 2、乘除法以参与运算的数值中有效位数最少的那个数为准,但当结果的第1位数较小,比如1、2、3时可以多保留一位(较小:结果的第一位数小于 有效数字最少的结果第一位数)! 例如:n=tg56° θ=56° d θ=1° θθθθθ2cos d d d dtg dn == 为保留) (,带入848.156n 15605.018056cos 1cos 22=?=∴?=??=≈?=?= ?tg n θθπθθ 3、可以数字只出现在最末一位:对函数运算以不损失有效数字为准。 例如:20*lg63.4 可疑最小位变化0.1 Y=20lgx 01.04 .631.010ln 2010ln 20ln 10ln 20≈===x dx dx dx x d dy 04.364.63lg 20=∴ 4、原始数据记录、测量结果最后表示,严格按有效数字规定处理。(中间过程、结果多算几次) 5、4舍5入6凑偶 6、不估计不确定度时,有效数字按相应运算法则取位;计算不确定度时以不确定度的处理结果为准。 真值和误差 1、 误差=测量值-真值 ΔN=N-A 2、 误差既有大小、方向与政府。 3、 通常真值和误差都是未知的。 4、 相对约定真值,误差可以求出。 5、 用相对误差比较测量结果的准确度。 6、 ΔN/A ≈ΔN/N 7、 系统误差、随机误差、粗大误差 8、 随机误差:统计意义下的分布规律。粗大误差:测量错误 9、 系统误差和随机误差在一定条件下相互转化。 不确定度 1、P (x )是概率密度函数 dx P dx x x P p )x (之间的概率是测量结果落在+当x 取遍所有可能的概率值为1. 2、正态分布且消除了系统误差,概率最大的位置是真值A 3、曲线“胖”精密度低“瘦”精密度高。 4、标准误差:无限次测量?∞∞-=-2 )()(dx X P A X x )(σ 有限次测量且真值不知道标准偏
2. 不稳定常数的测定 在络合物明显解离的情形下,用等摩尔系列法得到图2中的曲线,并作切线交于N 点。 设在N 点的光密度为D 0,曲线2极大的光密度为D ,则络合物的解离度α为: 对于MA 型络合物的 ,故将该络合物浓度c 及上面求出的α代入此式即可算出不稳定常数。 数据处理 2. 络合物不稳定常数的计算 在△D- 图上通过 为0和1.0处分别作曲线的切线,两切线交于一点,从 图上找到该点相应的光密度D 0以及曲线上极大点的光密度D ,由D 0和D 计算解离度α。 最后计算该络合物的不稳定常数 K 不稳文献值为2*10-3。 解: 从△D- 图上可以得到: D 0=0.382, D max = 0.264 则可求得解离度α: =0.50 得 =解离部分总浓度=总浓度络合物浓度总浓度D D 0=D 0ααK 不稳=c α21c M c M c A =D D 0=D 0 α=0.3820.3090.3820.264c M c M c A c M c M c A D D 0=D 0αc M c M c A αK 不稳=c α21
c A = c M 又知: c A + c M = 0.038 (mol ?L -1 ) 得 c A = c M = 0.019 (mol ?L -1 ) ∴ c MA = 0.019 (mol ?L -1 ),即c= 0.019 (mol ?L -1 ) 3. 络合反应标准自由能变化的计算 利用△G ? = - RT ln1/K 不稳计算该络合反应的标准自由能变化。 △G ? = - RT ln1/K 不稳 = -8.314*(273.15+22.5)*ln1/(2.63*10-3) = -1.46*104 (J ?mol -1) 原电池电动势数据处理 Ⅴ、数据记录(实验测试数据) E 1 = 1.11810 V (Zn-Cu 电池) E 2 = 1.07110 V (Zn-Hg 电池) E 3 = 0.04470 V (Cu-Hg 电池) Ⅵ、数据处理 1、 饱和甘汞电极的电极电势温度校正公式,计算实验温度时饱和甘汞电极的电极电势: )298/(1061.72415.0/4-?-=-K T V ? = 0.2415 - 7.61×10 –4(292 – 298) = 0.24607 V 2、 据测定的各电池的电动势,分别计算铜、锌电极的T ?、T θ?、298θ ?。 (1) 求 T ?: V E K Hg Cl Hg Cu Cu 29077.024607.004470.0)292(/3/222=+=+=+?? V E K Hg Cl Hg Zn Zn 82503.007110.124607.0)292(2//222-=-=-=+?? (2) 求T θ ?: αK 不稳=c α21= 0.019*0.309210.309= 0.019*0.0955 0.691=2.63*10 -3
第二章 热力学第一定律 内容摘要 ?热力学第一定律表述 ?热力学第一定律在简单变化中的应用 ?热力学第一定律在相变化中的应用 ?热力学第一定律在化学变化中的应用 一、热力学第一定律表述 U Q W ?=+ d U Q W δδ=+ 适用条件:封闭系统的任何热力学过程 说明:1、amb W p dV W '=-+? 2、U 是状态函数,是广度量 W 、Q 是途径函数 二、热力学第一定律在简单变化中的应用----常用公式及基础公式 2、基础公式 热容 C p .m =a+bT+cT 2 (附录八) ● 液固系统----Cp.m=Cv.m ● 理想气体----Cp.m-Cv.m=R ● 单原子: Cp.m=5R/2 ● 双原子: Cp.m=7R/2 ● Cp.m / Cv.m=γ 理想气体 ? 状态方程 pV=nRT
? 过程方程 恒温:1122p V p V = ? 恒压: 1122//V T V T = ? 恒容: 1122/ / p T p T = ? 绝热可逆: 1122 p V p V γγ= 111122 T p T p γγγγ--= 1111 22 TV T V γγ--= 三、热力学第一定律在相变化中的应用----可逆相变化与不可逆相变化过程 1、 可逆相变化 Q p =n Δ 相变 H m W = -p ΔV 无气体存在: W = 0 有气体相,只需考虑气体,且视为理想气体 ΔU = n Δ 相变 H m - p ΔV 2、相变焓基础数据及相互关系 Δ 冷凝H m (T) = -Δ蒸发H m (T) Δ凝固H m (T) = -Δ熔化H m (T) Δ 凝华 H m (T) = -Δ 升华 H m (T) (有关手册提供的通常为可逆相变焓) 3、不可逆相变化 Δ 相变 H m (T 2) = Δ 相变 H m (T 1) +∫Σ(νB C p.m )dT 解题要点: 1.判断过程是否可逆; 2.过程设计,必须包含能获得摩尔相变焓的可逆相变化步骤; 3.除可逆相变化,其余步骤均为简单变化计算. 4.逐步计算后加和。 四、热力学第一定律在化学变化中的应用 1、基础数据 标准摩尔生成焓 Δf H θm,B (T) (附录九) 标准摩尔燃烧焓 Δc H θ m.B (T)(附录十) 2、基本公式 ?反应进度 ξ=△ξ= △n B /νB = (n B -n B.0) /νB ?由标准摩尔生成焓计算标准摩尔反应焓 Δr H θm.B (T)= ΣνB Δf H θ m.B (T) ?由标准摩尔燃烧焓计算标准摩尔反应焓 Δr H θ m.B (T)=-Σ νB Δc H θ m.B (T) (摩尔焓---- ξ=1时的相应焓值) ?恒容反应热与恒压反应热的关系 Q p =Δr H Q v =Δr U Δr H =Δr U + RT ΣνB (g) ?Kirchhoff 公式 微分式 d Δr H θ m (T) / dT=Δr C p.m 积分式 Δr H θm (T 2) = Δr H θ m (T 1)+∫Σ(νB C p.m )dT 本章课后作业: 教材p.91-96(3、4、10、11、16、17、38、20、23、24、28、30、33、34)
第二章 热力学第一定律 一、基本概念 系统与环境,状态与状态函数,广度性质与强度性质,过程与途径,热与功,内能与焓。 二、基本定律 热力学第一定律:ΔU =Q +W 。 焦耳实验:ΔU =f (T ) ; ΔH =f (T ) 三、基本关系式 1、体积功的计算 δW = -p e d V 恒外压过程:W = -p e ΔV 可逆过程:12 21ln ln p p nRT V V nRT W == 2、热效应、焓 等容热:Q V =ΔU (封闭系统不作其他功) 等压热:Q p =ΔH (封闭系统不作其他功) 焓的定义:H =U +pV ; d H =d U +d(pV ) 焓与温度的关系:ΔH =?2 1 d p T T T C 3、等压热容与等容热容 热容定义:V V )(T U C ??=;p p )(T H C ??=
定压热容与定容热容的关系:nR C C =-V p 热容与温度的关系:C p =a +bT +c’T 2 四、第一定律的应用 1、理想气体状态变化 等温过程:ΔU =0 ; ΔH =0 ; W =-Q =?-p e d V 等容过程:W =0 ; Q =ΔU =?T C d V ; ΔH =?T C d p 等压过程:W =-p e ΔV ; Q =ΔH =?T C d p ; ΔU =?T C d V 可逆绝热过程:Q =0 ; 利用p 1V 1γ=p 2V 2γ 求出T 2, W =ΔU =?T C d V ;ΔH =?T C d p 不可逆绝热过程: Q =0 ; 利用C V (T 2-T 1)=-p e (V 2-V 1)求出T 2, W =ΔU =?T C d V ;ΔH =?T C d p 2、相变化 可逆相变化:ΔH =Q =n Δ_H ; W=-p (V 2-V 1)=-pV g =-nRT ; ΔU =Q +W 3、热化学 物质的标准态;热化学方程式;盖斯定律;标准摩尔生成焓。 摩尔反应热的求算:)298,()298(B H H m f B m r θθν?=?∑
1.4 实验数据处理的几种方法 物理实验中测量得到的许多数据需要处理后才能表示测量的最终结果。对实验数据进行记录、整理、计算、分析、拟合等,从中获得实验结果和寻找物理量变化规律或经验公式的过程就是数据处理。它是实验方法的一个重要组成部分,是实验课的基本训练内容。本章主要介绍列表法、作图法、图解法、逐差法和最小二乘法。 1.4.1 列表法 列表法就是将一组实验数据和计算的中间数据依据一定的形式和顺序列成表格。列表法可以简单明确地表示出物理量之间的对应关系,便于分析和发现资料的规律性,也有助于检查和发现实验中的问题,这就是列表法的优点。设计记录表格时要做到:(1)表格设计要合理,以利于记录、检查、运算和分析。 (2)表格中涉及的各物理量,其符号、单位及量值的数量级均要表示清楚。但不要把单位写在数字后。 (3)表中数据要正确反映测量结果的有效数字和不确定度。列入表中的除原始数据外,计算过程中的一些中间结果和最后结果也可以列入表中。 (4)表格要加上必要的说明。实验室所给的数据或查得的单项数据应列在表格的上部,说明写在表格的下部。 1.4.2 作图法 作图法是在坐标纸上用图线表示物理量之间的关系,揭示物理量之间的联系。作图法既有简明、形象、直观、便于比较研究实验结果等优点,它是一种最常用的数据处理方法。 作图法的基本规则是: (1)根据函数关系选择适当的坐标纸(如直角坐标纸,单对数坐标纸,双对数坐标纸,极坐标纸等)和比例,画出坐标轴,标明物理量符号、单位和刻度值,并写明测试条件。 (2)坐标的原点不一定是变量的零点,可根据测试范围加以选择。,坐标分格最好使最低数字的一个单位可靠数与坐标最小分度相当。纵横坐标比例要恰当,以使图线居中。 (3)描点和连线。根据测量数据,用直尺和笔尖使其函数对应的实验点准确地落在相应的位置。一张图纸上画上几条实验曲线时,每条图线应用不同的标记如“+”、“×”、“·”、“Δ”等符号标出,以免混淆。连线时,要顾及到数据点,使曲线呈光滑曲线(含直线),并使数据点均匀分布在曲线(直线)的两侧,且尽量贴近曲线。个别偏离过大的点要重新审核,属过失误差的应剔去。 (4)标明图名,即做好实验图线后,应在图纸下方或空白的明显位置处,写上图的名称、作者和作图日期,有时还要附上简单的说明,如实验条件等,使读者一目了然。
实验数据处理的基本方法 数据处理是物理实验报告的重要组成部分,其包含的内容十分丰富,例如数据的记录、函数图线的描绘,从实验数据中提取测量结果的不确定度信息,验证和寻找物理规律等。本节介绍物理实验中一些常用的数据处理方法。 1列表法 将实验数据按一定规律用列表方式表达出来是记录和处理实验数据最常用的方法。表格的设计要求对应关系清楚、简单明了、有利于发现相关量之间的物理关系;此外还要求在标题栏中注明物理量名称、符号、数量级和单位等;根据需要还可以列出除原始数据以外的计算栏目和统计栏目等。最后还要求写明表格名称、主要测量仪器的型号、量程和准确度等级、有关环境条件参数如温度、湿度等。 本课程中的许多实验已列出数据表格可供参考,有一些实验的数据表格需要自己设计,表1.7—1是一个数据表格的实例,供参考。 表1.7—1数据表格实例 杨氏模量实验增减砝码时,相应的镜尺读数 2作图法
作图法可以最醒目地表达物理量间的变化关系。从图线上还可以简便求出实验需要的某些结果(如直线的斜率和截距值等),读出没有进行观测的对应点(内插法),或在一定条件下从图线的延伸部分读到测量范围以外的对应点(外推法)。此外,还可以把某些复杂的函数关系,通过一定的变换用直线图表示出来。例如半导体热敏电阻的电阻与温度关系为,取对数后得到 ,若用半对数坐标纸,以lgR为纵轴,以1/T为横轴画图,则为一条直线。 要特别注意的是,实验作图不是示意图,而是用图来表达实验中得到的物理量间的关系,同 时还要反映出测量的准确程度,所以必须满足一定的作图要求。 1)作图要求 (1)作图必须用坐标纸。按需要可以选用毫米方格纸、半对数坐标纸、对数坐标纸或极坐标纸等。 (2)选坐标轴。以横轴代表自变量,纵轴代表因变量,在轴的中部注明物理量的名称符号及其单位,单位加括号。 (3)确定坐标分度。坐标分度要保证图上观测点的坐标读数的有效数字位数与实验数据的有效数字位数相同。例如,对于直接测量的物理量,轴上最小格的标度可与测量仪器的最小刻度相同。两轴的交点不一定从零开始,一般可取比数据最小值再小一些的整数开始标值,要尽量使图线占据图纸的大部分,不偏于一角或一边。对每个坐标轴,在相隔一定距离下用整齐的数字注明分度(参阅图1.7—1)。 (4)描点和连曲线。根据实验数据用削尖的硬铅笔在图上描点,点子可用“+”、“×”、“⊙”等符号表示,符号在图上的大小应与该两物理量的不确定度大小相当。点子要清晰,不能用图线盖过点子。连线时要纵观所有数据点的变化趋势,用曲线板连出光滑而细的曲线(如系直线可用直尺),连线不能
Journal of Comparative Chemistry 比较化学, 2018, 2(2), 80-84 Published Online June 2018 in Hans. https://www.doczj.com/doc/8c18397459.html,/journal/cc https://https://www.doczj.com/doc/8c18397459.html,/10.12677/cc.2018.22010 The Teaching Method of Data Processing in Analytical Chemistry Experiment Guofeng Gui*, Xiaoyuan Sun, Yu Zhang School of Chemical Engineering, Guizhou University of Engineering Science, Bijie Guizhou Received: May 27th, 2018; accepted: Jun. 21st, 2018; published: Jun. 28th, 2018 Abstract The data processing in the analytical chemistry experiment includes the detailed observation of the experimental phenomena, the accurate record of the experimental data and the analysis and calculation of the test data. Students’ mastery of data processing can not only improve students’ mastery of the basic knowledge of chemistry, but also reflect their ability of generalizing and summarizing the analysis problems. This paper discusses and explores the teaching of data processing, and expects students to own a solid foundation for future courses and practical work in the future. Keywords Analytical Chemistry Experiment, Data Processing, Teaching Method 分析化学实验数据处理教学方法 归国风*,孙小媛,张宇 贵州工程应用技术学院化学工程学院,贵州毕节 收稿日期:2018年5月27日;录用日期:2018年6月21日;发布日期:2018年6月28日 摘要 分析化学实验中的数据处理包括对实验现象的详细观察、实验数据的准确记录以及对分析测试数据进行分析计算等。学生对数据处理的掌握,不仅可以提高学生对化学基础知识的掌握,还能够体现出学生对分析问题的归纳总结能力。本文就数据处理方面的教学进行讨论和探究,期望学生能够在学习后续课程*通讯作者。