G(T) = H298 – TS298
H 和 S 随温度改变很 小,可用298K下数据来计 算任意温度下G(T) 。
G(T)
200 H = +178 (kJ / mol)
100
0
0 473 873 1273 T 第3(0K页 )
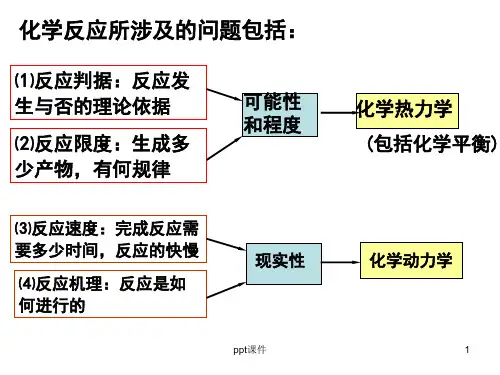
五、G-H方程利用
G= H-T S 正向反应自发
H S 低温
高温 性
–+ –
第五章 化学热力学初步
5.1 热力学第一定律 5.2 热化学 5.3 化学反应方向
第1页
5.1 热力学第一定律
体系与环境 环 体系 境
敞开体系 封闭体系 孤立体系
能量互换 物质互换
有
有
有
无
无
无
第2页
一、化学热力学惯用术语1
状态和状态函数: 状态由一些物理量来拟定,如气体状态由P、V、T、 n 等来拟定。 决定体系状态物理量称为 状态函数。 P、V、T、n 等均是状态函数。
Hθ= [ 2 ×Hfθ, Fe3O4(s) + Hfθ, CO2(g) ] – [ 3 ×Hfθ, Fe2O3(s) + Hfθ, CO(g) ]
= [ 2 ×(-1118)+ (-393.5)] –[ 3 ×(-824.2) + (-110.5)]
= -46.4 (kJ/mol)
(查表)
第15页
等温过程 G = H – T S (封闭体系) H < 0, S > 0 G < 0 正向自发 H > 0, S < 0 G > 0 正向非自发 当 G = 0 体系处于平衡
第28页
例
在标态,298 K时, CO(g) + NO(g) = CO2 (g) + 0.5 N2 (g)