金属及各类晶体配位数计算图总结共140页文档
- 格式:ppt
- 大小:8.67 MB
- 文档页数:140

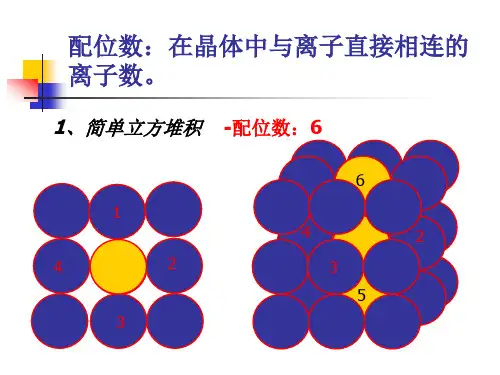





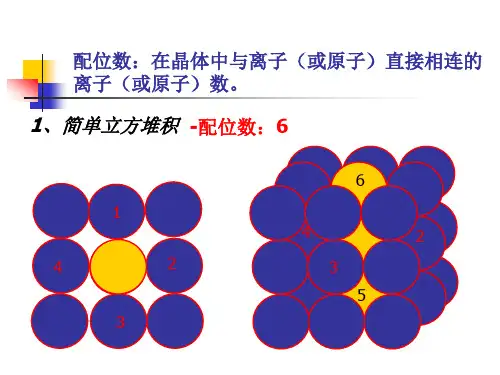
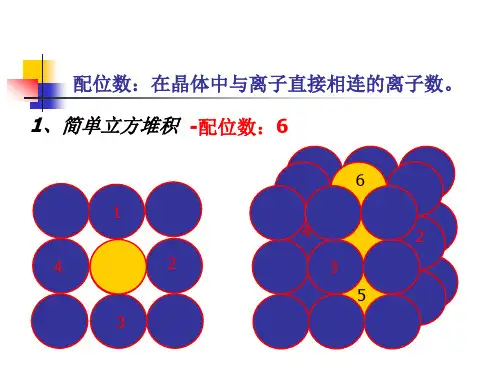

二.晶体的配位数,密度,距离,空间利用率计算1.课本模型图一个CO2分子周围阳离子的配位数是阳离子的配位数是有个分子紧邻阴离子的配位数是阴离子的配位数是阳离子周围的阳离子阳离子周围最近的阳离子数阴离子周围的阴离子阴离子周围最近的阴离子数CaF2CaF2F-的配位数是简单立方堆积体心立方堆积Ca2+的配位数是配位数是配位数是Ca2+周围的最近Ca2+数是F- 周围最近的F-数是面心立方最密堆积六方最密堆积金刚石配位数是配位数是配位数是标出A,B,C各层的原子2、在自然界中TiO2有金红石、板钛矿、锐钛矿三种晶型,其中金红石的晶胞如右图所示,则其中Ti4+的配位数为化学式为3.晶体中距每个X原子周围距离最近的Q原子有个.每个Q原子周围距离最近的X原子有个,Z原子周围距离最近的X有个,每个X原子周围距离最近的Z原子有个,每个Z原子周围距离最近的Q原子有个4.若en代表乙二胺()则配合物[Pt(en)2]Cl4中心离子的配位数为。
σ链数目为。
配离子[PtEn)2]4+的配位数为,该配离子含有的微粒间的作用力类型有5.立方氮化硼,其结构和硬度都与金刚石相似。
(1)晶胞边长为361.5pm,立方氮化硼的密度是g/cm3.(只要求列算式).(2)如图是立方氮化硼晶胞沿z轴的投影图,请在图中圆球上涂“●”和画“×”分别标明B与N的相对位置.6.列式表示(NA表示阿伏伽德罗常数的值)(1)钋原子半径为r pm,相对原子质量为M,晶体钋的密度空间利用率(2)钠原子半径为a pm,晶体钠的密度空间利用率(3)银原子半径为d cm,银晶体的密度空间利用率(4)锌原子半径为b nm 锌晶体的密度空间利用率7.列式并计算(1)铁原子半径为r pm铁晶体有2种分别是钾型铜型,铁晶体的钾型铜型密度之比为(2)金刚石原子半径为r pm列式并计算表示空间利用率8.(1)已知CaF2晶体密度为dg/cm3则F﹣与F﹣的最短距离为nm,F﹣与Ca2+最短距离为pm. (2)CaF2的Ca2+,F-半径分别为r1,r2 pm,把晶胞看成阳离子刚性球堆积,阴离子填充其中列式表示CaF2晶胞空间利用率Ca2+间最近距离,F-间最近距离9.已知氧化镍的密度为ρg/cm3;其纳米粒子的直径为Dnm,列式表示其比表面积m2/g。
晶体结构总结一、离子晶体晶体结构离子晶体的结构类型的制约因素主要是离子的电荷比(决定数量比)和半径大小比(决定配位数),离子的电子组态在一定程度上也会影响它的晶体结构,这三个性质综合起来还会决定离子键的共价性成分,后者过分强烈时,将使离子晶体转变为原子晶体,其间存在离子晶体到原子晶体的过渡型。
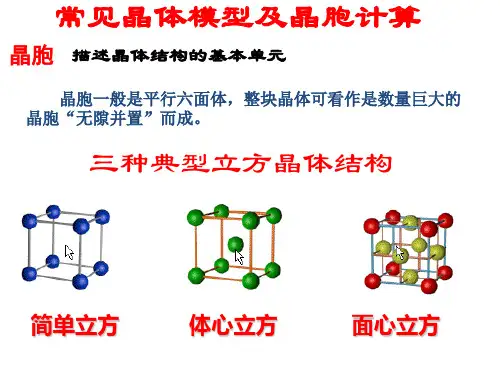
离子半径比r+-与配位数和晶体构型的关系堆积方式体心立方堆积面心立方最密堆积六方最密堆积三、原子晶体1.金刚石、晶体硅的结构:金刚石的晶体结构如下图所示,每个碳原子以sp3杂化与相邻的4个碳原子形成4个共价键,把晶体内所有的C原子连结成一个整体,形成空间网状结构,这种结构使金刚石具有很大的硬度和熔沸点。
由金刚石晶胞得,在一个金刚石晶胞中,含有8个C原子。
晶体硅具有金刚石型的结构。
只需将金刚石中的C原子换成Si原子,即得到硅的结构。
2.SiO2的结构:在每个Si—Si键中插入1个O原子,即得到SiO2的晶体结构,如下图所示,每个Si原子与4个氧原子形成1个Si—O四面体,Si原子配位数为4,O原子配位数为2.四、分子晶体水凝结变成冰,冰晶体中,H2O分子之间存在范德华力和氢键,其晶体结构如下图所示:CO2晶体俗称干冰,CO2分子之间通过范德华力结合,其晶胞如下图所示:注意:在干冰晶体结构中,每个CO2分子周围与之最近且等距离CO2分子的个数有12个。
五、混合型晶体混合型晶体又称过渡型晶体,石墨是典型的混合型晶体。
晶体的微粒之间存在两种或两种以上的作用力,这样的晶体就是混合型晶体。
石墨是层状结构,C原子采用sp2杂化轨道,与相邻的三个C原子以σ键相连结。
每个C原子周围形成三个σ键,键角120°。
每个C原子还有一个2p轨道,其中有一个2p电子。
这些2p 轨道都垂直于sp2杂化轨道的平面,因此互相平行,形成了大π键。
大π键中的电子沿层面方向的活动能力很强,与金属中的自由电子具有相似之处,所以石墨具有金属光泽,并具有良好的导电和导热性。