大黄炭饮片质量标准
- 格式:doc
- 大小:55.50 KB
- 文档页数:7

大黄检验操作规程执行标准:《中国药典》2020年版一部规程:1【性状】本品类圆形、圆锥形、卵圆形或不规则块状,长3~17cm,直径3~10cm。
除尽外皮者表面黄棕色至红棕色,有的可见类白色网状纹理及星点(异型维管束)散在,残留的外皮棕褐色,多具绳孔及粗皱纹。
质坚实,有的中心稍松软,断面淡红棕色或黄棕色,显颗粒性;根茎髓部宽广,有星点环列或散在;根木部发达,具放射状纹理,形成层环明显,无星点。
气清香,味苦而微涩,嚼之粘牙,有砂粒感。
2【鉴别】2.1鉴别(1)2.1.1仪器与用具:显微镜、玻片。
2.1.2操作步骤:按药材(饮片)及成方制剂显微鉴别法标准操作规程操作。
2.1.2.1本品横切面:根木栓层及皮层大多已除去。
韧皮部筛管群明显;薄壁组织发达。
形成层成环。
木质部射线较密,宽2~4列细胞,内含棕色物;导管非木化,常1至数个相聚,稀疏排列。
薄壁细胞含草酸钙簇晶,并含多数淀粉粒。
2.1.2.2根茎髓部宽广,其中常见黏液腔,内有红棕色物;异型维管束散在,形成层成环,木质部位于形成层外方,韧皮部位于形成层内方,射线呈星状射出。
2.1.2.3粉末黄棕色。
草酸钙簇晶直径20~160µm,有的至190µm。
具缘纹孔导管、网纹导管、螺纹导管及环纹导管非木化。
淀粉粒甚多,单粒类球形或多角形,直径3~45µm,脐点星状;复粒由2~8分粒组成。
2.2鉴别(2)2.2.1仪器与用具:酒精灯、试管、木夹。
2.2.2操作步骤:取本品粉末少量,进行微量升华,可见菱状针晶或羽状结晶。
2.3鉴别(3)2.3.1试剂:甲醇、盐酸、乙醚、石油醚、氨、甲酸乙酯、甲酸、羧甲基纤维素钠、氯仿、大黄酸对照品。
2.3.2仪器与用具:量筒(5ml、25ml)、水浴锅、烧杯、展开缸、点样管、三用紫外分析仪、电子天平(1/10000)、硅胶H薄层板。
2.3.3操作步骤:取本品粉末0.1g,加甲醇20ml,浸泡1小时,滤过,取滤液5ml,蒸干,残渣加水10ml使溶解,再加盐酸1ml,加热回流30分钟,立即冷却,用乙醚分2次提取,每次20ml,合并乙醚液,蒸干,残渣加三氯甲烷1ml使溶解,作为供试品溶液。

中药饮片质量标准一、根、根茎、藤木类性状:按药典、全国中药炮制规范、各省中药炮制规范.片形:异性片不得超过10%.极薄片:不得超过该品种标准厚度的.;薄片、厚片、丝、块:不得超过该标准的1mm;段:不得超过该标准2mm.检查:取100g拣选取异形片/取样量水分:7%----13%药屑杂质:小于2%检查:取样100g+过3号筛/取样量二、果实种子类性状:按药典、全国中药炮制规范、各省中药炮制规范.片形:异性片不得超过10%.检查:取100g拣选取异形片/取样量水分:7%----13%药屑杂质:小于3%检查:取样100g拣选杂质+过二号筛/取样量三、全草类性状:按药典、全国中药炮制规范、各省中药炮制规范.片形:异性片不得超过10%.检查:取50g拣选取异形片/取样量水分:7%----13%药屑杂质:小于2%检查:取样100g拣选杂质+过二号筛/取样量四、花类性状:按药典、全国中药炮制规范、各省中药炮制规范.片形:异性片不得超过10%.检查:取100g拣选取异形片/取样量水分:7%----13%药屑杂质:小于2%检查:取样100g拣选杂质+过二号筛/取样量五、皮类性状:按药典、全国中药炮制规范、各省中药炮制规范.片形:异性片不得超过10%.检查:取100g拣选取异形片/取样量水分:7%----13%药屑杂质:小于2%检查:取样100g拣选杂质+过二号筛/取样量六、叶类性状:按药典、全国中药炮制规范、各省中药炮制规范.片形:异性片不得超过10%.检查:取50g拣选取异形片/取样量水分:7%----13%药屑杂质:小于3%检查:取样50g拣选杂质+过二号筛/取样量七、树脂类性状:按药典、全国中药炮制规范、各省中药炮制规范.药屑杂质:小于3%检查:取样100g拣选杂质+过三号筛/取样量八、动物类性状:按药典、全国中药炮制规范、各省中药炮制规范.片形:异性片不得超过10%.检查:取100g拣选取异形片/取样量水分:7%----13%药屑杂质:小于3%检查:取样100g拣选杂质+过二号筛/取样量九、矿物类性状:按药典、全国中药炮制规范、各省中药炮制规范.片形:粉粒型药屑杂质:小于2%检查:取样100g拣选杂质+过二号筛/取样量十、菌藻类性状:按药典、全国中药炮制规范、各省中药炮制规范.片形:异性片不得超过10%.检查:取100g拣选取异形片/取样量水分:5%----18%药屑杂质:小于2%检查:取样100g拣选杂质+过二号筛/取样量炮制品质量要求现代科学技术的发展,为中药炮制品质量的检测与评价提供了科学依据.从传统的经典检测方法到现代检测技术的应用,从饮片的形、色、气、味等外观指标到内含成分的质量,从定性鉴别到定量测定,中药炮制品的质量要求,更客观化、合理化、科学化.一、净度净度:系指炮制品的纯净度,以及炮制品中所含杂质和非药用部位的限度.炮制品中不应夹带泥沙、灰屑、杂质、虫蛀、霉变品.应剔除非药用部位如壳、核、芦头、栓皮、头足、翅等.规定:1、根及根茎、藤木类:含药屑、杂质不超过2%2、果实、种子类含药屑、杂质不超过3%3、全草类:含药屑、杂质不超过3%4、叶类:含药屑、杂质不超过2%5、花类:含药屑、杂质不超过2%6、皮类:含药屑、杂质不超过2%7、树脂类:含药屑、杂质不超过3%8、动物类:含药屑、杂质不超过2%9、矿物类:含药屑、杂质不超过2%10、菌藻类:含药屑、杂质不超过2%二、片型及粉碎粒度经挑选整理或水洗处理后药材,根据药物特性和炮制要求用手工或机器切制成一定规格的片型,使之便于调剂、炮炙、储藏.1、片型符合药典和炮制规范的规定.切制后的饮片应均匀、整齐、色泽鲜艳、表面光洁.片面无油渍、无整体、无长梗、无连刀片、掉刀片、边缘卷曲等不合格的饮片.异型片不超过10%.2、粉碎粒度一般不适宜切制的或医疗上有特殊需要的药物,经挑选整理或水洗处理后药材,用手工或机器粉碎成颗粒或粉末.便于调剂或煎煮.粉碎后的药材应粉粒均匀、无杂质.三、色泽含光泽中药炮制品对色泽有特殊的要求.它的意义:⑴药材炮制后应显其固有的色泽.⑵通常在炮制操作中常以饮片表面或断面的色泽变化作为炮制程度控制的直观指标.⑶饮片的色泽是反应其质量的一项指标.⑷炮制品色泽的不正常变化说明其内部质量的变异.炒制品:含生片、焦糊片不超过2%.炒焦品:含生片、焦糊片不超过3%.炒炭品:含生片、完全炭化片不超过5%.蒸制品:色泽黑润、内无白心、未蒸透者不超过3%煮制品:未煮透者不超过2%,有毒药材要煮透.煨制品:未煨透者及糊片不超过5%.锻制品:未煅透者及灰化者不超过3%.四、气味炮制品虽经切制或炮制,但应具有原有的气和味,不应带异味或气味散失变淡.加辅料炮制品,除具原有气和味,还应带有辅料的气和味.五、水分检查炮制品中的水分,是一项重要的必不可少的内容,药物制成饮片,有的须经水处理,有的要加入部分液体辅料,如操作不当可造成“伤水”,或部分药物吸水过多,尚若干燥不充分,则炮制品极易霉烂变质.炮制品中水分宜控制在7%----13%.蜜炙品水分小于15%,酒炙醋炙盐炙姜汁炙蒸煮发酵发芽制品小于13%.烫制后醋炙品小于10%.六、灰分将干净而又无杂质的炮制品加高热灰化,所得的灰分称:“生理灰分”.而同一品种之生理灰分往往在一定的范围内.所以测定炮制品之总灰分的意义,在于通过对不挥发性无机盐的测定来鉴定和评价炮制品的质量和净度.七、浸出物炮制品加入一定溶媒后, 经过浸润、渗透——解析,溶解——扩散、置换等作用,炮制品中的某些成分总体,包括有效成分会被提取出来,因此,测定浸出物的含量是表示其质量的一项指标,对于那些有效成分尚不完全清楚或无精确定量方法的炮制品,具有重要意义.浸出物测定方法有:1水溶性浸出物2醇溶性浸出物八、显微及理化鉴别显微及理化鉴别是利用显微镜、化学方法或仪器来观察、分析鉴定炮制品的真伪、纯度或质量.1、显微鉴别 1组织鉴别 2粉末2、理化鉴别 1显色反应和沉淀反应 2荧光鉴别九、有效成分测定炮制品有效成分的含量,是评价炮制品质量的最可靠、最准确的方法;同时也是控制药物在炮制过程中有效成分的流失、检查炮制方法与工艺是否合理、科学的评判,可为工艺的改造提供准确的实验依据及指标.十、有毒成分有毒成分的限量指标应包括:毒副作用成分、重金属的含量、砷盐含量、农残等.1990年药典收载了80个含量测定方法和限量品种.十一、卫生学检查鉴于中医临床用药的传统习惯,某些炮制品常被研成细末,直接供患者冲服;有些为烊化冲服,又有些是泡服;更多的炮制品被直接粉碎成细末后,制成散剂、丸剂供人们服用.应该对饮片中可能含有的致病菌、大肠杆菌、细菌总数、霉菌总数及活螨等作必要的检查,并客观地作限量要求.十二、包装检查包装的目的是为了保护药物,便于贮存、运输和装卸.包装不仅可以保护药物的完整性和清洁,无菌包装尚能防止微生物、害虫等的侵蚀以及避免外界温度、湿度和有害气体、阳光的影响.检查炮制品的包装是否完好无损,这对炮制品在贮存、运输和装卸起作保质、保量的重要作用.。

中药饮片质量标准通则(试行)一.根、根茎、藤木类
二.果实、种子类
三.全草类
四.叶类
五.花类
六.皮类
七.树脂类
八.动物类
九.矿物类
十.菌澡类
《中药饮片质量标准通则(试行)》部分名词解释
1.霉变:系指因干燥不够或受潮湿侵袭后,药物表面或内部寄生了霉菌,引起药物变质的现象。
2.虫蛀:系指中药因生虫而被蛀蚀的现象。
一般药品均应做到无虫蛀。
3.杂质:是指来源与规定相同,但其性状或部位与规定不符;或来源与规定不同的物质或无机杂质,如砂石、泥块、尘土等。
4.伤水:系指药材在水处理时由于浸润过度,致使药材所吸水分过多,从而造成药材有效成份流失,甚至霉烂,又不易切制的现象。
5.走油变色:系指中药表面发软、发粘、呈现油状物质,同时颜色变深,并发出油腻味。
6.异形片:包括不符合质量指标所规定的规格范围的饮片、斜长片、破碎片、斧头片、连刀片。
7.药屑:系指原药的药末。

中药饮片炮制操作的质量要求一、净药材的质量要求和检查方法1.经净制后的药材必须按大小粗细分档,无虫蛀、无霉变、无走油泛黑,无杂质。
杂质包括非药用部位、伪品、混淆品、异物、无机杂质如沙石、泥块、尘土等。
2.质量指标2.1药典规定枸杞子杂质不得过0.5%;五味子、桃仁杂质不得过1%;山茱萸杂质(果核、果梗)不得过3%;女贞子杂质不得过3%;小茴香、穿山甲杂质不得过4%;草乌杂质(残茎)不得过5%;酸枣仁杂质(核壳等)不得过5%;蒲黄杂质不得过10%。
2.2饮片通则规定2.2.1根、根茎、藤木、叶、花、皮、菌藻类等类的药屑杂质不得过2%。
2.2.2果实、种子、全草等类的药屑杂质不得过3%。
2.2.3树脂类的杂质不得过3%。
2.2.4动物类的杂质不得过2%。
2.2.5矿物类的杂质不得过2%。
3.杂质检查法3.1取规定量的供试品,摊开,用肉眼或放大镜(5-10倍)观察,将杂质拣出;如其中有可以筛的杂质,则通过适当的筛,将杂质分出。
3.2将各类杂质分别称重,计算其在供试品的含量(%)。
杂质含量(%)=杂质的重量/样品总重量*100%3.3注意3.3.1药材中混杂的杂质如和正品相似,难以从外观鉴别时,可称取适量,进行显微、化学或物理鉴别试验,证明其为杂质后,计入杂质重量中。
3.3.2个体大的药材,必要时可破开,检查有无虫蛀、霉烂或变质情况。
3.3.3杂质检查所用的供试品量,除另有规定外,按药材取样法称取。
中药材软化操作的质量要求、质量指标和检查方法二、软化药材采取操作的质量要求1.质量要求经软化后的药材,必须无泥沙等杂质,无伤水,无腐败,无霉变、异味,软硬适度,达到“药透水尽”的要求。
2质量指标2.1喷淋药材未润透或水分过大的不得超过5%。
2.2淘洗及抢水洗药材水分过大或未透者不得超过5%。
2.3浸泡药材未泡透者不得超过5%,伤水的不得超过3%。
2.4闷润药材未润透的不得超过10%。
3.检查方法3.1取定量样品,用下列方法拣出未润透和水分过大的药材,合并称重计算。

中药饮片质量标准中药饮片作为中药材的一种加工形式,是中医药制剂的重要组成部分。
其质量标准的制定对于保证中药饮片的药效和安全性具有重要意义。
本文将对中药饮片质量标准进行详细介绍,以便更好地了解和掌握中药饮片的质量要求。
一、外观特征。
中药饮片的外观特征是其质量的直观表现,也是质量标准的重要内容之一。
中药饮片应具有完整的形状,色泽应自然均匀,无明显异物和霉变现象。
此外,中药饮片的气味也是其外观特征之一,应具有中药特有的香气。
二、理化指标。
中药饮片的理化指标包括水分、灰分、挥发油含量等多个方面。
其中,水分是影响中药饮片贮存稳定性的重要因素,应符合国家标准的规定范围。
灰分则是衡量中药饮片杂质含量的重要指标,其含量过高可能影响中药饮片的药效。
挥发油含量则是反映中药饮片药效成分的重要参数,不同中药饮片的挥发油含量应符合相应的标准要求。
三、微生物指标。
中药饮片的微生物指标是评价中药饮片是否符合卫生标准的重要依据。
其中包括大肠杆菌群、霉菌和酵母菌等指标,其含量应符合国家标准的规定范围,以确保中药饮片的安全性和卫生质量。
四、农药残留。
农药残留是中药饮片质量安全的重要内容之一,其合格标准应符合国家相关法规的规定。
在中药饮片的生产过程中,应严格控制农药的使用量和使用方法,以减少农药残留对中药饮片质量的影响。
五、重金属残留。
重金属残留是中药饮片质量安全的另一个重要方面,其合格标准应符合国家相关法规的规定。
在中药饮片的生产过程中,应严格控制重金属的使用量和使用方法,以减少重金属残留对中药饮片质量的影响。
六、质量控制。
中药饮片的质量控制是确保中药饮片质量稳定和可控的重要手段。
在生产过程中,应建立健全的质量控制体系,包括原材料采购、生产工艺控制、成品检验等多个环节,以确保中药饮片的质量符合标准要求。
七、贮存要求。
中药饮片的贮存要求是保证中药饮片质量稳定的重要环节。
在贮存过程中,应避免阳光直射、潮湿和高温环境,以免影响中药饮片的质量稳定性和药效。
中药饮片工艺验证0009-大黄方案文件名称大黄工艺验证方案版本号 00-2015文件类别技术标准起草人日期文件编码 M-VL-0009 审核人日期执行日期批准人日期分发部门质量管理部、生产设备部一、概述:1.生产情况概述:中药饮片在进行了关键岗位员工培训及各种设备安装确认、运行确认、计量器具校验后,开始中药饮片的生产。
现对大黄的生产工艺关键工序进行验证,以确定大黄生产过程的稳定性,保证在规定的条件下始终如一地生产出质量可靠的大黄饮片。
2.产品概述:2.1 品名:大黄2.2.规格:2-4mm厚片。
2.3.性状:本品呈类圆柱形、圆锥形、卵圆形或不规则块状,长3,17cm,直径3,lOcm。
除尽外皮者表面黄棕色至红棕色,有的可见类白色网状纹理及星点(异型维管束)散在,残留的外皮棕褐色,多具绳孔及粗皱纹。
质坚实,有的中心稍松软,断面淡红棕色或黄棕色,显颗粒性;根茎髓部宽广,有星点环列或散在;根木部发达,具放射状纹理,形成层环明显,无星点。
气清香,味苦而微涩,嚼之粘牙,有沙粒感。
二、范围:适用于大黄生产工艺的验证。
三、人员与职责:验证小组负责对此工艺的验证,生产人员协助操作,具体见下表:姓名职务所在部门及职务验证过程中的职责批准验证方案及验证报告梁文峰组长总经理落实验证文件起草者,安排验证过程按进度有序进行,审核验证方案、记石殿祥成员生产设备部经理录是否完整及最终验证结果评价。
负责验证方案的审核及验证报告评价。
李文平成员质量部经理负责起草验证方案,负责验证数据的收集、校对、复核确认工作。
负责整梁宗海成员生产设备部理文件记录的归档工作及最终验证报告。
负责验证确认过程中现场检测相关工作。
马富巧成员质量部QA负责取样、检验,出具检验报告,确认验证结果。
陈玉芳成员质量部QC 负责设备运转正常,辅助完成工艺验证王建中成员生产设备部四、验证依据:大黄生产工艺规程(Y/M-TS-0016)五、大黄生产工艺流程:大黄拣选洗润切厚片干燥酒炙蒸制炒炭筛选包装 M-VL-0009 1 /18六、本次验证内容:本验证将对大黄的清洗、润、切、干燥、筛选、包装等关键工序进行验证。
XXXXXXX有限公司原料质量标准及检验操作规程1 品名:1.1 中文名:大黄1.2 汉语拼音:Da huang2 代码:3 取样文件编号:4 检验方法文件编号:5 依据:《中国药典》(2020年版一部)。
6 质量标准:7 检验操作规程:7.1 试药与试剂:甲醇、水、盐酸、乙醚、三氯甲烷、大黄对照药材、大黄酸对照品、石油醚(30~60℃)、甲酸乙酯、甲酸、氨蒸气、乙醇、磷酸、芦荟大黄素对照品、大黄素对照品、大黄酚对照品、大黄素甲醚对照品。
7.2 仪器与用具:显微镜、电子天平、以羧甲基纤维素钠为黏合剂的硅胶H薄层板、水浴锅、三用紫外分析仪、恒温鼓风干燥箱、马福炉、高效液相色谱仪、超声波清洗器。
7.3 性状:取本品适量,自然光下目测色泽,嗅闻气味。
7.4 鉴别:7.4.1 取本品制片置10×10显微镜下做显微观察。
7.4.2 取本品粉末少量,进行微量升华,可见菱状针晶或羽状结晶。
7.4.3 取本品粉末0.1g,加甲醇20ml,浸泡1小时,滤过,取滤液5ml,蒸干,残渣加水10ml使溶解,再加盐酸1ml,加热回流30分钟,立即冷却,用乙醚分2次提取,每次20ml,合并乙醚液,蒸干,残渣加三氯甲烷1ml使溶解,作为供试品溶液。
另取大黄对照药材0.1g,同法制成对照药材溶液。
再取大黄酸对照品,加甲醇制成每1ml含1mg的溶液,作为对照品溶液。
照薄层色谱法(附录7)试验,吸取上述三种溶液各4µl,分别点于同一以羧甲基纤维素钠为黏合剂的硅胶H薄层板上,以石油醚(30~60℃)-甲酸乙酯-甲酸(15 : 5 : 1)的上层溶液为展开剂,展开,取出,晾干,置紫外光灯(365nm)下检视。
供试品色谱中,在与对照药材色谱相应的位置上,显相同的五个橙黄色荧光主斑点;在与对照品色谱相应的位置上,显相同的橙黄色荧光斑点,置氨蒸气中熏后,斑点变为红色。
7.5 检查:7.5.1 土大黄苷:取本品粉末0. 1g,加甲醇10ml,超声处理20分钟,滤过,取滤液lml,加甲醇至10ml,作为供试品溶液。
中药饮片炮制操作的质量要求一、净药材的质量要求和检查方法1.经净制后的药材必须按大小粗细分档,无虫蛀、无霉变、无走油泛黑,无杂质。
杂质包括非药用部位、伪品、混淆品、异物、无机杂质如沙石、泥块、尘土等。
2。
质量指标2。
1药典规定枸杞子杂质不得过0。
5%;五味子、桃仁杂质不得过1%;山茱萸杂质(果核、果梗)不得过3%;女贞子杂质不得过3%;小茴香、穿山甲杂质不得过4%;草乌杂质(残茎)不得过5%;酸枣仁杂质(核壳等)不得过5%;蒲黄杂质不得过10%。
2.2饮片通则规定2.2.1根、根茎、藤木、叶、花、皮、菌藻类等类的药屑杂质不得过2%。
2。
2。
2果实、种子、全草等类的药屑杂质不得过3%。
2。
2。
3树脂类的杂质不得过3%。
2.2.4动物类的杂质不得过2%。
2.2。
5矿物类的杂质不得过2%.3。
杂质检查法3.1取规定量的供试品,摊开,用肉眼或放大镜(5—10倍)观察,将杂质拣出;如其中有可以筛的杂质,则通过适当的筛,将杂质分出。
3。
2将各类杂质分别称重,计算其在供试品的含量(%)。
杂质含量(%)=杂质的重量/样品总重量*100%3。
3注意3。
3。
1药材中混杂的杂质如与正品相似,难以从外观鉴别时,可称取适量,进行显微、化学或物理鉴别试验,证明其为杂质后,计入杂质重量中.3。
3。
2个体大的药材,必要时可破开,检查有无虫蛀、霉烂或变质情况.3.3。
3杂质检查所用的供试品量,除另有规定外,按药材取样法称取。
中药材软化操作的质量要求、质量指标和检查方法二、软化药材采取操作的质量要求1.质量要求经软化后的药材,必须无泥沙等杂质,无伤水,无腐败,无霉变、异味,软硬适度,达到“药透水尽”的要求。
2质量指标2.1喷淋药材未润透或水分过大的不得超过5%。
2。
2淘洗及抢水洗药材水分过大或未透者不得超过5%。
2.3浸泡药材未泡透者不得超过5%,伤水的不得超过3%。
2。
4闷润药材未润透的不得超过10%.3.检查方法3。
1取定量样品,用下列方法拣出未润透和水分过大的药材,合并称重计算. 3.1.1刀劈质地坚硬药材用刀劈开,内心应有潮湿痕迹。
饮片质量标准饮片是中药材的一种加工形式,是中药制剂的重要原料。
饮片的质量直接关系到中药制剂的疗效和安全性,因此制定和执行严格的饮片质量标准对于保障中药质量和人民健康具有重要意义。
一、外观质量标准。
1. 饮片应整齐、饱满、无虫蛀、无霉斑、无异物。
2. 色泽应与原药材基本一致,无明显变色。
3. 饮片的大小、形状应符合规定要求,不得有明显破碎。
二、理化指标。
1. 含水量,饮片的含水量应符合国家标准,一般不得超过12%。
2. 杂质,饮片中的杂质应符合国家标准,不得超过规定的百分比。
3. 灰分,饮片的灰分含量应符合国家标准,不得超过规定的百分比。
三、理化成分。
1. 主要有效成分,饮片中的主要有效成分含量应符合国家标准,保证药效。
2. 重金属、农药残留,饮片中的重金属、农药残留量应符合国家标准,不得超过规定的安全范围。
四、微生物指标。
1. 饮片中的细菌总数、霉菌和酵母菌数量应符合国家标准,保证饮片的微生物安全。
2. 不得检出致病菌和霉菌毒素。
五、质量控制。
1. 生产过程中应严格执行良好的生产规范,保证饮片的质量稳定。
2. 对原药材进行严格的质量控制,确保饮片的原料质量。
六、贮存和运输。
1. 饮片的贮存和运输过程中应避免阳光直射、潮湿和污染。
2. 严格执行质量管理制度,确保饮片在贮存和运输过程中不受污染和变质。
七、质量标准的执行。
1. 生产企业应严格执行国家标准,确保饮片质量符合要求。
2. 监管部门应加强对饮片质量的监督检查,发现问题及时处理。
总之,饮片质量标准的制定和执行对于保障中药质量、提高中药制剂的疗效和安全性具有重要意义。
各相关部门和企业应共同努力,严格执行质量标准,保障饮片的质量安全,为人民健康服务。
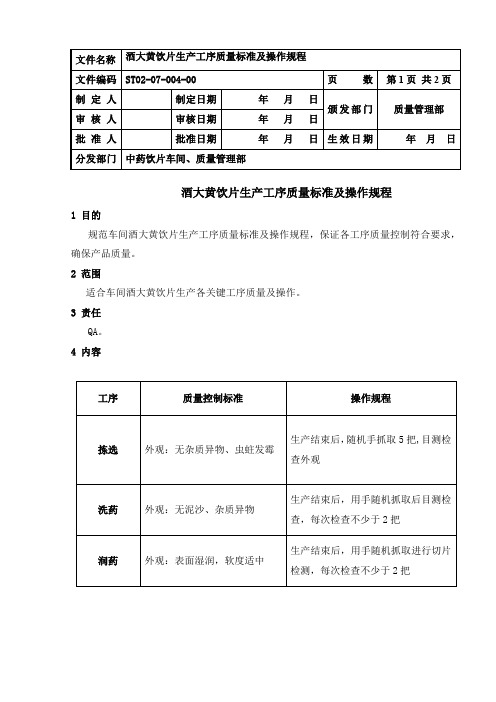
大黄炭饮片质量标准1 目的
制定大黄炭饮片质量标准,以确保质量。
2 适用范围
本公司所生产的大黄炭饮片。
3 职责
质量管理部
4 内容
4.1 产品名称、产品代码、产品规格、包装形式
4.1.1 产品名称:大黄炭饮片
4.1.2产品代码:C003
4.1.3 产品规格:400 g/袋
4.1.4 包装形式:400 g/袋×12袋/件
4.2 标准依据:
中国药典2015年版一部
4.3取样、检验方法或相关操作规程编号
4.4 质量指标
4.5 检验标准操作规程
4.5.1性状
本品呈不规则的块片,表面黑色,断面中间隐约可见放射状纹理,质坚硬,气微香。
具体操作和注意事项见文件SW10-04-009-00《性状检查标准操作规程》
4.5.2鉴别
4.5.2.1显微鉴别
本品横切面:根木栓层和栓内层大多已除去。
韧皮部筛管群明显;薄壁组织发达。
形成层成环。
木质部射线较密,宽2~4列细胞,内含棕色物;导管非木化,常1至数个相聚,稀疏排列。
薄壁细胞含草酸钙簇晶,并含多数淀粉粒。
根茎髓部宽广,其中常见黏液腔,内有红棕色物;异型维管束散在,形成层成环,木质部位于形成层外方,韧皮部位于形成层内方,射线呈星状射出。
粉末黄棕色。
草酸钙簇晶直径20~160μm,有的至190μm。
具缘纹孔导管、网纹导管、螺纹导管及环纹导管非木化。
淀粉粒甚多,单粒类球形或多角形,直径3~45μm,脐点星状;复粒由2~8分粒组成。
具体操作和注意事项见文件SW10-04-011-00《显微鉴别标准操作规程》
4.5.2.2一般鉴别
取本品粉末少量,进行微量升华,可见菱状针晶或羽状结晶。
4.5.2.3 薄层鉴别
取本品粉末0.1g,加甲醇20ml,浸泡1小时,滤过,取滤液5ml,蒸干,残渣加水10ml使溶解,再加盐酸1ml,加热回流30分钟,立即冷却,用乙醚分2次振摇提取,每次20ml,合并乙醚液,蒸干,残渣加三氯甲烷1ml使溶解,作为供试品溶液。
另取大黄对照药材0.1g,同法制成对照药材溶液。
再取大黄酸对照品,加甲醇制成每1ml含1mg的溶液,作为对照品溶液。
照薄层色谱法(详见文件SW10-04-010-00《薄层色谱法标准操作规程》)试验,吸取上述三种溶液各4μ1,分别点于同一以羧甲基纤维素钠为黏合剂的硅胶H薄层板上,以石油醚(30~60℃)-甲酸乙酯-甲酸(15:5:1)的上层溶液为展开剂,展开,取出,晾干,置紫外光灯(365nm)下检视。
供试品色谱中,在与对照药材色谱相应的位置上,显相同的五个橙黄色荧光主斑点;在与对照品色谱相应的位置上,显相同的橙黄色荧光斑点,置氨蒸气中熏后,斑点变为红色。
具体操作和注意事项见文件SW10-04-010-00《薄层色谱法标准操作规程》
4.5.3检查
4.5.3.1土大黄苷
取本品粉末0.1g,加甲醇10ml,超声处理20分钟,滤过,取滤液1ml,加甲醇至10ml,作为供试品溶液。
另取土大黄苷对照品,加甲醇制成每1ml含10μg的溶液,作为对照品溶液(临用新制)。
照薄层色谱法(通则0502)试验,吸取上述两种
溶液各5μl,分别点于同一聚酰胺薄膜上,以甲苯-甲酸乙酯-丙酮-甲醇-甲酸(30:5:5:20:0.1)为展开剂,展开,取出,晾干,置紫外光灯(365nm)下检视。
供试品色谱中,在与对照品色谱相应的位置上,不得显相同的亮蓝色荧光斑点。
具体操作和注意事项见文件SW10-04-010-00《薄层色谱法标准操作规程》。
4.5.3.2干燥失重
具体操作和注意事项见文件SW10-04-004-00《干燥失重测定标准操作规程》。
4.5.3.3总灰分
具体操作和注意事项见文件SW10-04-005-00《总灰分测定标准操作规程》。
4.5.3.4装量差异限度检查
具体操作和注意事项见文件SW10-04-014-00《装量差异限度检查标准操作规程》。
4.5.3.5二氧化硫残留量
具体操作和注意事项见文件SW10-04-016-00《二氧化硫残留量测定标准操作规程》。
4.5.4浸出物
具体操作和注意事项见文件SW10-04-006-00《浸出物测定标准操作规程》
照水溶性浸出物测定法项下的热浸法测定。
4.5.5含量测定
4.5.5.1总蒽醌
色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以甲醇-0.1%磷酸溶液(85:15)为流动相;检测波长为254nm。
理论板数按大黄素峰计算应不低于3000。
对照品溶液的制备精密称取芦荟大黄素对照品、大黄酸对照品、大黄素对照品、大黄酚对照品、大黄素甲醚对照品适量,加甲醇分别制成每1ml含芦荟大黄素、大黄酸、大黄素、大黄酚各80μg,大黄素甲醚40μg的溶液;分别精密量取上述对照品溶液各2ml,混匀,即得(每1ml中含芦荟大黄素、大黄酸、大黄素、大黄酚各16μg,含大黄素甲醚8μg)。
供试品溶液的制备取本品粉末(过四号筛)约0.15g,精密称定,置具塞锥形瓶中,精密加入甲醇25ml,称定重量,加热回流1小时,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过。
精密量取续滤液5ml,置烧瓶中,挥去溶剂,加8%盐酸溶液10ml,超声处理2分钟,再加三氯甲烷10ml,加热回流1小时,放冷,置
分液漏斗中,用少量三氯甲烷洗涤容器,并入分液漏斗中,分取三氯甲烷层,酸液再用三氯甲烷提取3次,每次10ml,合并三氯甲烷液,减压回收溶剂至干,残渣加甲醇使溶解,转移至10ml量瓶中,加甲醇至刻度,摇匀,滤过,取续滤液,即得。
测定法分别精密吸取对照品溶液与供试品溶液各10μl,注入液相色谱仪,测定,即得。
本品按干燥品计算,含总蒽醌以芦荟大黄素(C
15H
10
O
5
)、大黄酸(C
15
H
8
O
6
)、大黄素
(C
15H
10
O
5
)、大黄酚(C
15
H
10
O
4
)和大黄素甲醚(C
16
H
12
O
5
)的总量计,不得少于0.90%。
4.5.5.2游离蒽醌
色谱条件与系统适用性试验以十八烷基硅烷键合硅胶为填充剂;以甲醇-0.1%磷酸溶液(85:15)为流动相;检测波长为254nm。
理论板数按大黄素峰计算应不低于3000。
对照品溶液的制备精密称取芦荟大黄素对照品、大黄酸对照品、大黄素对照品、大黄酚对照品、大黄素甲醚对照品适量,加甲醇分别制成每1ml含芦荟大黄素、大黄酸、大黄素、大黄酚各80μg,大黄素甲醚40μg的溶液;分别精密量取上述对照品溶液各2ml,混匀,即得(每1ml中含芦荟大黄素、大黄酸、大黄素、大黄酚各16μg,含大黄素甲醚8μg)。
供试品溶液的制备取本品粉末(过四号筛)约0.5g,精密称定,置具塞锥形瓶中,精密加入甲醇25ml,称定重量,加热回流1小时,放冷,再称定重量,用甲醇补足减失的重量,摇匀,滤过,取续滤液,即得。
测定法分别精密吸取对照品溶液与供试品溶液各10μl,注入液相色谱仪,测定,即得。
本品按干燥品计算,含游离蒽醌以芦荟大黄素(C
15H
10
O
5
)、大黄酸(C
15
H
8
O
6
)、大
黄素(C
15H
10
O
5
)、大黄酚(C
15
H
10
O
4
)和大黄素甲醚(C
16
H
12
O
5
)的总量计,不得少于0.50%。
具体操作和注意事项见文件SW10-04-001-00《高效液相色谱法标准操作规程》。
4.6贮藏条件
置通风干燥处。
4.7有效期
三年
————————————————。