中考化学 专题六 化学方程式计算题
- 格式:ppt
- 大小:97.00 KB
- 文档页数:18


江苏省东台市中考化学复习专题六有关化学式的计算解析[典例剖析]例1、最近,科学家研究确认,一些零食特别是油炸食品含有致癌物质丙烯酰胺(C3H5ON)。
丙烯酰胺的相对分子质量__________,碳、氢、氧、氮元素的质量比为__________,氮元素的质量分数为__________。
解析:单纯计算熟悉物质的相对分子质量、各元素质量比和元素质量分数的题目已被中考淘汰,取而代之的是以这类计算作为传播最新科技、最新发现或普及健康知识等内容的载体。
背景材料只需大致了解,关键是提取解题的有效信息——丙烯酰胺的化学式(C3H5ON)。
在计算中注意所给元素的顺序、数准各原子的数目,并保证计算准确。
C3H5ON的相对分子质量:12×3+1×5+16+14=71C3H5ON中碳、氢、氧、氮四种元素的质量比=12×3∶1×5∶16∶14=36∶5∶16∶14C3H5ON中氮元素的质量分数:×100%=19.7%答案:71;36∶5∶16∶14;19.7%例2、为了消除碘缺乏病,我国政府规定居民的食用盐必须是加碘盐。
碘盐就是在食盐中加入一定量的碘酸钾(KIO3)。
1000g碘盐中约含0.02g碘。
(相对原子质量:K-39 I-127 O -16)(1)__________g碘酸钾中含有0.02g碘。
(保留小数点后3位)(2)成人每天约需1.5×10-4g碘,假设这些碘是从碘盐中摄取的,成人每天需要食用碘盐______g。
解析:碘盐中碘元素的质量=碘盐中碘酸钾的质量×碘酸钾中碘元素的质量分数(1)碘酸钾中碘元素的质量分数为:×100%=59.3%需碘酸钾的质量为:0.02g/59.3%=0.034g(2)需要食用碘盐的质量为:1.5×10-4g/x=0.02g/1000g x=7.5g答案:(1)0.034 (2)7.5例3、研究表明,Al3+在人体内会阻止小肠壁对磷的吸收,使血液和其它组织内磷的含量减少,造成记忆力减退,免疫功能下降,被世界卫生组织确定为食品污染源之一。

专题六综合计算题1.(2018年山西)某同学用锌和稀硫酸做了如下实验,并进行相关的定量分析。
将一定量的锌放入试管中,向其中加入98 g质量分数为10%的稀硫酸,恰好完全反应。
(1)请计算生成氢气的质量(写出计算过程)。
(2)通过已知数据还能求出的量有________(填字母,符合题意的选项都选)。
a.参加反应锌的质量 b.生成硫酸锌的质量c.稀硫酸中水的质量 d.反应后溶液中溶质质量分数2.(2018年广东)同学们做甲、乙两个中和反应实验的探究(见下图)。
(1)甲实验恰好中和,则该溶液中的溶质是____________(填化学式)。
(2)取乙反应后的溶液60.0 g,滴加质量分数26.5%的Na2CO3溶液(如图丙),溶液pH的变化如图丁,则与CaCl2反应的碳酸钠溶液的质量为____________g;请计算该溶液中CaCl2的溶质质量分数____________(写出计算过程,精确到0.1%)。
戊(3)根据计算所得数据在图戊中画出产生沉淀的曲线。
(4)乙组的中和反应实验设计存在的不足是____________________________。
3.(2018年邵阳)某化学兴趣小组参观了一个石灰厂时,带回了一些石灰石样品,同学们利用这些石灰石样品做了如下实验:取样品10 g放入烧杯中,将50 g稀盐酸分5次加入,实验过程所得的数据如表所示(已知石(1)第______3(2)石灰石样品中CaCO3的质量分数=________。
(3)所用稀盐酸中溶质的质量分数(写出计算过程,结果精确到0.1%)。
4.(2018年南昌)小新用20 g含碳酸钠53%的天然碱制取氢氧化钠用于制作“叶脉书签”(杂质不参加反应)。
操作过程如下:请计算:(1)20 g样品中碳酸钠的质量为________g。
(2)反应后所得滤液中氢氧化钠的质量分数为多少?(写出计算过程)(3)将200 g滤液浓缩成制作“叶脉书签”所需质量分数为10%的氢氧化钠溶液,需蒸发水________g。

专题六化学计算题(必考)一、有关化学式的计算(必考)此类试题解题时要抓住两个关键量,即相对原子质量和各原子的个数。
解题方法如下:如以C6H12O6为例1.一个分子中碳、氢、氧的原子个数比=6∶12∶6=1∶2∶12.相对分子质量=12×6+1×12+16×6=1803.碳、氢、氧元素的质量比=(12×6)∶(1×12)∶(16×6)=6∶1∶84.碳元素的质量分数=碳的相对原子质量×原子个数×100%=C6H12O6的相对分子质量12×6180×100%=40%5.碳元素的质量=C6H12O6的质量×碳元素的质量分数1.(2019省卷)如图是某化肥的部分信息。
请根据该信息计算:△△牌钾肥主要成分:K2SO4(杂质不含钾元素)净重:50 kg化工厂(1)硫酸钾中钾、硫、氧三种元素的质量比为__39∶16∶32__。
(2)该钾肥中钾元素的质量分数最高为__44.8%__(精确至0.1%)。
2.(2018天水)由于高铁列车车厢是密闭的空间,因此需要提供清洁的空气和保持车厢的卫生。
高铁酸钠(Na2FeO x)是高铁上常用的一种“绿色、环保、高效”的消毒剂。
(1)已知高铁酸钠的相对分子质量为166,则x的值为__4__。
(2)__16.6__克的高铁酸钠中含有4.6克的钠元素。
3.(2021郴州)葡萄酒中含有白藜芦醇(C x H12O3),现代科技证明,白藜芦醇具有美容养颜之功效,其相对分子质量为228。
试计算:(1)x=14;(2)白藜芦醇中碳、氢、氧元素的原子个数比为14∶12∶3;(3)22.8 g白藜芦醇中氧元素的质量为4.8 g。
4.硅胶是常用的一种干燥剂。
利用氯化钴含有不同数目的结晶水呈现不同颜色的性质,在制备硅胶时加入一些氯化钴得到变色硅胶。
用CoCl2·xH2O表示含结晶水的氯化钴。

化学方程式计算专题一、有关反应物和生成物质量的计算1 、用28g铁跟足量的稀硫酸反应,可制得氢气多少g?现需用20g氢气填充气球,需要消耗多少克铁?(Fe+H2SO4====FeSO4 +H2 ↑)二、含有杂质的反应物和生成物的计算2、在二氧化锰的催化下,加热氯酸钾来制取氧气,如果用20克纯度为96%的氯酸钾起反应,能制得多少氧气?3、有一块不纯的锌片15.25g,跟足量的稀硫酸完全反应(杂质不参加反应),生成0.4g氢气,求此锌片的质量分数?(Zn+H2SO4====ZnSO4 +H2 ↑)三、关于多步反应的计算4、用电解水的方法产生的氢气还原氧化铜,若还原得到32g铜,则需电解多少克水?(CuO+H2====Cu +H2O)5、用足量的CO和32gFe2O3完全反应,能生成多少克铁?这些铁相当于多少可Fe3O4中铁的含量?(注:此反应为:Fe2O3+3CO=== 2Fe+3CO2)四、有关质量差的计算6、将0.5g二氧化锰与一定量氯酸钾共热到质量不减少为止,称得残渣质量为15.4g。
求:(1)生成氧气多少克?(2)原先氯酸钾的质量是多少克?五、有关相对原子质量的计算7、某+1价金属R2.3克与足量的氧气反应生成一种氧化物6.2克,求这种金属的相对原子质量?8、ag某金属R与足量稀硫酸完全反应,生成bg氢气,已知该金属的化合价为+3价,则金属R的相对原子质量是多少?六、质量守恒定律在化学方程式计算中的应用9、实验室常用一定质量分数的过氧化氢溶液制取氧气。
某同学实验前称得一定质量分数的过氧化氢溶液42.5 g,加入1g MnO2,完全反应后称得剩余物的质量为41.9 g。
计算:(1)反应中放出氧气的质量。
(2)实验中加入的过氧化氢溶液的质量分数。
10、6.4克铜在空气中加热一段时间,完全反应后发现质量增加1.6克,求生成了氧化铜多少克?七、关于反应物过量的计算11、62克磷和40克氧气充分反应,可生成五氧化二磷多少克?12、有20克H2和O2的混合气体,点燃充分反应后,产生18克水,则原混合气体的成分组成情况是怎样的,通过计算说明.八、无数据计算题:13、氯酸钾、二氧化锰和铜的混合物在空气中加强热,完全反应后剩余固体和原混合物固体质量相等。


专题六 综合计算题类型一 文字表达型将铁粉和铜粉的混合物7 g ,参加到盛有58.1 g 稀盐酸的烧杯中,恰好完全反响,此时烧杯内各物质的总质量为64.9 g 。
试计算: (1)原混合物中铁粉的质量分数。
(2)反响后所得溶液中溶质的质量分数。
参与反响的物质有哪些,应该用什么方程式进展计算。
分析模型步骤一:分析题干信息,确定化学方程式Fe +2HCl===FeCl 2+H 2↑。
步骤二:分析题干中的数据,抓住打破口“恰好完全反响〞,即铁粉恰好完全反响,盐酸也恰好完全反响。
步骤三:利用化学方程式进展计算。
生成氢气的质量7 g +58.1 g -64.9 g =0.2 g Fe +2HCl===FeCl 2+H 2↑ √ √ 0.2 g由此可以计算出混合物中铁的质量,溶液中溶质的质量。
步骤四:计算纯度、溶液中溶质质量分数。
铁粉的质量分数=铁粉的质量混合物质量×100%溶质质量分数=溶质质量溶液质量×100%注:画“√ 〞表示可由数据求得,下同。
1.(2021·山西中考)黄铜(铜锌合金)的外观与黄金极为相似,容易以假乱真。
小红同学想测定黄铜中锌的含量。
她称取20 g 黄铜样品放入烧杯中,参加足量稀硫酸充分反响后,测得生成氢气的质量为 0.2 g。
(1)该反响属于____________(填根本反响类型)。
(2)求黄铜样品中锌的质量分数(写计算过程)。
2.(2021·潍坊中考)工业纯碱中常含有少量的氯化钠。
某学习小组对其组成展开探究。
现取24 g纯碱样品,参加100 g水使其完全溶解,再参加96 g过量的氯化钙溶液,完全反响后,过滤、洗涤、枯燥得沉淀20 g。
完成以下问题:(1)反响后溶液中含有的溶质是________________________(写化学式)。
(2)通过数据,能求出的量有__________(写字母序号)。
A.反响后溶液的总质量B.参加反响的氯化钙的质量C.样品中碳酸钠的质量分数D.氯化钙溶液中溶质的质量分数(3)计算反响后溶液中氯化钠的质量分数。

专题六化学计算[考点导航][例题1][有关化学式计算]在“坚定信心、同舟共济、科学防治、精准施策”的指引下,全国上下同心战疫,共同打赢疫情防控阻击战!材料一:新型冠状病毒肺炎是由2019新型冠状病毒(2019﹣nCoV)引起,呼吸道飞沫和密切接触传播是主要的传播途径,以发热、乏力、干咳为主要表现。
材料二:新型冠状病毒对化学消毒剂敏感,75%酒精(C2H5OH)、过氧乙酸(CH3COOH)、84消毒液和紫外线均可灭活病毒。
请根据上述材料回答:小敏对灭杀新冠病毒的消毒液研究:①相同个数的酒精分子和过氧乙酸分子,所含氢原子的个数比为。
②酒精中碳元素的质量分数为(保留到0.1%)。
[练习1]铁是人类不可缺少的微量元素,正常人每天应补充14mg左右的铁,其中大部分来自于食物。
如果全部通过服用含FeSO4•7H2O的片剂补充铁,则每天约需要服用含mg FeSO4•7H2O的片剂。
市场上某硫酸亚铁片剂,其中Fe2+的含量为16.0%.该片剂中的Fe2+在空气中易变质,国家规定该片剂中Fe2+变质超过10.0%即不能再服用。
为检验某药店出售的硫酸亚铁片剂是否失效,取10.0g该片剂经测定含Fe2+1.52g。
通过计算说明该片剂是否能服用?[例题2][溶液计算] M是硝酸钾或氯化铵中的一种,硝酸钾和氯化铵的溶解度曲线如图1所示,某化学兴趣小组用物质M进行了如图2所示的实验。
(1)t1℃时,氯化铵的溶解度为g;(2)烧杯①中溶质质量分数的计算式为;(3)物质M是。
[练习2]某同学取四份150克水后,分别加入一定质量的硝酸钾固体配制成t℃的溶液,充分搅拌后,滤去未溶解的固体,将相关数据记录如下表:操作序号1234加入硝酸钾的质量/g120150180210溶液的质量/g270300310m(1)表格中m值.(2)根据以上数据,计算t℃时硝酸钾的S.[例题3][有关化学方程式计算]在一烧杯中盛有CaCl2和HCl的混合溶液100g,向其中逐渐滴加溶质质量分数为10%Na2CO3溶液,混合溶液的质量与所滴入的Na2CO3溶液的质量关系图象如图所示。
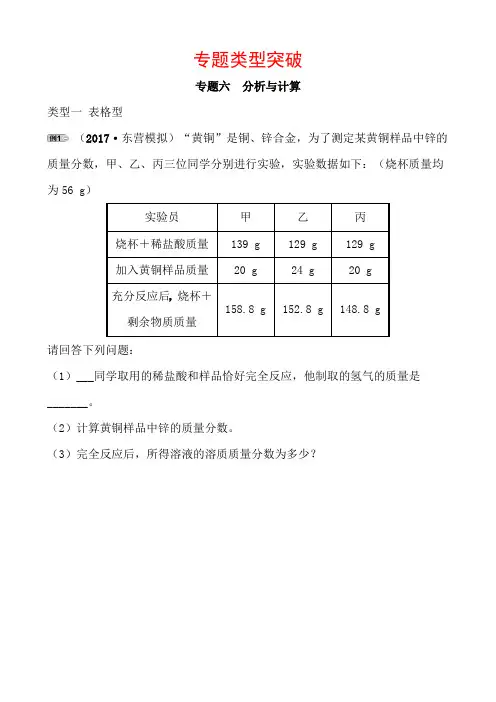
专题类型突破专题六分析与计算类型一表格型(2017·东营模拟)“黄铜”是铜、锌合金,为了测定某黄铜样品中锌的质量分数,甲、乙、丙三位同学分别进行实验,实验数据如下:(烧杯质量均为56 g)请回答下列问题:(1)___同学取用的稀盐酸和样品恰好完全反应,他制取的氢气的质量是_______。
(2)计算黄铜样品中锌的质量分数。
(3)完全反应后,所得溶液的溶质质量分数为多少?(2017·东营中考)醋的主要成分是醋酸,其化学式为CH。
醋不仅是调味品,而且还有较强的灭菌、抑毒的作用。
小明为判断家中的9°米醋含酸量是否合格,取100 mL米醋(见标签)于锥形瓶中,然后再向锥形瓶中逐渐加入一定溶质质量分数的碳酸氢钠溶液,反应过程中,当加入碳酸氢钠溶液的质量至以下数值时,对充分反应后锥形瓶中剩余物质的质量进行了记录,测得的部分数据如下,请根据有关信息回答问题。
(提示:化学方程式为CH3COOH+NaHCO3===CH3COONa+H2O+CO2↑)(1)醋酸中碳、氢、氧三种元素的质量比为_______。
(2)100 mL米醋与足量碳酸氢钠溶液反应产生的二氧化碳质量为_____g,表中m的数值为_______。
(3)请通过计算判断该产品含酸量是否合格?(写出计算过程)读懂表中数据,判断哪组物质完全反应,确定用哪些数据来解题。
分析模板步骤一: 分析题干信息,确定反应的化学方程式:Zn +2HCl===ZnCl 2+H 2↑。
步骤二:分析表格数据,三位同学实验后得到氢气的质量均为0.2 g 。
甲、丙对比,甲中稀盐酸过量,乙、丙对比,乙中黄铜样品过量,所以丙同学取用的稀盐酸和样品恰好完全反应。
所以根据乙组同学提供的数据进行计算。
步骤三:利用化学方程式进行计算。
Zn +2HCl===ZnCl 2+H 2↑ √ √ 0.2 g由此可以计算出混合物中锌的质量,溶液中溶质的质量。
步骤四:计算混合固体中某物质质量分数、溶液中溶质质量分数。

初三化学化学方程式计算练习题一、选择题1、电解水得到的氢气和氧气的质量比是()A 2:1B 4:8C 1:8D 1:16答案:C解析:电解水的化学方程式为:2H₂O 通电 2H₂↑ + O₂↑,氢气和氧气的相对分子质量分别为 2 和 32。
生成氢气和氧气的物质的量之比为 2:1,质量之比为(2×2):(1×32)= 4:32 = 1:8。
2、在反应 2A + 3B = 2C + 4D 中,若 A、B、C、D 的质量比为8:12:11:9,则 A、B、C、D 的相对分子质量之比为()A 8:12:11:9B 16:36:22:36C 16:16:22:9D 2:3:2:4答案:B解析:设 A、B、C、D 的相对分子质量分别为 x、y、z、m。
因为 A、B、C、D 的质量比为 8:12:11:9,根据化学方程式中各物质的质量比等于相对分子质量乘以化学计量数之比,可得:(2x):(3y):(2z):(4m) = 8:12:11:92x : 3y = 8 : 12 ,解得 x : y = 16 : 362x : 2z = 8 : 11 ,解得 x : z = 16 : 222x : 4m = 8 : 9 ,解得 x : m = 16 : 36所以 A、B、C、D 的相对分子质量之比为 16:36:22:36,故选 B。
3、用氢气还原氧化铜,若还原 8 克氧化铜,需要氢气的质量是()A 02 克B 05 克C 1 克D 2 克答案:A解析:氢气还原氧化铜的化学方程式为:H₂+ CuO 加热 Cu +H₂O氧化铜的相对分子质量为 80,设需要氢气的质量为 xH₂+ CuO 加热 Cu + H₂O2 80x 8g2/80 = x/8g ,解得 x = 02g4、要制取 48 克氧气,至少需要分解多少克高锰酸钾?()A 474 克B 474 克C 948 克D 948 克答案:C解析:加热高锰酸钾制取氧气的化学方程式为:2KMnO₄加热K₂MnO₄+ MnO₂+ O₂↑高锰酸钾的相对分子质量为 158,氧气的相对分子质量为 32设需要分解高锰酸钾的质量为 x2KMnO₄加热 K₂MnO₄+ MnO₂+ O₂↑316 32x 48g316/32 = x/48g ,解得 x = 474g但需要注意的是,在实际实验中,高锰酸钾不能完全分解,所以至少需要 948 克高锰酸钾。

专题六常见的化学计算一、选择题1.(2017重庆中考B卷)某工厂制取漂白液的化学原理为:Cl2+2NaOH===NaCl+NaClO+H2O,在该反应中,氯元素没有呈现出的化合价是(A)A.+2 B.+1 C.0 D.-12.(2017嘉兴中考)谷氨酸钠(化学式为C5H8NO4Na)是味精的主要成分。
下列关于谷氨酸钠的说法错误的是(B)A.是一种有机物B.加热会产生含硫物质C.由五种元素组成D.碳、氢原子个数之比为5 83.(2017德阳中考)向盛有10 g某Cu—Al合金样品的烧杯中加入100 g稀硫酸,恰好完全反应,反应结束后,测得烧杯内物质的总质量为109.4 g。
则该合金样品中铜的质量分数是(C)A.73% B.54% C.46% D.27%4.(2017丽水中考)科技人员成功研制出一种新型催化剂,可将二氧化碳转化成液体燃料,反应的微观示意图如下。
有关该反应的说法正确的是(A)A.该反应属于化合反应B.反应前碳元素的化合价为+2价C.生成物的化学式可用C2H2O表示D.参加反应的两物质的质量比为1 15.(河南中考)相同质量的镁、铝、锌分别与相同质量20%的盐酸充分反应,产生氢气质量(直接用各金属表示)大小关系有以下几种猜测:①Mg>Al>Zn;②Al>Mg>Zn;③Al=Mg=Zn;④Al=Mg>Zn;⑤Al=Zn>Mg;⑥Al>Mg=Zn。
其中合理的个数为(C)A.5个 B.4个 C.3个 D.2个6.(2017广安中考)用足量的CO还原8.0 g某种铁的氧化物,生成的气体全部被足量的澄清石灰水吸收,得到沉淀12.5 g,则这种铁的氧化物可能是(C)A.FeOB.Fe2O3与Fe3O4的混合物C.FeO与Fe3O4的混合物D.Fe3O47.(贵港中考)硝酸钾在不同的温度下溶解度数据如表,下列说法错误的是(D)温度/℃0 20 40 60 80 100溶解度/g 13.3 31.6 63.9 110 169 246A.硝酸钾的溶解度受温度影响变化较大B.60 ℃时,饱和硝酸钾溶液中溶质与溶液质量之比为11∶21C.20 ℃时,10 g水中加入5 g硝酸钾充分溶解后再加入5 g水,前后溶质的质量分数不变D.将溶质质量分数为28%的硝酸钾溶液从60 ℃降温至20 ℃,没有晶体析出二、非选择题8.(天津中考)维生素C(化学式为C 6H 8O 6)主要存在于蔬菜、水果中,它能促进人体生长发育,增强人体对疾病的抵抗力。
铁及其化合物的化学方程式和离子方程式1、铁在氧气中燃烧:3Fe+2O2Fe3O4(Fe为+2和+3,黑色,磁性氧化铁)2、常温条件下铁锈的形成:4Fe+3O2+2H2O2[Fe2O3·H2O](不要求写方程式,知道铁锈的主要成分是Fe2O3,Fe为+3,红色)3、高温条件铁与氧气反应:2Fe+O22FeO(Fe为+2,黑色)4、铁在氯气中燃烧:2Fe+3Cl22FeCl3(Fe为+3)5、铁和硫共热:Fe+S FeS(Fe为+2)6、铁与水蒸气在高温条件下反应:3Fe+4H2O Fe3O4+4H27、铁与稀硫酸反应:Fe+H2SO4FeSO4+H2↑(金属与酸反应放H2,非氧化性酸,稀盐酸、稀硫酸)Fe+2H+Fe2++H2↑铁、铝与浓硫酸、浓硝酸发生钝化,钝化为化学反应,加热时继续反应铜与浓硫酸共热:Cu+2H2SO4Cu SO4+SO2↑+2H2O(推测Fe)■铜与浓硝酸共热:Cu+4HNO3(浓)Cu (NO3)2+2NO ↑+2H2O(推测Fe)离子方程式:■铜与稀硝酸共热:3Cu+8HNO3(稀) 3 Cu (NO3)2+2NO2↑+4H2O(推测Fe)离子方程式:8、铁与硫酸铜溶液反应:Fe+CuSO4FeSO4+Cu(Fe为+2,活泼性强的金属置换活泼性弱的金属)Fe+Cu2+Fe2++Cu铝与氯化亚铁溶液反应:2Al+3FeCl22AlCl3+3Fe(必须是+2铁的盐溶液)2Al+3Fe2+2Al3++3Fe9、氧化亚铁与稀硫酸反应:FeO+H2SO4FeSO4+H2O(碱性氧化物与酸反应)FeO+2H+Fe2++H2O氧化铁与稀盐酸反应:Fe2O3+6HCl2FeCl3+3H2O(碱性氧化物与酸反应)Fe2O3+6H+2Fe3++3H2O10、铝粉与四氧化三铁高温下反应:8Al+3Fe3O44Al2O3+9Fe铝和氧化铁高温下反应:2Al+Fe2O3Al2O3+2Fe(铝热反应)11、氧化铁与一氧化碳高温下反应:Fe2O3+3CO Fe+3CO2(高炉炼铁反应)12、氢氧化亚铁与稀硫酸(稀盐酸)反应:Fe(OH)2+H2SO4FeSO4+2H2O(酸碱中和反应)Fe(OH)2+2H+Fe2++2H2O氢氧化铁与稀硫酸(稀盐酸)反应:2Fe(OH)3+3H2SO4Fe2(SO4)3+6H2O(酸碱中和反应)2Fe(OH)3+6H+2Fe3++6H2O氢氧化亚铁与浓硫酸、浓硝酸、稀硝酸发生氧化还原反应:铁由+2变为+3)13、氢氧化亚铁在空气中被氧化:4Fe(OH)2+O2+2H2O4Fe(OH)314、氢氧化亚铁隔绝空气加热:Fe(OH)2FeO+H2O(碱受热分解,共性)加热氢氧化铁:2Fe(OH)3Fe2O3+3H2O15、氯化亚铁溶液中通入氯气:2FeCl2+Cl22FeCl32Fe2++Cl22Fe3++2Cl-氯化亚铁溶液中加入溴水:6FeCl2+3Br24FeCl3+2FeBr32Fe2++Br22Fe3++2Br-铁与氯化铁溶液反应:Fe+2FeCl33FeCl2(0、+2、+3转化)Fe+2Fe3+3Fe2+16、氯化亚铁溶液中加入氢氧化钠溶液:FeCl2+2NaOH Fe(OH)2↓+2NaCl4Fe(OH)2+O2+2H2O4Fe(OH)3 在空气中,现象:先生成白色沉淀,,迅速变为灰绿色,最终变为红褐色氯化亚铁溶液中加入氨水:FeCl2+2NH3·H2O Fe(OH)2↓+2NH4ClFe2++2NH3·H2O Fe(OH)2↓+2NH4+氯化铁溶液中加入氢氧化钠溶液:FeCl3+3NaOH Fe(OH)3↓+3NaClFe3++3OH-Fe(OH)3↓氯化亚铁溶液中加入氨水:FeCl3+3NH3·H2O Fe(OH)3↓+3NH4ClFe3++3NH3·H2O Fe(OH)3↓+3NH4+Fe(+2 )遇到氧化剂(浓H2SO4、浓HNO3、稀HNO3、MnO4-、HClO 、H2O2、Na2O2、CL2、Br2)发生氧化还原反应,变为+3Fe(+3 )遇到还原剂(H2S、HS-、SO2、SO32-、I-、金属单质)发生氧化还原反应,变为+217、氯化铁溶液中加入硫氰化钾溶液:FeCl3+3KSCN Fe(SCN)3+3KClFe3++SCN-Fe(SCN)2+(红色透明溶液)18、氯化亚铁溶液中加入硝酸银溶液:FeCl2+2AgNO3Fe(NO3)2+2AgCl↓(复分解反应)Ag++Cl-AgCl↓氯化亚铁溶液中加入硫化钠溶液:FeCl2+Na2S FeS↓+2NaClFe2++S2-FeS↓(黑色)。
专题六 综合计算题(中考第36题)类型一 文字叙述型(2013年考查)例1 (2019,十堰)将20.0 g 铜锌合金置于烧杯中,向其中逐渐加入稀硫酸,当加入148.4 g 稀硫酸时,不再有气体生成,此时测得烧杯中混合物的质量为168.0 g 。
请计算:(1)反应中生成气体的质量是__0.4__g 。
(1分)(2)求反应后烧杯溶液中溶质的质量分数。
(写出计算过程)【解析】 (1)锌和稀硫酸反应生成硫酸锌和氢气。
根据质量守恒定律可知:反应后减少的质量即为生成H 2的质量,故反应中生成气体的质量是148.4 g +20.0 g -168.0 g =0.4 g 。
(2)反应后烧杯溶液中溶质为ZnSO 4,把0.4 g 氢气的质量代入化学方程式中即可求得ZnSO 4的质量。
反应后烧杯中溶液的质量为:参加反应的锌粒质量+148.4 g 稀硫酸-生成氢气的质量。
再根据公式:溶质质量分数=溶质质量溶液质量×100%,求解即可。
对应训练1 (2019,鄂州)某同学为定量研究氢氧化钠溶液与盐酸反应,做了如下实验:取40 g 氢氧化钠溶液,加入到50 g 溶质质量分数为7.3%的稀盐酸中,恰好完全反应。
请计算:(1)氢氧化钠溶液中溶质的质量分数是__10%__。
(2)反应后所得溶液中溶质的质量分数。
(写出计算过程)解:设生成的氯化钠的质量为x 。
NaOH +HCl===NaCl +H 2O36.5 58.550 g ×7.3% x36.558.5=50 g ×7.3%xx =58.5×50 g ×7.3%36.5=5.85 g 反应后所得溶液中溶质的质量分数为 5.85 g 40 g +50 g×100%=6.5% 答:反应后所得溶液中溶质的质量分数为6.5%。
【解析】 (1)把50 g ×7.3%=3.65 g HCl 的质量代入反应NaOH +HCl===NaCl +H 2O 中,可求得NaOH 的质量为4 g ,故氢氧化钠溶液中溶质的质量分数是4 g 40 g×100%=10%。
最新初三化学化学方程式的计算题20套(带答案)一、中考化学方程式的计算1.某校学习小组测定酸碱中和反应。
他们向50g 8%的氢氧化钠溶液中加入100g的稀盐酸恰好完全反应,此时溶液的pH=7。
请你计算,所得溶液溶质的质量分数是多少?【答案】3.9%【解析】【分析】氢氧化钠和盐酸发生中和反应,生成氯化钠和水。
【详解】解:设生成氯化钠的质量为x。
2NaOH+HCl=NaCl+H O4058.550g8%x⨯4050g 8%=58.5xx=5.85g⨯所得溶液溶质的质量分数是5.85g100%=3.9% 50g+100g⨯答:所得溶液溶质的质量分数是3.9%。
【点睛】本题考查的是溶液与化学方程式的综合计算,难度不算大,但要学会运用化学方程式先求出溶质的质量,再利用溶质质量分数计算公式进行解答。
2.为测定某未知浓度的稀硫酸溶液的溶质质量分数,取20g该稀硫酸溶液,逐滴加入20%氢氧化钠溶液30g,同时用pH计测定并记录反应过程中混合溶液pH变化情况。
请回答下列问题。
(1)a点溶液中的溶质的化学式是______。
(2)通过计算求出稀硫酸中溶质的质量分数(计算过程中保留一位小数)______。
【答案】Na2SO4、NaOH 30.6%【解析】【分析】【详解】(1)氢氧化钠和硫酸反应生成硫酸钠和水,反应后的溶液中一定有硫酸钠,可能有氢氧化钠或硫酸,在a 点pH 大于7,所以氢氧化钠过量,在溶液中的溶质有:Na 2SO 4、NaOH ; (2)设20g 稀硫酸中溶质的质量为x242422NaOH +H SO =Na SO +2H O809825g 20%x⨯ 8025g 20%98x⨯= x=6.125g稀硫酸中溶质的质量分数为:6.125g 100%30.6%20g⨯≈ 答:稀硫酸中溶质的质量分数为30.6%。
3.(1)工业上若冶炼出含铁98%的生铁1000t ,至少用含氧化铁80%的赤铁矿石的质量是_________t 。