脊椎动物适用及禁用之麻醉及安乐死方法
- 格式:doc
- 大小:175.00 KB
- 文档页数:13


小鼠处死方法小鼠是一种常见的实验动物,广泛应用于医学、生物学等领域的实验研究中。
在实验完成后,需要对小鼠进行处死,以终止其生命。
正确的处死方法不仅可以减少小鼠的痛苦,还可以保证实验结果的准确性。
本文将介绍几种常见的小鼠处死方法,供大家参考。
1. 麻醉后处死。
首先,可以选择使用麻醉药物将小鼠进行麻醉,待小鼠完全失去知觉后,再使用适当的方法进行处死。
常见的麻醉药物包括异氟醚、氯仿等,这些药物可以迅速使小鼠陷入麻醉状态,减少其痛苦。
在小鼠完全失去知觉后,可以选择采用颈部脱臼、颈椎切断等方法进行处死。
这种方法可以确保小鼠在没有任何痛苦的情况下结束生命。
2. 窒息处死。
另一种常见的小鼠处死方法是利用二氧化碳或一氧化碳进行窒息。
将小鼠置于密闭的容器中,注入适量的二氧化碳或一氧化碳,待小鼠呼吸困难,最终窒息死亡。
这种方法可以快速、有效地结束小鼠的生命,减少其痛苦。
在使用二氧化碳或一氧化碳进行处死时,需要注意控制浓度和时间,以确保处死的效果和速度。
3. 颈椎切断。
颈椎切断是一种常见的小鼠处死方法,适用于需要获取小鼠脑组织样本的实验。
在进行颈椎切断时,需要将小鼠固定在手术台上,用手术刀迅速切断颈椎,使小鼠立即丧失知觉并死亡。
这种方法需要专业人员操作,以确保操作的准确性和速度,避免小鼠产生痛苦。
4. 麻醉药物注射。
除了麻醉后处死外,也可以选择直接使用麻醉药物进行注射处死小鼠。
将适量的麻醉药物注射到小鼠体内,使其迅速失去知觉并死亡。
这种方法需要注意药物的剂量和注射部位,以确保小鼠在短时间内安全、无痛苦地结束生命。
总之,正确的小鼠处死方法可以减少小鼠的痛苦,保证实验结果的准确性。
在进行处死操作时,需要严格遵守实验室的规定和操作流程,以确保小鼠在最短的时间内安全、无痛苦地结束生命。
希望本文介绍的小鼠处死方法对大家有所帮助,谢谢阅读。

动物临终关怀及安乐死技术动物临终关怀及安乐死技术是现代兽医学领域的重要课题,涉及到对动物的尊重和福祉保障。
在动物生命走到尽头之际,提供适当的终末关怀和人道的安乐死选择,对于减少动物痛苦,最大程度地保护它们的身心健康,具有重要意义。
本文将介绍动物临终关怀及安乐死技术的相关概念、原则、实施方法以及其引发的伦理问题。
一、动物临终关怀的概念与原则动物临终关怀(end-of-life care)是指在动物生命接近终点的阶段,为其提供身体和心理上的照顾与支持。
其目的是尊重动物生命的尊严,减缓痛苦,提升生命质量,并在可能的情况下为其提供合适的安乐死措施。
在进行动物临终关怀时,有以下原则需要遵守:1. 尊重与真诚:将动物视为有感情和有尊严的个体,对其予以关怀和尊重。
与动物主人保持真诚沟通,听取他们的意见和要求。
2. 疼痛管理:提供适当的疼痛管理,包括药物和非药物疼痛缓解方法。
例如,为动物提供合适的镇痛药物,减轻其身体痛苦。
3. 舒适与安抚:为动物提供舒适的环境,例如柔软的床铺、安静的空间以及温暖的气温。
提供适当的安慰,如轻柔的触摸和温暖的饮食。
4. 饮食与水分管理:根据动物的需求,提供合适的饮食和水分管理。
在必要时,根据兽医的建议,进行管饲或其他形式的喂食。
5. 合适的安乐死选择:在经过充分沟通和谨慎考虑后,为无法继续生存或生活质量严重受损的动物提供合适的安乐死选择,以减少其痛苦和苦闷。
二、动物安乐死技术的实施方法动物安乐死技术(euthanasia)是指通过医学手段帮助动物在无痛苦、压力和不适的情况下终止生命。
在实施动物安乐死技术时,需要遵循以下步骤和原则:1. 兽医评估:由专业兽医对动物进行评估,确定其需求和是否适合安乐死。
2. 与动物主人协商:与动物主人充分沟通,了解其意见和决定,并解答其提出的问题。
3. 安静环境:将动物放置在安静、熟悉和舒适的环境中,以减少其压力和不适感。
4. 镇静与麻醉:在适当的情况下使用镇静剂和麻醉剂,确保动物处于无痛苦和无意识的状态。

常用实验动物各种处死方法常用实验动物的处死方法是一种引起争议的话题。
在科学研究中,使用动物模型进行实验是不可避免的,但是对动物的使用和处死方法必须符合伦理标准和法律规定。
本文将介绍一些常用的实验动物处死方法,强调保证动物福利和尽量减少痛苦的重要性。
1. 简易离心机方法(Centrifugation Method)这是一种常见的小鼠和大鼠处死方法。
动物被放置在特殊的容器中,在高速旋转的离心机中进行离心,使动物体内的重要器官和系统被破坏。
这种方法通常会导致极大的痛苦和压力,也可以造成很大的心理压力。
因此,在使用这种方法时应严格限制和监督,确保最小化动物的痛苦。
2. 窒息法(Asphyxiation)这是一种常见的处死方法,特别适用于小鼠和大鼠。
通过将动物置于低氧或无氧环境中,阻止动物的呼吸,引起动物失去意识并最终死亡。
常见的方法包括使用二氧化碳(CO2)或一氧化碳(CO)。
这种方法相对低成本且生物安全,但可能导致动物焦虑和痛苦。
因此,在使用这种方法时,应使用始终使用适当的麻醉或镇痛剂。
3. 麻醉和安乐死(Anesthesia and Euthanasia)在一些情况下,使用药物麻醉和安乐死是最常见的处死方法。
这种方法通常仅用于需要采集特定器官和组织或执行特定实验的情况下。
具体方法包括使用麻醉药物使动物进入无意识状态,然后再使用致死剂量的药物使动物死亡。
这种方法相对较安全且无痛苦,但需要遵循严格的操作规程和众多的道德和法律要求。
麻醉和镇痛剂的使用也需要注重药物的效力和剂量,以减少动物的痛苦。
需要强调的是,处死动物的目的是为了避免动物承受不必要的痛苦。
在进行实验动物处死时,应确保尊重动物的福利,遵循伦理规范和法律法规,使用最安全和无痛苦的方法。
此外,为了减少动物使用和处死,在科学研究中应不断推广和使用替代动物模型、技术和方法。
总之,正确使用实验动物处死方法是确保科学研究的必要步骤,但同时也是一个需要反思和努力完善的领域。

动物安乐死的常用方法
动物安乐死是指出于对动物病痛的考虑,通过一种无痛的方式终止其生命。
以下是常用的动物安乐死方法:
1. 注射安乐剂:通常使用安乐剂(euthanasia solution)通过静脉注射的方式。
安乐剂包括巴比妥类药物(如硫喷妥钠)或药效类似的大剂量酒精等。
这些药物可以迅速导致动物体内的功能停止,使动物无痛地进入昏迷和死亡。
2. 二氧化碳气体:将动物置于一个密封的容器中,通过通入高浓度的二氧化碳气体来使动物窒息死亡。
这种方法也被称为“进入静室”(entering the chamber)。
3. 高温、高湿热处理:这种方法适用于小型动物,如无脊椎动物和小鼠等。
将动物放入高温高湿的环境中,使其迅速死亡。
这种方法可以通过高温烘箱或高温蒸煮等方式实现。
4. 电击:这种方法通常在注射安乐剂无法实施或不适用的情况下使用。
通过施加电流使动物瞬间失去知觉和生命。
这些方法在使用时应该符合相关的道德和法律要求,并由专业的兽医或合格的动物保护人士进行操作。
在使用安乐死方法时应该优先考虑最小化动物的痛苦和不
适。
详细介绍对动物进行安乐死方法动物安乐死是指出于合法、合理和人道的目的,对患有严重疾病、无法治愈且生活质量严重受损的动物进行无痛苦、无恐惧的死亡处理。
安乐死的目的是减轻动物痛苦,保证其尊严和福利。
下面将详细介绍常见的动物安乐死方法。
1.注射安乐死药物:这种方法是最为常用和推荐的安乐死方式。
通常使用的药物是“伊非必可(Euthasol)”,主要成分是盐酸消旋盐酸甲基阿噁唑酮和盐酸异戊巴比妥。
这两种药物的混合剂是一种安全有效的麻醉剂和镇静剂,能够快速而无痛苦地让动物处于昏迷状态,然后停止呼吸和心跳。
该药物通过静脉或肌肉注射的方式给予动物,通常在静脉注射下效果更佳。
该过程需要专业的兽医参与,以确保药物剂量的准确和动物的安全。
注射后,动物通常会陷入无知觉的睡眠状态,然后最终停止呼吸和心跳,实现无痛苦的死亡。
2.气体麻醉:在一些情况下,比如大面积疾病爆发时,一次性需要处理大量动物,如家禽或实验室鼠,使用气体麻醉可以更有效地完成任务。
常用的气体麻醉剂包括二氧化碳、氮气和一氧化碳。
动物置于一个相对封闭的容器中,然后与麻醉剂接触,通常是通过调节气体浓度和暴露时间来实现的。
这种方法的效果取决于麻醉剂的浓度和动物对其的敏感程度。
然而,使用气体麻醉剂也存在一些问题,如引起动物焦虑、恐惧和窒息感。
因此,必须确保气体浓度逐渐上升以减少动物不适感,并确保动物无痛苦地死去。
需要注意的是,气体麻醉只适用于大规模、集中方式进行安乐死的情况,不适用于个体动物。
3.精神安乐死:精神安乐死是指通过使用具有镇痛、抗焦虑和镇定作用的药物,让动物处于无痛苦、舒适和安详的状态,然后在其自然死亡之前提供关闭护理。
这种方法常用于老年动物或无法注射药物的情况下。
通过在动物的饮用水或食物中添加安乐死药物,比如苯巴比妥钠,可以实现精神安乐死。
然后,在动物原本享有的自然环境中提供舒适和尊严的护理,直到其自然死亡。
总结而言,动物安乐死的主要方法包括注射安乐死药物、气体麻醉和精神安乐死。
第1篇一、引言实验动物在科学研究和医学实验中扮演着重要角色。
然而,实验动物的处死问题一直备受关注。
为了规范实验动物的处死行为,保障实验动物的福利,我国制定了相关法律规定。
本文将详细阐述实验动物处死的法律规定。
二、实验动物处死的原则1. 尊重生命原则:实验动物的处死必须尊重生命,不得随意或残忍地对待实验动物。
2. 道德原则:实验动物的处死应当遵循道德原则,不得违反社会公德。
3. 科学原则:实验动物的处死应当遵循科学原则,确保实验结果的准确性。
4. 福利原则:实验动物的处死应当尽量减少其痛苦,保障实验动物的福利。
三、实验动物处死的法律依据1. 《中华人民共和国动物保护法》《中华人民共和国动物保护法》第二十条规定:“禁止非法猎捕、杀害、买卖、运输、利用、食用野生动物,禁止虐待、遗弃、丢弃动物。
”2. 《中华人民共和国实验动物管理条例》《中华人民共和国实验动物管理条例》第三十二条规定:“实验动物处死应当符合人道原则,采取适当的处死方法,尽量减少动物的痛苦。
”3. 《实验动物福利法》《实验动物福利法》第二十一条规定:“实验动物处死应当符合人道原则,采取适当的处死方法,尽量减少动物的痛苦。
”四、实验动物处死的方法1. 非人道处死方法(1)电击法:将实验动物置于电击器中,通过电流使实验动物死亡。
(2)窒息法:将实验动物置于密闭容器中,使其窒息死亡。
(3)吊杀法:将实验动物悬挂于高处,使其死亡。
2. 人道处死方法(1)过量麻醉法:给实验动物注射过量麻醉剂,使其失去意识后死亡。
(2)心脏穿刺法:通过心脏穿刺使实验动物死亡。
(3)空气栓塞法:通过注入空气使实验动物死亡。
五、实验动物处死的程序1. 实验动物处死前,应当取得实验动物的福利委员会的批准。
2. 实验动物处死时,应当由经过培训的专业人员操作。
3. 实验动物处死过程中,应当尽量减少动物的痛苦。
4. 实验动物处死后,应当对尸体进行妥善处理。
六、违反实验动物处死法律规定的法律责任1. 违反《中华人民共和国动物保护法》第二十条,非法猎捕、杀害、买卖、运输、利用、食用野生动物,虐待、遗弃、丢弃动物的,由公安机关依法给予行政处罚;构成犯罪的,依法追究刑事责任。
详细介绍对动物进行安乐死方法实验动物安乐死问题一直困扰着动物实验工作者,什么是安乐死技术或方法? 如何实施安乐死?怎样的安乐死方法才能既保证动物福利、符合伦理道德准则,又对实验者方便实用? 本文根据美国兽医学会(AVMA) 关于安乐死的评价准则阐述实验动物实施安乐死的若干问题。
1 什么是安乐死安乐死一词来源于希腊文“eu”,意思是“平安和有意义的死亡”。
平安死亡意味着微量的疼痛和痛苦(pain and distress)。
实验动物科学中的安乐死指的是对实验动物实施的人道处死( humane death)。
因为实验动物作为人类的替难者用于各种科学实验,人类有义务给予实验动物足够的尊敬,处死动物时尽可能减少动物的疼痛和痛苦。
安乐死技术很难做到完全没有疼痛和痛苦,但通过改善实施安乐死的环境条件和熟练掌握技术可以减少动物的痛苦。
从定义中可以看出,安乐死技术包含两个方面的内容,一是减少疼痛,二是减轻痛苦。
减少疼痛要求建立无疼痛死亡技术,减轻痛苦要求尽量减少动物感知(丧失意识)。
2 安乐死技术( 方法) 介绍药物方法:药物安乐死技术方法的原理有:直接或间接缺氧、生命功能的神经元抑制和大脑活动或生命功能神经元的直接破坏。
直接或间接缺氧。
可以在任何地方完成,并且可以依不同速率造成动物意识丧失。
没有疼痛和痛苦的死亡一定是意识丧失先于动作消失(肌肉活动消失),而动作消失不等于意识丧失和没有痛苦发生。
因此,导致肌肉麻痹而不能造成意识丧失的安乐死药物(例如去极化或非去极化的肌肉松弛剂,士的宁、烟碱、镁盐等)不能作为安乐死的单一方法。
生命功能的神经元抑制。
药物首先抑制大脑神经元随后导致动物死亡。
某些药物在实施过程中会使动物处于一种所谓激动躁狂期,可能发出叫声或肌肉收缩。
但这不是有目的的,随着意识丧失马上死亡,原因是心脏停止跳动造成呼吸中枢供氧不足。
大脑活动或生命功能神经元的直接破坏。
来源于直接冲击破坏大脑或大脑神经元去极化可以使动物马上丧失意识。
脊椎动物适用及禁用之麻醉及安乐死方法一、前言动物安乐死的目的是以人道的方式使动物死亡,它以最低程度的疼痛、最短的时间使动物失去知觉和痛觉。
在2000 Report of the A VMA Panel on Euthanasia 中详细介绍了动物安乐死的各种方法和优缺点,本文仅对脊椎动物于科学、教学及试验应用范围内提供建议方法。
(一)以安乐死作为解除疼痛的选择如无法以其它方式解除动物的疼痛(pain)或窘迫(distress)时,建议施予安乐死。
在科学研究中,如动物的死亡是可预期或必然的实验结果,则研究者应依据病理、生理或行为面详加叙述动物实验的终点(end points),除非安乐死确实影响实验结果,否则应在动物呈现垂死、死后组织自体溶解、或死后被笼内其它同类相食前以人道的方式解决。
安乐死不但可以解决动物遭受严重疼痛,并可透过完整的尸体解剖更近一步了解动物的状态,有助于实验之进行。
(二)执行安乐死的时机一般而言选择安乐死的考虑因素有:动物体重下降、消瘦、成长期动物未增重、无法有效控制的疼痛、过度的肿瘤增长或腹水产生、持续性的自残行为、疾病造成的全身性脱毛、因实验因素无法治疗的长期下痢、严重呼吸道感染、持续性的倦怠伴随粗造的皮毛、拱背、腹围扩大、四肢无法行走、严重贫血、黄疸、异常的中枢神经反应(抽蓄、颤抖、瘫痪、歪头等)、无法控制的出血现象、排尿异常(无尿、多尿等)、影响进食饮水的病症、传染性疾病末期、严重低温、明显的功能损伤、动物遭受长期窘迫时的行为及生理现象等。
各机构的动物实验管理委员(IACUCs)、研究人员、兽医师、研究部门主管应对实验动物的终点(end points)、以及何时执行动物安乐死等方面共同拟定该机构之政策。
(三)安乐死:技术以及对执行者的冲击由于动物失去知觉与死亡的时间点不尽相同,且有些如静脉注射或断头等方法需较高的技巧,难以由未接受训练的人员立刻操作、或者决定动物是否遭受疼痛或失去知觉。
各机构的动物实验管理委员(IACUCs)与兽医师应建立人员训练计划,使人员学习正确的安乐死技术、了解动物安乐死的目的,并安排人员间的相互讨论,以舒解可能的心理紧迫。
(四)避免造成其它动物的恐惧感窘迫的叫声、恐惧的行为、惊吓动物的费洛蒙气味等,皆引起其它动物的焦虑和不安,这些因素会影响存活动物的身心平衡与福祉,干扰实验结果。
因此,动物安乐死时,最好选择远离同种动物的非公开场所来执行。
(五)辅助执行安乐死动物安乐死首要考虑为解除动物的疼痛与窘迫,因此面对神经质或难以驾御的动物,可先给予镇定剂或止痛剂等药物,以便降低动物的紧迫与恐惧。
(六)确认死亡确认动物是否死亡是非常重要的事项。
执行安乐死后人员需检查动物的心跳是否完全停止。
停止呼吸不能作为判断死亡的依据,动物往往先停止呼吸,数分钟之后才停止心跳,尤其是使用二氧化碳进行安乐死时,需特别注意。
二、选择安乐死的药物与方法动物安乐死的方法取决于品种,大小,温驯度,兴奋度,对疼痛、窘迫、疾病的感受性,保定方法,实验是否需组织采样及其它因素。
适当的物理性保定不仅可减低动物的恐惧、焦虑及疼痛,并可保障操作人员的安全。
另外,人员的技术、动物的数量亦为安乐死程序是否顺利完成的重要因素。
选择安乐死药物与方法的准则:●使动物无疼痛、窘迫、焦虑、不安的失去知觉至死亡的能力●失去知觉至死亡花费的时间●可靠性●对操作人员的安全性●不可逆性●对操作和观察人员的情绪影响●对其后的评估、检验、组织应用的适合性●对品种、年龄、健康状况的适合性●价格与可利用性●效能与操作方便性●对环境的冲击●人滥用药物的潜在性安乐死的药物与方法有三类:吸入性药剂、非吸入性(化学性)药剂、物理性方法。
安乐死时最好先抑制动物的中枢神经而使其失去知觉,解除疼痛感。
因此,首选为使用过量的化学性麻醉药剂。
动物一旦被施予深度麻醉,之后使用的安乐死方法选择性较多,也较人道。
如因科学研究所需无法使用麻醉剂,则使用物理性安乐死方法。
(一)吸入性药剂常见药物如乙醚、halothane、methoxyflurane、isoflurane、enflurane、氮气、一氧化碳、二氧化碳等麻醉药剂。
通常藉由气麻机或可透视的密闭容器执行体重低于7公斤的小型哺乳动物与鸟类安乐死,由于仔兽对缺氧状态耐受性高,吸入药剂的时间需延长3-5倍,亦可配合其它方法共同进行。
大部分的吸入性药剂对人体有害,因此需在通风良好场所执行。
乙醚具有易燃、易爆的性质,通常不建议使用。
如因特殊需求而使用乙醚进行动物安乐死,则全程需在抽气柜内操作,动物尸体需置于防爆冰柜内。
氯仿对人具有肝毒性和致癌性,一氧化碳对人员有害,因此不建议使用。
二氧化碳是实验动物常用的吸入性安乐死药剂,吸入40%二氧化碳时很快达到麻醉效果,而长时间持续吸入时可导致动物死亡。
它容易使用、价格便宜、无易燃易爆性、无异味,在通风良好的场所使用时较其它药剂更安全。
利用高压桶装的二氧化碳,使用时先将适量二氧化碳灌入安乐死箱底部,再放入动物,之后再缓慢持续加入二氧化碳,可减低动物死亡前的焦虑。
动物停止呼吸后至少在箱内停留5-6分钟,检查动物确实死亡,之后再移除动物。
每次操作时注意安乐死箱内勿过度拥挤,并且使用透视性佳的箱子,以便易于确认动物死亡。
(二)非吸入性药剂多数为注射性药物,此类药剂有多种投与方法,但是静脉注射是最佳选择。
如需给予心脏注射,需先学习相关技术,否则如因操作不当而使药物泄漏至胸腔或肺脏时,会导致动物痛苦、并延长死亡时间,因此只有在动物已呈现垂死、休克、或深度麻醉中才给予心脏注射。
腹腔注射需使用较高剂量的药物,而且可能使动物死亡时间延长及死前挣扎。
巴比妥盐及其衍生物是动物安乐死的首选药物。
它人道、安全、正确投药时效果迅速,静脉注射时可使动物安详的沉睡至死。
巴比妥盐及其衍生物中sodium pentobarbital 的效果最佳,目前广泛使用于大部分动物的安乐死。
使用此类药剂的缺点为必需每只动物个别保定后投予,且操作人员须具有动物静脉注射技术,由于可能造成人类滥用,此类药剂需经管制药品管理局申请核准后取得及使用。
对于难以驾御或过度神经质的动物,须先给予适当的镇定后注射。
经药物镇定后的动物由于循环及心跳变慢,对于pentobarbital药物注射后的反应时间比直接投药来的慢,需特别注意。
深度麻醉中的动物可利用快速静脉注射KCl(2mmol/ kg)来完成安乐死,但未麻醉动物禁止直接注射KCl。
其它如KetamineHCl、xylazine、opiods等注射性药物,虽然高剂量注射时亦可使动物死亡,但由于死亡前动物常呈现疼痛及抽蓄现象,因此建议仅使用于动物的一般性保定、镇定、止痛及麻醉,勿做为动物安乐死用药剂。
(三)物理性方法包括颈椎脱臼、断头、放血、枪击、电击等。
物理性安乐死法在下列三种情形下评估使用:其解剖性状适合使用此法的小型脊椎动物;大型农场动物;其它安乐死方法会影响实验结果时。
有些人抗拒并排斥物理性方法,但是只要在良好的技巧与适当的工具配合下,它能迅速使动物解除疼痛并死亡。
如未受过训练的人冒然实施物理性方法,不仅易造成人员受伤,更可能使动物未完全死亡而导致极大的痛苦。
有些物理性方法,如电击等,则需配合使用第二种方法(如放血)或重复电击来完成安乐死。
所有操作人员需接受完整的技术训练,并以尸体多次练习后才正式执行。
颈椎脱臼法常使用于体重低于200公克的囓齿类动物、禽类、以及体重低于1公斤的仔兔。
透过正确的训练技巧,人员可迅速将动物的颈椎与脊椎脱离,使动物死亡。
除非有特殊实验需求,执行颈椎脱臼前动物应先给予镇定或吸入二氧化碳,以减低动物的窘迫。
对于小型囓齿类动物,利用杆子或拇指食指压住头颈部,用另一只手抓住尾巴,迅速用力向后拉扯后驱,使颈椎脱离头颅;对于禽类,双手抓取脖子扭断;对于仔兔,一手抓头,另一手抓后肢,将身体迅速拉长,使颈椎脱离头颅。
因实验需求无法使用化学性药剂或二氧化碳实施安乐死时,可利用断头台(guillotine)砍断小型囓齿类动物或仔兔的头颈部。
实施此法易造成人员的不适,亦较具危险性,因此需接受完整的技术训练。
人员需温柔稳固的保定动物,快速地利用断头台将头颈连接处砍断。
注意需随时保持断头台刀片的锐利度,并在每次使用后彻底清洗残留的血迹和气味。
如因实验所需采集动物的全身血液或放血,动物需先麻醉或失去知觉后执行。
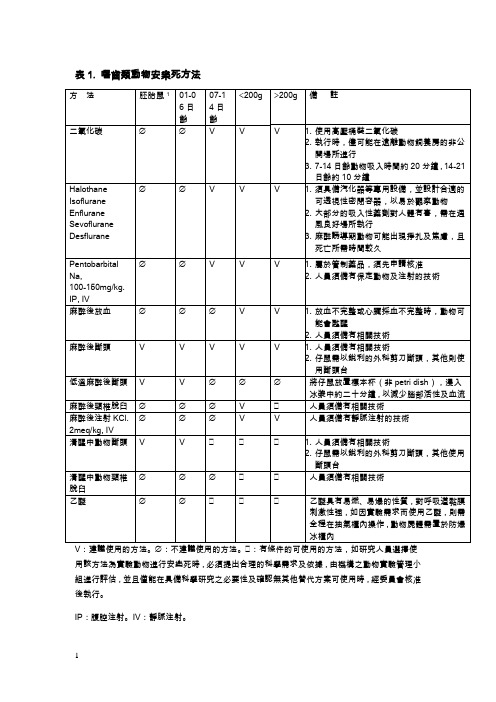
三、适用之安乐死方法(一)一般常用脊椎动物说明:1. ○:建议使用的方法;×:不得使用的方法;△:一般情况不推荐使用,除非实验需要(需说明于动物实验申请表,由IACUC审核通过后使用)。
2. Barbiturate 巴比妥盐类注射剂属管制药品,需事先洽行政院管制药品管理局申请核可后购买使用。
Ketamine不得作为Barbiturate巴比妥盐的替代品注射于动物安乐死。
3. 出生仔鼠对二氧化碳(缺氧)耐受性高,建议安乐死方法为将仔鼠装入塑料袋,灌满二氧化碳,绑紧塑料袋,置入-15℃冰柜内。
(二)其它脊椎动物:(三)巴比妥盐类(Barbiturate)之安乐死剂量(mg/kg):注1:一般动物以麻醉剂量的3倍剂量为安乐死剂量注2:数据取材自(1)2000 Report of the AVMV Panel on Euthanasia。
(2)。
(3)/animal/?get=euthanasia附录1 二氧化碳动物安乐死法:(1)放入动物前,先灌注CO2于压克力箱(或PC盒)内20-30秒.关闭CO2 .放入动物。
(2)再灌注CO2于箱内约1-5 分钟(兔子需较久时间),确定动物不动、不呼吸、瞳孔放大.关闭CO2 .再观察2分钟,确定死亡。
(3)动物尸体以不透明感染性物质专用塑料袋包装、储藏至冷冻柜后依法焚烧处理。
附录2 乙醚动物安乐死法:(1)乙醚为易挥发,易燃,易爆炸,具致癌性,有眼鼻刺激性之危险物品, 其保存及使用皆应有适当之场所设备及标准操作程序或指示方法(如防燃之安全抽风柜, 密闭容器等) 。
(2)施行于少量,小型实验动物 (如大鼠,小鼠等) 为可以接受之安乐死方法。
(3)动物尸体之处理仍有安全顾虑,置放于冰箱冰柜焚化器中皆应特别注意(动物尸体应于安全抽风柜中暴露至少30分钟,确认死亡后再置于密封之塑料袋中;动物尸体应尽快清除,不宜置放过久) 。
(4)乙醚易溶于血中,其引发之安乐死较为耗时。
四、脊椎动物禁止使用之死亡方法11资料来源:669 Report of the AVMA Panel on Euthanasia JAVMA, Vol 218, No. 5, March 1, 200113。