高三化学有机化学复习专题
- 格式:ppt
- 大小:420.50 KB
- 文档页数:8

高三化学有机知识点一、有机化学概述有机化学是研究含碳化合物的化学分支,它不仅包括对有机化合物的结构、性质、合成方法的研究,还涉及生物体内的生物化学过程。
在高中化学的教学中,有机化学占据了重要的地位,尤其是在高三阶段,学生需要掌握大量的有机化学知识点,为将来的高考和更深层次的学术研究打下坚实的基础。
二、有机化合物的基本特性有机化合物通常具有以下特性:首先,它们含有碳元素,这是区分有机化合物和无机化合物的基本标准。
其次,有机化合物往往具有较低的熔点和沸点,易溶于有机溶剂,难溶于水。
此外,有机化合物的反应速度通常较慢,且反应机理复杂,需要通过详细的机理研究来理解。
三、有机化合物的分类有机化合物可以根据其结构和功能团进行分类。
常见的分类包括烃、卤代烃、醇、酚、醚、醛、酮、羧酸、酯、胺等。
每一类有机化合物都有其独特的化学性质和反应类型,学生需要对每一类化合物的特点进行深入的了解和学习。
四、有机化学反应类型有机化学反应类型繁多,主要包括取代反应、加成反应、消除反应、氧化反应、还原反应等。
取代反应是指一个原子或基团被另一个原子或基团所取代的反应;加成反应是指两个或多个分子结合形成一个新分子的反应;消除反应是指有机分子中一个或多个小分子的离去,形成双键或三键的反应;氧化反应是指有机分子中增加氧或失去氢的反应;还原反应则与氧化反应相反,是指有机分子中减少氧或增加氢的反应。
五、有机化学的实验操作在高三化学的学习中,实验操作是理解有机化学知识的重要途径。
通过实验,学生可以直接观察有机化学反应的过程和结果,加深对理论知识的理解。
常见的有机化学实验包括蒸馏、萃取、重结晶、色谱分析等。
在进行实验操作时,学生需要注意实验安全,严格遵守实验室规则,正确使用实验器材和化学试剂。
六、有机化学的应用有机化学在日常生活和工业生产中有着广泛的应用。
例如,塑料、合成纤维、橡胶等高分子材料的生产离不开有机化学;药物的合成、食品添加剂的开发、环境污染物的处理等也都涉及到有机化学的知识。
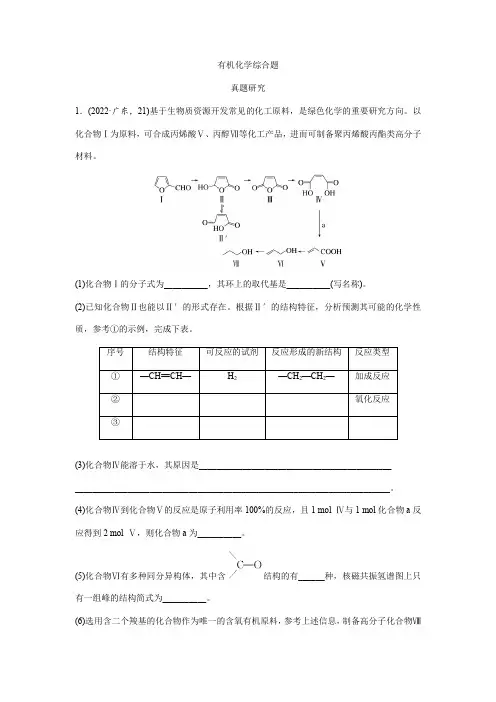
有机化学综合题真题研究1.(2022·广东,21)基于生物质资源开发常见的化工原料,是绿色化学的重要研究方向。
以化合物Ⅰ为原料,可合成丙烯酸Ⅴ、丙醇Ⅶ等化工产品,进而可制备聚丙烯酸丙酯类高分子材料。
(1)化合物Ⅰ的分子式为__________,其环上的取代基是__________(写名称)。
(2)已知化合物Ⅱ也能以Ⅱ′的形式存在。
根据Ⅱ′的结构特征,分析预测其可能的化学性质,参考①的示例,完成下表。
(3)化合物Ⅳ能溶于水,其原因是____________________________________________________________________________________________________________________。
(4)化合物Ⅳ到化合物Ⅴ的反应是原子利用率100%的反应,且1 mol Ⅳ与1 mol化合物a反应得到2 mol Ⅴ,则化合物a为__________。
(5)化合物Ⅵ有多种同分异构体,其中含结构的有______种,核磁共振氢谱图上只有一组峰的结构简式为__________。
(6)选用含二个羧基的化合物作为唯一的含氧有机原料,参考上述信息,制备高分子化合物Ⅷ的单体。
Ⅷ写出Ⅷ的单体的合成路线__________(不用注明反应条件)。
2.(2021·福建,15)帕比司他是治疗某些恶性肿瘤的药物,其中间体(E)的合成路线如图所示:回答下列问题:(1)A 分子含有的官能团名称为________。
(2)反应Ⅱ分两步进行:B ―――――→CH 2(COOH )2PyC C 。
第一步反应为加成反应,则C 的结构简式为________________________________________________________________________; 第二步脱水的反应属于____________(填反应类型)。
(3)若反应Ⅲ加热温度太高,CH 3OH 自身反应生成的副产物为________(填名称)。


高三化学有机物知识点总结
以下是高三化学有机物知识点的一些总结:
有机化学是研究碳及其化合物的科学。
有机化合物的分类、命名原则和方法以及各种化合物的结构与性质是高三必修三中的重要内容。
了解有机化学反应常见的机理和应用,对于学生的化学思维能力和解题能力的提升具有重要意义。
高中有机化学知识点是历年高考必考内容之一,例如有机物的分类、结构与组成、有机反应类型、有机物的相互转化、有机物的制取和合成以及石油化工、煤化工等。
常见的官能团及名称:—X(卤原子:氯原子等)、—OH(羟基)、—CHO(醛基)、—COOH(羧基)、—COO—(酯基)、—CO—(羰基)、—O—(醚键)、C=C (碳碳双键)、—C≡C—(碳碳叁键)、—NH2(氨基)、—NH—CO—(肽键)、—NO2(硝基)。
常见有机物的通式:烷烃:CnH2n+2;烯烃与环烷烃:CnH2n;炔烃与二烯烃:CnH2n-2;苯的同系物:CnH2n-6;饱和一元卤代烃:CnH2n+1X;饱和一元醇:CnH2n+2O或CnH2n+1OH;苯酚及同系物:CnH2n-6O或CnH2n-7OH;醛:CnH2nO 或CnH2n+1CHO;酸:CnH2nO2或CnH2n+1COOH;酯:CnH2nO2或CnH2n+1COOCmH2m+1。

高三专题复习:有机化学的反应类型重要有机反应类型取代反应、加成反应、消去反应、聚合反应(含加聚反尖和缩聚反应)、氧化反应、还原反应 一、取代反应1.概念:有机物分子里某些原子或原子团被其它原子或原子团所代替的反应。
2.常见能发生取代反应的官能团有:醇羟基(-OH )、卤原子(-X )、羧基(-COOH )、酯基(-COO -)、肽键(-CONH -)等。
3.常见能发生取代反应的有机物如下图所示:(1)卤代反应:烃分子的氢原子被—X 所取代的反应。
(2)硝化反应:苯分子里的氢原子被—NO 2所取代的反应。
(3)磺化反应:苯分子里的氢原子被硫酸分子里的磺酸基(—SO 3H )所取代的反应。
(4)酯化反应:酸和醇起作用生成酯和水的反应。
羧酸和醇的酯化反应的脱水方式是“酸脱羟基醇脱氢”。
这种反应的机理可通过同位素原子示踪法进行测定。
(5)水解反应:一般指有机化合物在一定条件下跟水作用生成两种或多种物质的化学反应。
水解反应包括卤代烃水解、酯水解、糖水解、蛋白质水解。
其中皂化反应也属于水解反应。
皂化反应是指油脂在有碱存在的条件下水解,生成高级脂肪酸钠和甘油的反应。
取代反应 烃的卤代苯的磺化醇与氢卤酸的反应 酯化反应水解反应 醇、氨基酸等分子间的脱水苯的硝化塑料注意水解反应发生时有机物的断键部位,如乙酸乙酯水解时是与羰基相连的C -O 键断裂。
(蛋白质水解,则是肽键断裂) 二、加成反应1.能发生加成反应的官能团:碳碳双键、碳碳三键、苯环、羰基(醛、酮)等(包括:加水、加卤素、加氢、加卤化氢等) 2.加成反应有两个特点:(1)反应发生在不饱和的键上,不饱和键中不稳定的共价键断裂,然后不饱和原子与其它原子或原子团以共价键结合。
(2)加成反应后生成物只有一种(不同于取代反应)。
说明:(1)羧基和酯基中的碳氧双键不能发生加成反应。
(2)醛、酮的羰基与H 2发生加成反应,与其它物质一般难于加成。
三、加聚反应1.本质:通过自身加成反应形成高分子化合物。

高三总复习—有机化学专题第六讲高分子化合物和有机合成一、知识要点1.高分子化合物的概念高分子化合物是相对小分子而言的,相对分子质量达几万到几百万甚至几千万,通常称为高分子化合物,简称高分子。
大部分高分子化合物是由小分子通过聚合反应制得的,所以常被称为聚合物或高聚物。
2.高分子化合物的结构特点(1)高分子化合物通常结构并不复杂,往往由简单的结构单元重复连接而成。
如聚乙烯中:①聚乙烯的结构单元(或链节)为—CH2—CH2—。
②n表示每个高分子化合物中链节重复的次数,叫聚合度。
n越大,相对分子质量越大。
③合成高分子的低分子化合物叫单体。
如乙烯是聚乙烯的单体。
(2)根据结构中链节连接方式分类,可以有线型结构和体型结构。
①聚乙烯、聚氯乙烯中以C—C单键连接成长链。
②淀粉、纤维素中以C—C键和C—O键连接成长链。
(这些长链结构相互缠绕使分子间接触的地方增多,分子间的作用就大大增加)③硫化橡胶中,长链与长链之间又形成键,产生网状结构而交联在一起。
3.高分子化合物的基本性质(1)溶解性:线型结构高分子(如有机玻璃)能溶解在适当的有机溶剂里,但溶解速率比小分子缓慢。
体型结构高分子(如橡胶)则不易溶解,只有一定程度的胀大(溶胀)。
(2)热塑性和热固性:加热到一定温度围,开始软化,然后再熔化成可以流动的液体,冷却后又成为固体——热塑性(如聚乙烯)。
加工成型后受热不再熔化,就叫热固性(如电木)。
(3)强度:高分子材料强度一般比较大。
(4)电绝缘性:通常高分子材料的电绝缘性良好,广泛用于电器工业上。
(5)特性:有些高分子材料具有耐化学腐蚀、耐热、耐磨、耐油、不透水等特性,用于某些特殊需要的领域;有些高分子材料易老化、不耐高温、易燃烧、废弃后不易分解等。
4.高分子材料的分类5.应用广泛的高分子材料(1)塑料:工业生产聚氯乙烯的化学方程式为n CH 2===CHCl ――→催化剂CH 2—CHCl。
(2)合成纤维:合成涤纶的化学方程式为(3)合成橡胶合成顺丁橡胶的化学方程式为n CH 2===CH —CH===CH 2――→催化剂 CH 2—CH===CH —CH 2。

质对市爱慕阳光实验学校一轮复习专题——有机化学推断题1. 两个羟基同时连在同一碳原子上的结构是不稳的,它要发生脱水反:现有分子式为C9H8O2X2〔X为一未知元素〕的物质M,可在一条件下发生下述一系列反:试答复以下问题:〔1〕X为〔填元素符号〕;其判断依据是。
〔2〕A用盐酸酸化所得的物质中所含的官能团的名称为,〔3〕M的结构简式为。
〔4〕写出以下反的化学方程式:①B→D:。
②A与制Cu〔OH2〕悬浊液反:。
反的类型为。
③B+E:。
2. 某药物有效成分为有机物M,跟(CH3)2SO4反生成有机物A.二者的结构简式如图试答复:〔1〕有机物M的分子式为,1mol有机物M跟浓溴水反时最多消耗 mol Br2;有机物A不能发生的化学反有〔用番号表示〕。
①加成反②取代反③消去反④水解反⑤银镜反〔2〕有机物A能发生如下转化:提示:①C→D的化学方程式为。
②写出结构简式F ,G 。
③写出其中两种符合以下条件的E的同分异构体的结构简式。
a.遇FeCl3溶液呈紫色b.不能发生水解反,能发生银镜反c.苯环上的一氯取代物只有一种,分子中无甲基d.苯环上有四个取代基3. 乙醇是一种重要的化工产品、化工原料和用前景广阔的可再生能源。
〔1〕以玉米及其他含糖类农副产品为原料,经发酵、蒸馏制得乙醇。
多糖经过水解转化为葡萄糖,葡萄糖受到酒化酶的作用转化为乙醇。
请写出葡萄糖转化为乙醇的化学方程式。
〔2〕:C2H5OH〔l〕+3O2〔g〕=2CO〔g〕+3H2O〔l〕;△H=-1367kJ/mol。
玉米中淀粉和纤维素的含量为81%,,由玉米转化为乙醇时,原料总利用率为80%,那么1000g玉米制得的乙醇完全燃烧后放出的热量为kJ。
〔3〕香豆素是一种用途广泛的香料,它可以利用乙醇和B通过以下途径合成。
B 的分子式为C 7H 6O 2,它遇到FeCl 3溶液显紫色,其苯环上的一氯代物有4种。
答复以下问题:〔1〕D 的结构简式 。
〔2〕C →D 反类型 。

化学高三有机试题及答案一、选择题(每题3分,共30分)1. 下列化合物中,属于芳香烃的是:A. 甲烷B. 乙炔C. 苯D. 环己烷答案:C2. 烷烃的通式为:A. CnH2nB. CnH2n+2C. CnH2n-2D. CnH2n-6答案:B3. 以下哪种反应不是取代反应?A. 卤代反应B. 酯化反应C. 水解反应D. 加成反应答案:D4. 醇类化合物的通式为:A. R-OHB. R-SHC. R-NH2D. R-COOH5. 下列化合物中,属于烯烃的是:A. 乙烯B. 乙炔C. 苯D. 环己烷答案:A6. 以下哪种化合物可以发生消去反应?A. 乙醇B. 丙酮C. 甲酸D. 乙酸答案:A7. 酯化反应的一般反应式为:A. 酸 + 醇→ 酯 + 水B. 酸 + 醇→ 酯 + 醇C. 酸 + 醇→ 酸 + 醇D. 酸 + 醇→ 酯 + 醇 + 水答案:A8. 下列化合物中,属于羧酸的是:A. 乙酸B. 乙醇C. 乙酸乙酯D. 丙酮答案:A9. 以下哪种化合物是酮类化合物?B. 乙醇C. 乙酸D. 丙醛答案:A10. 下列化合物中,属于醚类化合物的是:A. 乙醚B. 乙醇C. 乙酸乙酯D. 丙酮答案:A二、填空题(每题5分,共30分)1. 烷烃的通式是________。
答案:CnH2n+22. 苯的分子式是________。
答案:C6H63. 酯化反应中,酸和醇反应生成的产物是________和________。
答案:酯;水4. 酮类化合物的通式是________。
答案:RCOR'5. 醚类化合物的通式是________。
答案:R-O-R'6. 醇类化合物的通式是________。
答案:R-OH三、简答题(每题10分,共40分)1. 简述烷烃和烯烃的区别。
答案:烷烃是饱和烃,分子中只有单键,通式为CnH2n+2;烯烃是不饱和烃,分子中含有碳碳双键,通式为CnH2n。
2. 什么是消去反应?请举例说明。

高中化学有机化学知识点归纳有机化学是化学的一个重要分支,研究含碳的化合物的结构、性质和反应。
在高中化学学习过程中,有机化学是一个重要的内容,以下是对高中化学有机化学知识点的归纳:1. 有机化合物的命名有机化合物的命名是有机化学的基础,主要有两种命名法,一种是按照IUPAC命名法,另一种是通用命名法。
按照IUPAC命名法,有机化合物命名顺序为:找到最长碳链、确定主链的编号方向、找出取代基的位置、命名取代基、确定双键或环烷的位置等。
通用命名法则是直接根据化学结构,给予化合物一个通用名称。
2. 有机物的结构式有机物的结构式包括:分子式、结构式、分子结构式、键线结构式、空间结构式等。
结构式能直观表现出有机物的结构,有助于理解有机化合物的性质和反应。
3. 有机物的同分异构体同分异构体是指化学式相同,结构式和物理性质却不同的化合物。
同分异构体主要有链式异构体、支链异构体、环状异构体、位置异构体等。
4. 有机物的性质有机物的性质主要包括:饱和、不饱和、烷烃、烯烃、炔烃、芳香烃等。
有机物在化学反应中常常表现出特定的性质和反应活性。
5. 有机物的化学反应有机物的化学反应包括:燃烧、卤代反应、加成反应、消除反应、重排反应、酯化反应、醇醚反应等。
有机化合物在不同条件下会发生不同的化学反应。
6. 有机物的制备方法有机化合物的制备方法包括:实验室制备、化学合成、生物合成等。
根据有机物的结构和性质,可以采取不同的方法来制备有机化合物。
总的来说,高中有机化学知识点的归纳包括有机物的命名、结构式、同分异构体、性质、化学反应和制备方法等内容。
通过系统的学习和积累,可以更好地理解和掌握有机化学知识,为日后的学习和研究打下坚实的基础。
希望以上内容对您有所帮助。

个性化教学辅导教案学生姓名 XXX年 级 高三学 科 化学 上课时间 X 年X 月X 日X 时…教师姓名XXX课 题 高三二轮复习专题:常见有机物及反应类型教学目标1、能根据有机化合物的元素含量、相对分子质量确定有机化合物的分子式;2、了解有机物分子中的官能团,能正确地表示它们的结构;3、了解有机化合物存在异构现象,能判断简单有机化合物的同分异构体;4、能根据有机化合物命名规则命名简单的有机化合物;了解卤代烃、醇、酚、醛、羧酸、酯的典型代表物的组成和结构特点以及它们的相互联系;5、了解合成高分子的组成与结构特点,能依据简单合成高分子的结构分析其链节和单体,了解加聚反应和缩聚反应的特点。
教学过程 教师活动学生活动1、有机高分子化合物甲是一种常用的光敏高分子材料,其结构简式为。
按如图所示关系可以合成甲,其中试剂I 可由相对分子质量为26的烃与水加成制得。
已知:a .-CH 2OH +-CH 2OH ――――→浓硫酸△-CH 2OCH 2-+H 2O b . 请回答下列问题:(1)质谱图显示A 的相对分子质量是80.5,A 分子中氧元素的质量分数为19.88%,碳元素的质量分数为29.81%,其余为氢元素和氯元素,且A 的核磁共振氢谱上有三个吸收峰,峰面积之比为2∶2∶1,则A 的结构简式为ClCH 2CH 2OH 。
(2)试剂I 的名称是乙醛;B →C 的反应类型是消去反应。
(3)写出下列反应的化学方程式:①D →E :________________________________________;②C +F →G +NaCl :________________________________________。
(4)E 的一种同分异构体的水解产物有两种,一种能使溴水褪色,另一种在滴加饱和溴水后,有白色沉淀生成,该物质的结构简式为________________________________。
3、化合物F 是一种抗心肌缺血药物的中间体,可以通过以下方法合成:(1)化合物A 中的含氧官能团为 填官能团名称)。

高三化学有机知识点大全有机化学是化学中的一个重要分支,研究有机物的结构、性质、合成和应用等方面。
在高三化学学习中,了解有机化学的知识点是非常重要的。
本文将为大家详细介绍高三化学有机知识点的大全。
一、化学键与有机物的分类1.有机物的特点有机物主要由碳和氢元素组成,其在化学反应中常表现出明显的不稳定性和易燃性,容易与氧发生反应。
2.碳的化学键碳与其他原子之间可以形成共价键、极性共价键和范德瓦尔斯力等化学键,其中共价键是最常见的碳化学键。
3.有机物的分类有机物可以分为烃类、醇类、醛类、酮类、酸类、酯类、醚类、胺类、酚类等多种类别,每种类别又可进一步细分。
二、有机物的结构与性质1.立体结构有机物的立体结构由于手性碳原子的存在而产生,立体异构体是指具有相同分子式但空间结构不同的有机化合物。
2.有机物的官能团官能团是有机化合物分子中具有相同功能性质的结构部分,如羟基、羰基、氨基、醚基等。
3.有机物的物理性质有机物的物理性质包括熔点、沸点、溶解性等,这些性质与有机物的分子结构和化学键有关。
4.有机物的化学性质有机物的化学性质主要通过它们的官能团来表现,常涉及酸碱中和、氧化还原、取代反应等。
三、有机反应机理1.取代反应机理取代反应是有机化学中最常见的反应类型之一,可发生在饱和碳原子上,常涉及亲电进攻与亲电离子离去的步骤。
2.加成反应机理加成反应是指两个或多个分子中的原子、离子或分子团结合成为一个分子的过程,涉及亲核试剂与互变试剂之间的反应。
3.消除反应机理消除反应是指饱和化合物中两个邻接碳原子之间的一个或多个原子逸出形成一个或多个双键或三键的反应。
四、有机化学的实际应用1.药物化学有机化合物在药物领域具有广泛的应用,药物的研制离不开有机合成和有机反应机理的应用。
2.合成塑料塑料是有机化合物合成的重要产物,合成塑料的方法包括聚合反应、共聚反应和羧酸酯反应等。
3.颜料与染料有机化学合成中,染料和颜料广泛应用于纺织、油漆、化妆品等领域,给人们的生活带来了丰富的色彩。
高三有机化学知识点一、有机化学概述有机化学是研究含碳化合物的化学性质、结构、合成及其应用的科学。
在高中阶段,有机化学作为化学学科的重要组成部分,对于培养学生的化学思维和实验能力具有重要意义。
高三学生在复习有机化学时,需要掌握基础概念、各类有机化合物的性质与反应类型、有机合成等核心知识点。
二、基础概念与分类1. 有机化合物与无机化合物有机化合物通常是指含有碳元素的化合物,如烃、醇、酮、酸等。
而无机化合物则通常不含有碳元素,如水、盐等。
然而,这种分类并非绝对,例如二氧化碳和碳酸盐虽然含有碳元素,但性质更接近无机物,因此被归类为无机化合物。
2. 有机化合物的分类有机化合物可以根据其结构和功能团进行分类。
常见的分类包括烃(仅由碳和氢原子组成)、卤代烃(含有卤素原子的烃)、醇(含有羟基)、酚(含有苯环和羟基)、醛和酮(含有羰基)、羧酸(含有羧基)、酯(由羧酸和醇反应生成)等。
三、有机化合物的性质1. 物理性质有机化合物的物理性质包括沸点、熔点、密度、溶解性等。
一般来说,有机化合物的沸点和熔点随分子量的增加而升高,且极性分子间的相互作用力会影响其物理性质。
2. 化学性质有机化合物的化学性质主要取决于其结构和功能团。
例如,醇和酚可以发生酯化反应、氧化反应;醛和酮可以发生加成反应、缩合反应;羧酸可以发生中和反应、酯化反应等。
四、有机反应类型1. 取代反应取代反应是指有机分子中的一个原子或基团被另一个原子或基团所取代的反应。
常见的取代反应包括卤代反应、酯化反应、水解反应等。
2. 加成反应加成反应是指两个或多个分子结合形成一个新分子的反应。
在加成反应中,不饱和化合物(如烯烃、炔烃)与饱和化合物(如水、氢气)或不饱和化合物之间发生反应。
3. 消除反应消除反应是指有机分子中两个相邻的原子或基团脱离,形成不饱和化合物的反应。
例如,醇在强酸作用下失去水分子生成烯烃。
4. 缩合反应缩合反应是指两个或多个分子结合时,伴随有小分子(如水、氢卤酸)的生成。
专题1 有机化学基础(Ⅰ)【考向分析】分析近几年高考题,有机化学试题一直比较稳定,以有机推断和合成为主要题型,考查推理、分析和综合能力。
考查的特点有:①与生活、生产、新材料、新医药等广泛联系,用有机化学知识分析生活中常见问题;②综合性强注重模块知识的综合,其考查内容主要有官能团的性质及其转化;有机物分子式和结构式的确定;同分异构体的书写;有机反应类型的判断等。
预计2012年此专题的出题形式不会有很大变化,还是一陌生度高的有机物作为载体进行考查,所以在复习时一定要抓住基础,熟悉各官能团的性质,以不变应万变。
【核心攻略】热点一:常见有机物的结构及组成[例1]下列说法正确的是()①丙烷中三个碳原子在同一条直线上;②烃类分子中的碳原子通过形成四对共用电子对与其他原子结合;③乙醇分子中无碳碳双键,所以是饱和烃;④糖类、油脂、蛋白质均由C、H、O三种元素组成的;⑤淀粉、纤维素、油脂、蛋白质均属于高分子化合物;⑥含5个碳原子的有机物,每个分子中最多可形成4个C—C单键;⑦所有的烃中碳原子与碳原子之间均是以碳碳单键相连;⑧表示苯的分子结构,其中含碳碳双键,因此苯的性质跟乙烯相似。
【需巩固的知识】1、元素组成:2、立体结构:3、化学键:4、类别:热点二:常见有机物的性质[例1]下列叙述正确的是()①乙烯可使溴的四氯化碳溶液褪色,则聚乙烯也可以使其褪色;②酸性高锰酸钾溶液可以鉴别乙烯和甲烷;③可以用溴水鉴别乙醇与乙酸;④可以用酸性高锰酸钾溶液鉴别乙醇与乙酸;⑤淀粉、纤维素、葡萄糖均属于糖类。
都可以水解;⑥乙醇与乙酸中均中含有—OH,所以均与Na反应生成氢气;⑦可以碳酸钠溶液鉴别乙醇与乙酸;⑧鸡蛋白溶液遇浓硝酸→黄色;⑨淀粉溶液遇碘化钾→蓝色。
【需巩固的知识】1、有机物的密度和溶解性:2、常见有机物与常用试剂的反应常见试剂常见有机物现象及原因溴水酸性高锰酸钾溶液NaOH溶液NaHCO3溶液Na浓硫酸银氨溶液新制氢氧化铜碘水浓硝酸热点三:官能团与有机物的性质某有机物A是农药生产中的一种中间体,其结构简式如图所示(1)有A的结构推测,它能(填代号)a.使溴的四氯化碳溶液褪色b.使酸性高锰酸钾溶液褪色c.有机物A和浓硫酸混合加热,可以发生取代反应d.1 mol A和足量的NaOH溶液反应,最多可以消耗3 mol NaOHe.与Na2CO3溶液作用生成CO2f.和NaOH醇溶液混合溶液反应,可以反生消去反应g.1 molA和足量的H2反应,最多可以消耗4mol H2(2)该有机物中含氧官能团的名称为。
专题15有机化学基础【考情探究】1.有机化合物的组成与结构:(1)能根据有机化合物的元素含量、相对分子质量确定有机化合物的分子式;(2)了解常见有机化合物的结构;了解有机化合物分子中的官能团,能正确地表示它们的结构;(3)了解确定有机化合物结构的化学方法和物理方法(如质谱、红外光谱、核磁共振氢谱等);(4)能正确书写有机化合物的同分异构体(不包括手性异构体);(5)能够正确命名简单的有机化合物;(6)了解有机分子中官能团之间的相互影响。
2.烃及其衍生物的性质与应用:(1)掌握烷、烯、炔和芳香烃的结构与性质;(2)掌握卤代烃、醇、酚、醛、羧酸、酯的结构与性质,以及它们之间的相互转化;(3)了解烃类及衍生物的重要应用以及烃的衍生物的合成方法;(4)根据信息能设计有机化合物的合成路线。
3.糖类、氨基酸和蛋白质:(1)了解糖类、氨基酸和蛋白质的组成、结构特点、主要化学性质及应用;(2)了解糖类、氨基酸和蛋白质在生命过程中的作用。
4.合成高分子:(1)了解合成高分子的组成与结构特点;能依据简单合成高分子的结构分析其链节和单体;(2)了解加聚反应和缩聚反应的含义;(3)了解合成高分子在高新技术领域的应用以及在发展经济、提高生活质量方面中的贡献。
【高频考点】高频考点一常见有机物及官能团的主要性质醚键醛基羧基酯基两性化合物,能形成肽键肽键氨基—NH2羧基—COOH羟基—OH醛基—CHO羰基酯基高频考点二合成路线的分析与设计1.有机合成中官能团的转变(1)官能团的引入(或转化)+H2O;R—X+H2O;R—CHO+H2;RCOR′+H2;R—COOR′+H2O;多糖水解(2)官能团的消除℃消除双键:加成反应。
℃消除羟基:消去、氧化、酯化反应。
℃消除醛基:还原和氧化反应。
(3)官能团的保护℃用NaOH溶液先转化为酚钠,后酸化重新转化为酚:NaOH溶液H+℃用碘甲烷先转化为苯甲醚,后用氢碘酸酸化重新转化为酚:CH3I HI乙醇(或乙二醇)加成保护:――――→CH 3CH 2OH―――→H +/H 2O2.增长碳链或缩短碳链的方法CH 3CHO ―――――→CH 3CH 2MgBrH +/H 2O+H 2O CH 3CHO――→HCN ――→H +H 2On CH 2===CH 2――→催化剂CH 2—CH 2n CH 2===CH—CH===CH 2――→催化剂CH 2—CH===CH—CH 22CH 3CHO ――――→NaOH 稀溶液+R—Cl――→AlCl 3+HCl+――→AlCl 3+HCl+――→HCl +(n -1)H 2O+NaOH――→CaO℃RH +Na 2CO 3O 3.常见有机物转化应用举例 (1)(2)(3)(4)CH 3CHO ―――――→NaOH 稀溶液――→浓硫酸℃4.有机合成路线设计的几种常见类型根据目标分子与原料分子在碳骨架和官能团两方面变化的特点,我们将合成路线的设计分为 (1)以熟悉官能团的转化为主型如:以CH 2===CHCH 3为主要原料(无机试剂任用)设计CH 3CH(OH)COOH 的合成路线流程图(须注明反应条件)。