氧腐蚀的原理
- 格式:doc
- 大小:20.50 KB
- 文档页数:2

铁吸氧腐蚀电极反应方程式【摘要】铁是常见的金属材料,在大气和水中容易发生腐蚀现象。
铁吸氧腐蚀是其一种常见形式,主要是通过氧气与铁表面发生反应产生氧化物而引起的。
在这一过程中,发生一系列的电化学反应,最终导致铁的腐蚀。
铁吸氧腐蚀的原理是铁表面的电位较高,促使氧气发生还原反应,形成氧化物。
这种腐蚀过程会严重影响铁材料的性能和使用寿命。
为了控制铁吸氧腐蚀,可以采取一些措施,如表面涂层、防锈处理等。
铁吸氧腐蚀是一种常见的腐蚀现象,了解其机理和影响,并采取有效的控制措施,对延长铁材料的使用寿命和保护设备具有重要意义。
最终,铁吸氧腐蚀电极反应方程式说明了腐蚀过程的电化学反应。
【关键词】铁腐蚀、吸氧腐蚀、电极反应方程式、机理、原理、过程、影响、控制方法、结论。
1. 引言1.1 铁吸氧腐蚀电极反应方程式铁吸氧腐蚀电极反应方程式是描述铁在吸氧腐蚀过程中发生的电化学反应的方程式。
铁吸氧腐蚀是指铁在存在氧气和水的环境中发生的一种腐蚀现象,具体反应如下:Fe + O2 + H2O -> Fe(OH)2 (铁的部分溶解)整个反应过程可以总结为铁在吸氧腐蚀过程中先发生氧化反应,将铁溶解为Fe2O3•H2O,然后在还原反应中将氧还原为水,同时释放出电子。
这些电子会在电极上流动,形成电流,导致铁的进一步腐蚀。
铁吸氧腐蚀电极反应方程式是研究铁腐蚀机理和控制方法的重要基础,对于防止铁制品腐蚀具有重要意义。
在正文中我们将深入探讨铁腐蚀的机理、铁吸氧腐蚀的原理、铁吸氧腐蚀过程、铁吸氧腐蚀的影响以及铁腐蚀的控制方法,以全面了解铁吸氧腐蚀及其对工程材料的影响。
2. 正文2.1 铁腐蚀的机理铁在大气或水中会发生腐蚀,其主要机理是通过电化学反应产生。
铁腐蚀的机理可以分为两个主要过程:阳极过程和阴极过程。
在阳极过程中,铁发生氧化反应,将铁原子氧化为铁离子并释放电子。
铁的氧化可以表示为Fe -> Fe^2+ + 2e^-. 这个过程是腐蚀的起始步骤,使铁表面形成氧化物。


铁锈腐蚀痕迹的原理是
铁锈的腐蚀是由氧气、水和铁之间的化学反应引起的。
铁锈由两种主要成分组成:氧化铁(Fe2O3)和氢氧化铁(Fe(OH)3)。
以下是铁锈腐蚀痕迹形成的原理:
1. 首先,铁与周围的氧气发生氧化反应,形成了铁的氧化物。
该反应中的一个例子是2Fe + O2 →2FeO。
2. 然后,该氧化物与水反应,形成了铁的氢氧化物。
这个反应是由于水分解产生的氢离子(H+)与氧化物结合。
该反应可以表示为FeO + H2O →Fe(OH)2。
3. 最后,氢氧化铁发生进一步的氧化和水解反应,形成氧化铁和氢氧化物的混合物,也就是我们通常看到的铁锈。
这个过程可以表示为4Fe(OH)2 + O2 →2Fe2O3 + 4H2O。
铁锈腐蚀痕迹的形成是一个逐渐发展的过程,它会不断地导致铁表面的物质损失和颜色变化。
这些痕迹通常呈现为红褐色或橙色,并且会逐渐扩大和蔓延,使铁表面产生凹凸不平的纹路。

腐蚀和膨胀的原理和应用1. 腐蚀的原理和应用腐蚀是指材料表面由于化学或电化学反应而逐渐被破坏或消耗的过程。
下面将介绍腐蚀的原理和应用。
1.1 腐蚀的原理腐蚀是由于材料表面与周围环境发生化学反应或电化学作用引起的。
腐蚀过程主要包括氧化、还原以及电极反应等。
1.1.1 氧化反应氧化反应是指材料表面与氧气发生反应,形成氧化物的过程。
例如,铁在潮湿氧气中发生氧化反应生成铁氧化物,即生锈。
1.1.2 还原反应还原反应是指材料表面与还原剂发生反应,将氧化物还原为金属的过程。
例如,将铁氧化物加热与还原剂反应可以得到纯铁。
1.1.3 电极反应电极反应是指材料表面与电解质溶液发生化学反应的过程。
在电解质溶液中,腐蚀产物离子化形成溶液,并与金属表面发生电化学反应,导致材料腐蚀。
1.2 腐蚀的应用腐蚀不仅有害,还具有一些应用价值。
下面列举了一些腐蚀的应用:•腐蚀是金属保护的基础。
通过控制和改变腐蚀过程,可以延长材料的使用寿命。
•腐蚀可用于制造金属雕刻艺术品。
通过腐蚀去除金属表面的一部分,可以创作出精美的艺术品。
•腐蚀可用于石油钻采工程中的“酸压裂”过程。
通过使用酸溶液腐蚀岩石,可以打开裂缝,以便更好地采集石油。
•腐蚀可用于食品加工。
例如,利用酸腐蚀作用可制备酸干丝等特色食品。
2. 膨胀的原理和应用膨胀是指物体在受热后体积增大的过程。
下面将介绍膨胀的原理和应用。
2.1 膨胀的原理膨胀是由于物体受热后分子间距离增大,导致体积增大的过程。
膨胀的原理主要包括热运动和热胀冷缩两个方面。
2.1.1 热运动热运动是分子或原子在受热后加速运动的过程。
在受热后,分子或原子具有更大的动能,相互之间的距离增大,导致物体体积增大。
2.1.2 热胀冷缩热胀冷缩是指物体在受热后膨胀,冷却后收缩的过程。
当物体受热时,分子或原子间的热运动使物体膨胀,冷却后分子或原子间的运动减慢,物体收缩。
2.2 膨胀的应用膨胀不仅是一种物理性质,还具有一些实际应用。
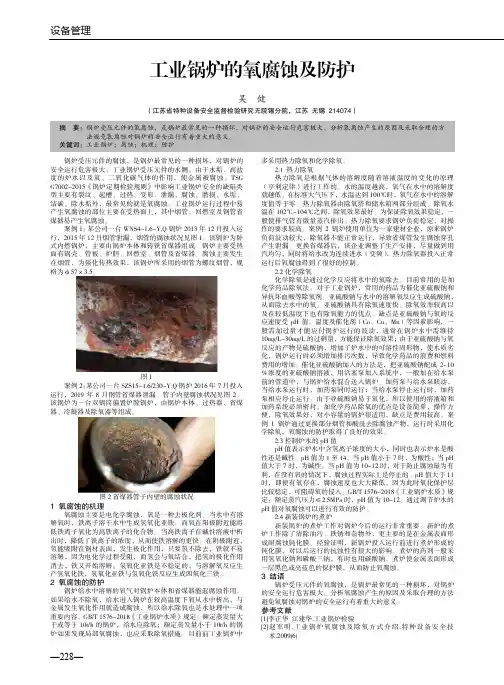
设备管理—228—工业锅炉的氧腐蚀及防护吴 健(江苏省特种设备安全监督检验研究无院锡分院,江苏 无锡 214074)锅炉受压元件的腐蚀,是锅炉最常见的一种损坏,对锅炉的安全运行危害极大。
工业锅炉受压元件的水侧,由于水垢、高盐度的炉水以及氧、二氧化碳气体的作用,使金属被腐蚀。
TSG G7002-2015《锅炉定期检验规则》中影响工业锅炉安全的缺陷类型主要有裂纹、起槽、过热、变形、泄漏、腐蚀、磨损、水垢、结碳。
除水垢外,最常见的就是氧腐蚀。
工业锅炉运行过程中易产生氧腐蚀的部位主要在受热面上,其中烟管、回燃室及钢管省煤器易产生氧腐蚀。
案例1:某公司一台WNS4-1.6-Y,Q 锅炉2013年12月投入运行,2015年12月烟管泄漏,烟管的腐蚀状况见图1。
该锅炉为卧式内燃锅炉,主要由锅炉本体和铸铁省煤器组成。
锅炉主要受热面有锅壳、管板、炉胆、回燃室、烟管及省煤器。
腐蚀主要发生在烟管,为强化传热效果,该锅炉所采用的烟管为螺纹烟管,规格为φ57×3.5。
图1案例2:某公司一台SZS15-1.6/230-Y,Q 锅炉2016年7月投入运行,2019年8月钢管省煤器泄漏。
管子内壁腐蚀状况见图2。
该锅炉为一台双锅筒偏置炉膛锅炉,由锅炉本体、过热器、省煤器、冷凝器及除氧器等组成。
图2省煤器管子内壁的腐蚀状况 1 氧腐蚀的机理 氧腐蚀主要是电化学腐蚀,氧是一种去极化剂。
当水中有溶解氧时,铁离子溶于水中生成氢氧化亚铁。
而氧在阳极附近能将低铁离子氧化为高铁离子的化合物。
当高铁离子在碱性溶液中析出时,降低了铁离子的浓度,从而使铁溶解的更快。
在阴极附近,氢能吸附在钢材表面,发生极化作用,只要氢不除去,铁就不易溶解,因为电化学过程受阻,而氢会与氧结合,把氢的极化作用消去,铁又开始溶解。
氢氧化亚铁是不稳定的,与溶解氧反应生产氢氧化铁,氢氧化亚铁与氢氧化铁反应生成四氧化三铁。
2 氧腐蚀的防护锅炉给水中溶解的氧气对锅炉本体和省煤器能起腐蚀作用。




锅炉氧腐蚀产生的原因及措施摘要:锅炉因运行操作不当或给水除氧不达标或停炉保养工作不及时、不彻底或方法、方式不当导致锅炉受压部件严重腐蚀的较多,其中大多数是热水锅炉,锅炉的腐蚀,不仅缩短了锅炉的使用寿命,影响了设备的安全运行。
由此可见,锅炉既应加强给水除氧和运行操作,又要注重锅炉停用期间的保养。
只要做好这三项,就能保证锅炉安全经济运行。
关键词:锅炉;氧腐蚀;产生;原因;措施1 锅炉氧腐蚀产生的原因1.1 氧腐蚀的范畴从历年来分析锅炉降低使用寿命和加大检修量,增加生产成本的主要原因是因为锅炉的氧腐蚀。
1.2 反应机理1.2.1 反应方程式阳极:Fe - 2e →Fe2+ (1)阴极:O2 +H2O +2e →2OH- (2)Fe2+ + 2OH- →Fe(OH)2 (3)4Fe(OH)2 + O2 + 2H2O → 4Fe(OH)3 (4)从上面的反应方程式(1),(2),(3)(4)可以判定出由单质的铁变成和红褐色的铁的胶体。
使锅炉本体发生腐蚀。
1.2 锅炉停用期间的氧腐蚀发生的原因停炉期间,锅筒内的水蒸气和氧气和铁的反应并没有停止,继续反应方程式为:Fe(OH)2 + 2 Fe(OH)3 →Fe3O4 + 4H2O (5)Fe(OH)3 + e → Fe(OH)2 + OH- (6)Fe3O4 + H2O + e →FeO + Fe2O3 + OH- (7)从上述(5),(6),(7)反应方程式就可以表明锅炉本体和受压部件的严重腐蚀。
1.3 氧腐蚀产生的影响因素:1.3.1 氧的浓度在发生氧腐蚀的条件下,随着氧的浓度增加,加快金属腐蚀速度。
1.3.2锅炉锅水PH值的影响:(1)当锅炉锅水的PH13,腐蚀产物变成可溶性HFeO2-,,加剧了腐蚀速度。
1.3.3锅炉炉水流速的快慢对锅炉腐蚀有很大:(1)当锅炉锅水的水流速度≥10m/S,这时水中的各种物质扩散的非常快,就会加速腐蚀。
(2)当锅炉锅水的水流速度≤0.2m/S,这时水中的气体就会析出,一部分气体会附着在金属壁上,附在金属壁上的气体会加速金属氧腐蚀。


实用文档之"吸氧腐蚀"摘要:本文从吸氧腐蚀的定义和发生吸氧腐蚀的必要条件出发,剖析了氧的阴极还原过程及其过电位和吸氧腐蚀的控制过程及特点,介绍了吸氧腐蚀的影响因素和常用的防腐方法,并结合腐蚀实例用实验进行了详细的分析。
关键词:吸氧腐蚀;氧的阴极还原过程;吸氧腐蚀的影响因素;防腐方法。
Oxygen Absorption CorrosionAbstract:This paper starts in the definition and the necessary condition of oxygen corrosion, analyzes the process and overpotential of the oxygen’s cathodic reduction and the control process and characteristics of oxygen corrosion, describes the factors and commonly used preservative method of oxygen corrosion, combined with corrosion instance with the experiments detailed analysis.Keyword:Oxygen corrosion;Cathodic oxygen reduction process;Oxygen corrosion factors;Antiseptic method.1.引言化学工业、石油化工、原子能等工业中,由于材料腐蚀造成的跑、冒、滴、漏,不仅造成惊人的经济损失,还可能使许多有害物质甚至放射性物质泄漏而污染环境,危害人民的健康,有的甚至会长期造成严重的后果;而由于金属腐蚀所造成的灾难性事故严重地威胁着人们的生命安全:许多局部腐蚀引起的事故,如氢脆和应力腐蚀断裂这一类的失效事故,往往会引起爆炸、火灾等灾难性恶果[1]。
氧化反应的原理与应用氧化反应是一种常见而重要的化学反应类型,其在物质转化、能量释放和环境保护等方面具有广泛的应用。
本文将详细介绍氧化反应的原理和常见的应用领域。
一、氧化反应的原理氧化反应是指一种物质与氧气(O2)或其他氧化剂发生反应,形成氧化物的化学反应。
其原理可以通过电子转移、氧原子或氧离子转移以及氧分子的加成等多种途径实现。
1. 电子转移:在一些离子化合物或有机物中,氧化反应涉及电子的失去和获得。
例如,金属的氧化反应就是通过金属中的电子向氧气中转移来实现的。
这种电子转移的氧化反应可以通过氧化电位和还原电位的差异进行观察和测定。
2. 氧原子或氧离子转移:在一些化合物中,氧化反应涉及氧原子或氧离子的转移。
例如,一氧化碳与氧气反应生成二氧化碳的反应中,氧原子从氧气中转移到一氧化碳中,形成二氧化碳。
在这种转移过程中,氧化反应伴随着氧离子转移。
3. 氧分子加成:在一些有机化合物反应中,氧分子以共价键和碳原子发生加成反应,形成间接的氧化产物。
例如,乙烯与氧气反应生成环氧乙烷,反应中两个氧分子以共价键与乙烯分子的碳原子形成一个环状的加成产物。
二、氧化反应的应用1. 燃烧反应:燃烧是一种氧化反应,也是最为常见的氧化反应之一。
燃烧过程中,燃料与氧气发生化学反应,产生热能和二氧化碳等氧化产物。
燃烧反应广泛应用于燃料的利用和能量的释放,如发电、加热、照明等。
2. 金属腐蚀:金属与氧气或其他氧化剂发生氧化反应,形成金属氧化物,即金属腐蚀。
金属腐蚀是一种自然界中常见的氧化反应,也是金属的一种损耗形式。
为了避免金属腐蚀,通常采用防腐处理、涂层保护等措施。
3. 化学合成:氧化反应在化学合成中起到重要作用。
例如,氧化反应常用于有机合成过程中的氧化剂和还原剂的选择,以实现目标化合物的合成。
氧化反应也可用于制取某些无机化合物,如氧化铁、氧化铝等。
4. 环境保护:在环境保护领域,氧化反应被广泛应用于废气治理和水处理等过程。
例如,废气中的有害气体可通过氧化反应将其转化为无害的氧化产物,从而达到净化空气的目的。
吸氧腐蚀和析氧腐蚀是怎么回事?有什么区别?吸氧腐蚀是指金属做负极,惰性非金属作正极的一类原电池反应,例如铁生锈的反应就是吸氧腐蚀,铁做负极,铁中的杂质等物质作正极,正极发生反应O2 + 4e- +2H20 = 4OH-,吸收氧气负极发生反应Fe - 2e- = Fe2+析氢腐蚀是指以酸为电解液的一类原电池反应,例如铁-锌,稀硫酸为电解液的原电池,正极发生反应2H+ + 2e- = H2,析出了氢气负极发生反应Zn - 2e- = Zn2+析氢腐蚀~~~~~~~~1 在酸性较强的溶液中发生电化腐蚀时放出氢气,这种腐蚀叫做析氢腐蚀。
2 在钢铁制品中一般都含有碳。
在潮湿空气中,钢铁表面会吸附水汽而形成一层薄薄的水膜。
水膜中溶有二氧化碳后就变成一种电解质溶液,使水里的H 增多。
是就构成无数个以铁为负极、碳为正极、酸性水膜为电解质溶液的微小原电池。
3 发生析氢腐蚀的体系3.1 标准电位很负的活泼金属3.2 大多数工程上使用的金属,如Fe3.3 正电性金属一般不会发生析氢腐蚀。
但是当溶液中含有络合剂时,正电性金属(如Cu,Ag)也可能发生析氢腐蚀。
4 析氢腐蚀的三种控制类型:4.1 阴极极化控制:如Zn在稀酸溶液中的腐蚀。
因为Zn是高氢过电位金属,故为阴极极化控制。
其特点是腐蚀电位与阳极反应平衡电位靠近。
对这种类型的腐蚀体系,在阴极区析氢反应交换电流密度的大小将对腐蚀速度产生很大影响。
4.2 阳极极化控制:只有当金属在酸溶液中能部分钝化,造成阳极反应阻力大大增加,才能形成这种控制类型。
有利于阳极钝化的因素使腐蚀速度减小。
4.3 混合控制:阴阳极极化程度差不多,称为混合控制。
其特点是:腐蚀电位离阳极反应和阴极反应平衡电位都足够远。
对于混合控制的腐蚀体系,减小阴极极化或减小阳极极化都会使腐蚀电流密度增大。
5 析氢腐蚀的影响因素5.1 溶液方面(1) pH值:溶液pH值对析氢腐蚀速度影响很大,随pH值下降,腐蚀速度迅速增大。
铸铁生锈原理及防护一、生锈原理:(主要为电化学腐蚀)1.吸氧腐蚀:负极Fe - 2e- + 2OH- =Fe(OH)2(沉淀)正极O2+2H2O+4e-=4OH-总反应2Fe+O2+2H2O=Fe(OH)2(沉淀)2.析氢腐蚀:负极Fe - 2e- + 2OH- =Fe(OH)2(沉淀)正极2H+2e-=H2总反应:Fe + 2H++ 2OH = Fe(OH)2(沉淀)+ H2(气体)最终:4Fe(OH)2+O2+2H2O===4Fe(OH)3(沉淀);2Fe(OH)3 ===Fe2O3·xH2O+(3-x)H2O.3.发生电化学腐蚀的必要条件:○1闭合回路下铁与○2水和氧气(氢离子)接触并发生○3“电子转移”。
图一4.电极电位:(1)以氢作为标准电极电位,其他元素相对于氢的电极电位为氢标准电极电位。
(2)电极电位也可以理解为某物质的离子溶解在盐水中,留下电子在物质表面(这个过程是可逆的)。
由于物质性质各不相同,所以其在盐溶液中的溶解率也不同,从而导致电极电位的不同。
当电极电位不同时,就会产生电位差。
电位差促进“电子的转移”。
二、表面组织锈蚀速率查文献得到铁素体为微阳极,珠光体为微阴极。
所以珠光体的锈蚀速度比铁素体快。
由于微区相间电极电位测量是难点,所以并没有基体组织的具体电极电位值。
三、刹车盘是否可以采用牺牲阳极的阴极保护法?不可以。
从铸铁生锈原理可以看出,锈蚀主要为电化学腐蚀,发生电化学反应一定要有闭合的回路。
当把锌镀在小外圆或其他部位是不能对刹面起到保护作用的。
因为其它部位的锌不能和刹面以水作为闭合回路。
(如图一闭合回路)四、金属防锈方法1.当知道铸铁生锈的原理后,才能制定有效的防锈方法。
如图一所示,防锈需从三个必要条件入手。
只要控制住一个就可以起到防锈的效果。
所以根据上表可知,在满足:1.海滨潮湿地区2.耐磨(极端工况200°)3.防腐最低3个月4.环境友好5.工艺简单6.低成本的条件下,寻找已经成熟的防锈油、防锈剂、合金配比、表面处理等方案。
氧浓差电池腐蚀原理(一)氧浓差电池腐蚀简介•氧浓差电池(也称差电池)是指在两个相同金属导体中形成氧化还原反应,从而产生电流的一种电化学装置。
•腐蚀是指金属在与周围环境接触时,发生氧化或溶解等破坏性变化的过程。
•氧浓差电池腐蚀是指差电池的形成和运行导致金属腐蚀的现象。
差电池原理1.差电池由两个相同金属导体和一个电解质组成。
2.金属导体中的金属离子在电池中发生氧化还原反应,从而产生电流。
3.在一侧金属导体中,金属离子被氧化成阳离子,释放出电子。
4.这些电子通过电路流动到另一边金属导体中,进行还原反应,将阳离子还原成金属离子。
差电池腐蚀原理1.在差电池中,金属导体的一侧氧化,另一侧还原,形成了氧化还原反应。
2.在反应过程中,发生了腐蚀现象。
3.在腐蚀中,金属导体的一侧(通常是阳极)发生氧化反应,形成金属离子溶解到电解质中。
4.而在另一侧(通常是阴极),金属离子被还原成金属结晶或沉积在表面。
5.这样,金属导体的一侧不断流失金属,形成腐蚀现象。
影响腐蚀的因素•温度:温度越高,反应速率越快,腐蚀加剧。
•电解质浓度:浓度越高,金属溶解速度越快,腐蚀加剧。
•金属导体的性质:不同金属导体对腐蚀的抵抗能力不同。
如何减轻差电池腐蚀•涂层保护:在金属导体表面涂上一层抗腐蚀物质,防止电池中的氧化还原反应发生在金属表面。
•阻挡剂使用:添加一定的阻挡剂到电解质中,形成保护层,减缓金属溶解速度。
•选择抗腐蚀金属:选用具有良好抗腐蚀性能的金属导体,可以减轻腐蚀的发生。
•控制温度和电解质浓度:通过控制温度和电解质浓度,减缓氧化还原反应速度,降低腐蚀程度。
结论•氧浓差电池腐蚀是差电池形成和运行过程中的副作用,通过影响金属导体的腐蚀程度,可采取一定措施来减轻腐蚀现象的发生。
•进一步研究差电池腐蚀原理以及减少腐蚀的方法可以改善电池的寿命和效率,提高电化学装置的使用寿命和安全性。
差电池腐蚀机制的深入解析•在差电池中,金属导体的一侧(阳极)发生氧化反应,金属溶解成离子溶解在电解质中。
混凝土氧化腐蚀原理一、前言混凝土是一种广泛应用于建筑物、道路、桥梁等基础设施建设中的常见材料。
然而在长期使用过程中,混凝土受到环境的侵蚀,会发生氧化腐蚀现象,导致混凝土的结构性能下降,最终影响到工程的使用寿命和安全性。
因此,深入探究混凝土氧化腐蚀的原理,对于提高混凝土的耐久性和延长工程使用寿命具有重要意义。
二、混凝土氧化腐蚀基础知识1. 氧化腐蚀定义氧化腐蚀是指金属在空气和水中发生的一种化学反应,即金属与氧气或其他氧化剂发生反应,生成金属氧化物或金属酸化物的过程。
氧化腐蚀是金属受到侵蚀的主要原因之一。
2. 混凝土氧化腐蚀定义混凝土氧化腐蚀是指混凝土中的钢筋或钢材受到空气和水中氧化物的侵蚀,导致钢筋或钢材表面产生锈蚀,最终破坏混凝土结构的过程。
混凝土中的氧化腐蚀是建筑物、道路、桥梁等基础设施建设中的一个常见问题。
3. 混凝土氧化腐蚀的原因混凝土氧化腐蚀的原因主要是混凝土中的钢筋或钢材表面受到氧化物的侵蚀。
混凝土中的钢筋或钢材表面被氧化物侵蚀后,会产生锈蚀,最终导致混凝土结构的破坏。
4. 混凝土氧化腐蚀的危害混凝土氧化腐蚀会导致混凝土结构的性能下降,最终影响到工程的使用寿命和安全性。
混凝土中的钢筋或钢材表面被氧化物侵蚀后,会产生锈蚀,从而导致钢筋或钢材的截面积减小,强度降低,最终影响到混凝土整体的承载能力和稳定性。
三、混凝土氧化腐蚀的机理1. 氧化腐蚀的化学反应混凝土氧化腐蚀的机理与金属氧化腐蚀的机理类似。
当混凝土中的钢筋或钢材表面受到氧化物的侵蚀时,钢筋或钢材表面的铁原子会与氧原子结合,形成铁氧化物或铁酸化物,即生锈的过程。
化学方程式:Fe + O2 + H2O → Fe(OH)2Fe(OH)2 + O2 → Fe(OH)3Fe(OH)3 → Fe2O3·nH2O + 3H2O2. 氧化腐蚀的电化学反应除了化学反应,混凝土氧化腐蚀还涉及到电化学反应。
在混凝土中,钢筋或钢材表面作为阳极,混凝土作为阴极,形成一个电池。
氧腐蚀的原理、特征及部位
1、氧腐蚀的原理
铁受水中溶解氧的腐蚀是一种电化学腐蚀,铁和氧形成腐蚀电池。
铁的电极电位总是比氧的电极电位低,所以在铁氧腐蚀电池中,铁是阳极,遭到腐蚀,反应式如下:Fe
→ Fe2++2e,氧为阴极,进行还原,反应式如下:O2+2H2O+4e
→
4OH-在这里溶解氧起阴极去极化作用,是引起铁腐蚀的因
素,这种腐蚀称为氧腐蚀。
2、氧腐蚀的特征:
氧腐蚀的形态一般表现为:溃疡和小孔型的局部腐蚀,其腐蚀的产物表现为黄褐、黑色、砖红色不等。
对金属的强度破
坏非常严重。
铁受到溶解氧腐蚀后产生Fe2+,它在水中进行下列反应:
Fe2++2 OH-→ Fe (OH )2
Fe (OH ) 2+2H2O+O2 → 4Fe (OH )3
Fe (OH ) 2+2Fe (OH)3 → Fe3O4+4H2O
在上述反应中, Fe (OH ) 2是不稳定的,使反应继续往下进行,最终产物主要是 Fe (OH ) 3和Fe3O4
3.腐蚀的部件
氧腐蚀是锅炉采暖系统常见的一种腐蚀。
在运行和停运期间均可发生。
其主要部位,首先是给水系统和省煤器,而且其腐蚀产物进入受热面中和循环水系统中,也会引起其他一些破坏。
在系统停运期间由于防护不当,更是如此,不断造成设备及系统的破坏,其破坏程度越来越大,在金属表面形成许多小鼓包,鼓包表面的颜色(由黄褐色到硅红色不等,次层是黑色)。
当将这些腐蚀产物清除后,便会出现腐蚀造成
的陷坑。