植物透射电镜样品制备
- 格式:ppt
- 大小:2.96 MB
- 文档页数:16




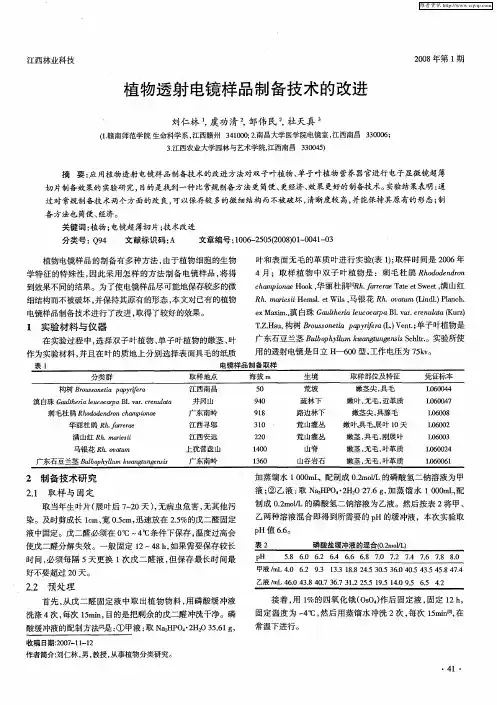

取材动作要迅速,材料离体后1min内就进入固定液,使组织、细胞尽可能保持原来生活状态,不要超过10min 解剖器械要锋利(如新的手术刀、新的双面刀片),避免牵拉和挤压,尽量减少取材中的机械损伤准取材要准确胃肠道、皮肤和角膜、视网膜、耳蜗等要注意方向性(纵切or横切),取材取成条状,确保要观察的部位在切面方向。
组织块的包埋方向与切面方向要十分清楚,尽量自己在包埋前进行定位(定向包埋,竖放or横放)⑶冷取材过程应在低温下(0~4℃)如冰块上操作,以降低酶的活性,减少细胞内结构的损伤。
⑶一般不超过1mm3小肠等取材时要方向性可取成条状;部分可取较大面积但截面约1mmX 1mm(厚度必须小于1mm)固定剂渗透力较弱(戊二醛为0.5mm,饿酸更弱),组织块太大则内部将得不到良好的固定而坏死注:1、2培养细胞的取材贴壁细胞:先倒出培养液,采用胰蛋白酶消化1500 rpm)10 min积的5~10倍)2.5~3%戊二醛固定液,固定约1h,也可在4悬浮细胞固定:1、离心固定:参考贴壁细胞离心步骤2、琼脂预包埋法:固定液固定的细胞悬液离心,弃上清后在50℃水浴中将细胞团加热,用热的吸管吸一滴已加热融化并冷却至50℃的琼脂,滴入细胞团中,使细胞悬浮。
为避免琼脂凝固,将细胞放入保温的离心管,在3000-5000 rpm离心1min。
在离心管置于水浴条件下,加入70%乙醇,停留1h。
当细胞团被琼脂包埋后,取出切成小块,用常规方法进行双重固定(先戊二醛再饿酸固定)。
植物组织的取材植物组织取材较容易,植物细胞离体后变化不像动物细胞那样迅速,但植物细胞的细胞壁阻碍着固定液的迅速渗透。
因此,植物材料的取材宜切成薄片状,经适当固定后再切成小方块。
植物材料内部存有的空气会使其漂浮于固定液液面上而影响固定效果,需抽取出气体抽取气体:将植物组织同固定液一起倒入注射器,用戴有乳胶套食指堵住注射器出口,右手拉动针栓;将注射器口垂直向上,松开食指,右手轻推针栓使液面上的气泡从注射器口排出。

透射电镜样品制备流程由于透射电镜能观察的样品必须很薄(60~70nm),所以透射电镜的样品准备要求很严格,方法也很单一,仅有一下两种方法:一.负染色技术负染色技术简单快速,可以显示生物大分子、细菌、分离的细胞器以及蛋白晶体等样品的形态、结构、大小以及表面结构的特征。
尤其在病毒学中,负染色技术有着广泛的应用。
样品要求:①样品悬液的纯度不要求很纯,但是如果杂质太多,如大量的细胞碎片,培养基残渣,糖类以及各种盐类结晶的存在都会干扰染色反应和电镜的观察。
尤其是不能有过多的糖类,因为在电子束的轰击下,糖类容易碳化而有碍观察,因此样品要适当提纯。
②样品悬液的浓度要适中,太稀在电镜下很难找到样品,太浓样品堆积影响观察。
操作流程:吸取样品悬液滴到有膜的铜网上,静置数分钟,然后用滤纸吸去多余的液体,滴上负染色液,染色1~2min后滤纸吸去负染色液,待干后用于电镜观察。
二、超薄切片技术超薄切片技术是为透射电镜观察提供薄样品的专门技术,是生物学中研究细胞超微结构最常用的技术。
广泛应用于生物体的各种细胞的超微结构观察。
一般厚度在10~100nm的切片称为超薄切片,制作这种切片的技术叫做超薄切片技术。
超薄切片制作的过程包括取材、固定、脱水、渗透、包埋、聚合、切片和染色等几个环节,和一般光学显微镜的石蜡切片过程相似。
但是,超薄切片切片过程更为细致与复杂,要求更严格,而且所用的试剂比较昂贵、配制复杂、强致癌。
具体操作步骤、注意事项如下:1.取材和前固定:快速的切取大小为0.5~1.0mm3的样品块,一分钟内把组织(样品)块浸入2.5%戊二醛(进口品质)溶液(取样前来平台领取),每个离心管内装20个以上的样品块,作为一个样送到平台。
要求:①取材前一定要和工作人员取得电话联系!②取材选择部位要准确可靠,确保每块材料都是要观察的部位。
③所有植物样品一定要抽真空,能够沉底的样品也抽真空15mins,不能沉底的样品一定要抽真空致沉底!④细菌、散在细胞等不能成块的样品,加戊二醛固定液,离心沉淀后送到平台,由平台工作人员处理。

透射电镜制样方法
透射电镜制样方法主要包括以下步骤:
1. 样品制备:首先需要选择合适的样品,并进行必要的前处理。
根据需要,可以使用传统的金相方法,如切片、打磨和腐蚀等来制备样品;也可以使用更先进的方法,如离子切片、聚焦离子束等来制备样品。
2. 高真空处理:将样品置于高真空环境下进行处理,以去除气体和水分的影响。
这可以通过在真空槽中加热样品、通入惰性气体等方法来实现。
3. 制备薄片:将制备好的样品制备成足够薄的薄片,通常厚度要求在几十纳米至几百纳米之间。
这可以通过使用超薄切片机或聚焦离子束来实现。
4. 电导涂层:为了提高样品的导电性,可以在样品表面涂上金薄层或碳薄层。
这可以通过蒸镀、溅射、离子镀等方法来实现。
5. 透射电镜成像:将制备好的样品放入透射电镜中,调整仪器参数,如加速电压、透镜聚焦等,进行成像。
可以使用像差校正技术、电子衍射等方法来提高成像质量。
需要注意的是,不同样品的制备方法会有一定差异,制备薄片时要注意避免样品的破裂和变形,电导涂层要均匀且致密,成像时要注意样品与探针的相对位置等
细节问题。
此外,透射电镜制样方法还包括一些先进的技术,如原位制备、低温制备、离子减薄等,可以根据需要选择适合的方法进行制备。

透射电镜样品制备方法透射电镜的样品制备方法,需要经过取材、固定、脱水、渗透、包埋聚合、切片及染色等步骤。
一.取材的基本要求组织从生物活体取下后,如果不立即进行适当处理,会由于细胞内部的各种酶作用,出现细胞器自溶现象。
因此,为了细胞结构尽可能保持天然状态,必须做到快、小、准、冷。
(1)动作迅速,组织从活体取下后应在最短的时间内(1分钟内)投入2.5%戊二醛固定液。
(2)所取组织的体积要小,一般不超过1mm*1mm,取样形状为牙签状。
也可将组织修成1mm*1mm*2-5mm大小长条形。
因为固定剂的渗透能力较弱,组织块如果太大,块的内部将不能得到良好的固定。
(3)机械损伤要小,解剖器械应锋利,操作宜轻,避免牵拉、挫伤与挤压。
推荐使用手术刀或双面刀片。
(4)操作最好在低温(0℃—4℃)下进行,以降低酶的活性,防止细胞自溶。
(5)取材部位要准确。
切片窗小于1mm*1mm,如取样带有太多的多余组织,可能造成你需要的部分刚好被修掉。
二.取材方法(按照自己的样品类型检索)1.动物及人体组织的取材(在冰浴上进行)动物组织的取材,应麻醉(1%戊巴比铵5 ml/kg体重腹腔注射)或断头急性处死,解剖出所需器官。
用手术刀切割取一小块组织,放在干净的硬质板上(例如培养皿底部),滴一滴冷却的固定液。
用新的、无油污的锋利双面刀片将材料切成大约1 mm宽,3~5 mm长的小块并从中选出受损伤较小的小条(牵拉损伤将直接破坏组织,切取时刀片下压,不要来回拉锯),用牙签将这些小块逐一放入盛有预冷的、新鲜固定液的1.5 ml管内,放入冰箱冷藏室低温固定(0~4℃)4小时或以上。
*固定结束后,将固定液用磷酸盐缓冲液稀释三倍,样品于该溶液中在4℃冰箱保存。
送样前请用磷酸盐缓冲液于4度冰箱浸泡清洗15 min,共3次,做好标记送至电镜室。
送样请使用2 ml离心管,用记号笔在离心管管壁上写好编号,用透明胶带缠绕。
后续管子会接触丙酮和乙醇,一定要用透明胶带缠绕,以防记号被洗掉。


透射电镜生物样品制备步骤
一.取材:
组织块小于1立方毫米
二.固定:
%戊二醛,磷酸缓冲液配制固定2小时或更长时间。
用磷酸漂洗液漂洗15分三次
1%锇酸固定液固定2-3小时
用磷酸漂洗液漂洗15分三次
三.脱水:
50%乙醇15-20分
70%乙醇15-20分
90%乙醇15-20分
90%乙醇90%丙酮(1:1)15-20分
90%丙酮15-20分
以上在4度冰箱内进行
100%丙酮室温15-20分三次四.包埋:
纯丙酮+包埋液(2:1)室温3-4小时
纯丙酮+包埋液(1:2)室温过夜
纯包埋液37度2-3小时
五.固化:
37度烘箱内过夜
45度烘箱内12小时
60度烘箱内48小时
六.超薄切片机切片70 nm
七.3%醋酸铀-枸橼酸铅双染色
八.透射电镜JEOL JEM-1230(80KV)观察。
拍片。
透射电镜常规样品制备流程
透射电镜是电子显微镜技术中最重要的一种技术,普通晶体样品的常
规样品制备流程如下:
1、样品的准备:将样品、水、石蜡、助融剂(如NaCl)、磷酸盐、石墨、甲醛和电子源材料(碳粉)准备好备用,并配合温度控制装置使用。
2、样品处理:将样品用接近样品发热点的温度处理,一般为200?C,把样品放入室温保温的石蜡,再将该石蜡分别放入不同的温度槽,如助融
剂的温度可以高于样品放置温度。
3、镀膜:将样品放置在硝酸银或碳材料的固体膜下,镀膜时,将碳
气体经过电子枪加热,形成形状与原子相同的表面。
4、结晶:首先需要将样品放置在一定温度和压力下,进行结晶,再
将研磨剂如磷酸盐、石墨和水添加到样品中,使样品迅速结晶,并在腔内
升温至合适温度,加快结晶过程。
5、夹具的清洗:在滴定液中加入抗蚀剂,夹具进行清洗,确保样品
无几何不良影响。
6、取晶体:用软金属夹具取出晶体,放在清洗过的滴定液中浸泡,
以使样品重新渗透,然后将样品放入滴定液腔中,进行滴定,使样品表面
无污染物。
7、安装样品:用金刚石夹具将样品安装在金刚石台子上,并将其固定,以保证样品的准确安装。
植物透射电镜样品制备技术的改进及不同树脂选择比较杨瑞;范敬伟;刘文可;王建立;于同泉;房克凤;王绍辉【摘要】针对植物细胞壁组织坚硬,透射电镜样品制备难度大的问题,笔者对样品制备程序化进行探讨;同时,在样品制备过程中对不同树脂配方进行选择和比较.结果表明:在经优化的样品处理下,不同树脂均能观察到植物样品的超微结构,结构清晰,且环氧树脂618包埋的样品受环境影响较小.【期刊名称】《北京农学院学报》【年(卷),期】2013(028)004【总页数】3页(P5-7)【关键词】透射电镜;样品制备;树脂;超微结构【作者】杨瑞;范敬伟;刘文可;王建立;于同泉;房克凤;王绍辉【作者单位】农业应用新技术北京市重点实验室,北京农学院植物科学技术学院,北京102206;农业应用新技术北京市重点实验室,北京农学院植物科学技术学院,北京102206;农业应用新技术北京市重点实验室,北京农学院植物科学技术学院,北京102206;农业应用新技术北京市重点实验室,北京农学院植物科学技术学院,北京102206;农业应用新技术北京市重点实验室,北京农学院植物科学技术学院,北京102206;农业应用新技术北京市重点实验室,北京农学院植物科学技术学院,北京102206;农业应用新技术北京市重点实验室,北京农学院植物科学技术学院,北京102206【正文语种】中文【中图分类】Q336随着电镜技术的日益普及,透射电镜(transmission electron microscopy,TEM)不仅在现代生物医学研究中起着越来越重要的作用,也已成为植物界超微结构研究的重要手段。
透射电镜生物样品制备大致分为取材、固定、漂洗、脱水、浸透、包埋、修块、定位、超薄切片及染色等多个步骤。
所有这些步骤环环相扣,缺一不可。
对于初学者,为获得理想的超薄切片,每一步都是难点和关键点;其中,材料的浸透和包埋受样品种类、季节和包埋剂的不同存在很大差异,影响因素较多[1-2],结果常不稳定,在很大程度上影响了电镜照片的质量,对于初学者也不易掌握,针对该问题,本实验室对重要环节包埋剂配方的选择进行了试验和比较,对国内外常用树脂EPON812,环氧树脂618,Spurr树脂进行试验、对比。
Living up to Lifeleica常规生物透射电镜样品制备概要1.取材及固定固定的目的是尽可能使细胞中的各细胞器以及大分子结构保持生活状态,并且牢固地固定在它们原来所在的位置上般来说固定有以下作用:1、破坏细胞的酶系统,阻止细胞的自溶;2、稳定细物质成分,如核酸、核蛋白,糖类和指类,使之发生交联,减少或避免抽提作用,以保存组织成分:3、在一些细胞组分之间以化学反应和物理反应建立交联,以提供一个骨架来稳定各种细胞器的空构型:4、能提供一定的电子反差L1动物及人体织的取材固定组织样品最重要的问题是速度,固定太慢会导致超微结构的改变111注定有条件尽可能活体灌注固定。
先腹腔注射巴比妥酸盐麻赛实验动物(如比妥钠.20-30mg/kg).打开腹腔,由腹主动脉插入针管,在肝脏附近切开一处静脉,启动蠕动泵开始灌注。
先灌注PBS冲洗液(37C,体积约13倍血液体积,200g 大鼠约需要10ml),可以在PBS内加入抗凝血剂防止血液凝固,然后灌注固定液(先37℃,再4℃),续5-10分钟,另一种灌注方法通过左心室,这种方法需要打开胸腔,动物呼吸停止,针管由左心室插入升主动脉,剪开右心耳,随后的步骤与上述灌注一样。
这种方法在胸腔打开后呼吸会立即停止,要求操作者尽快进行后续操作另外,向心脏插针管比向腹主动脉插针管要简单些,特别是对于一些很小的实验动物灌注后取出组织,切成1mm见方小块,再后用相同固定液固定30-60分钟左右112新检实样定血管不发达的组织,快速活体取材后立即投入固定液,同样,活检样品也要立即投入固定液,然后再尽快切成小块。
方法如下:麻醉或断头急性处死,解剖出所需器官,用解剖剪刀剪取一小块组织,放在干净的纸板上,滴一滴冷却的固定液,用新的、无油污锋利的《双面》刀片将材料切成大约1mm宽m长的小块,再将其切成1mm的小块,取材要尽量快速准确如果有方向要求,如一些空腔器官、皮肤、角膜等,要注意方向性,保证需要观察的部位准确取到。