高中化学平衡图像专题
- 格式:doc
- 大小:374.00 KB
- 文档页数:5

一、几大影响因素对应的基本v-t图像1.浓度当其他条件不变时,增大反应物浓度或减小生成物浓度,平衡向正反应方向移动;增大生成物浓度或减小反应物浓度,平衡向逆反应方向移动。
改变浓度对反应速率及平衡的影响曲线:2.温度。
在其他条件不变的情况下,升高温度,化学平衡向着吸热的方向进行;降低温度,化学平衡向着放热的方向进行。
化学平衡图像专题知识梳理由曲线可知:当升高温度时,υ正和υ逆均增大,但吸热方向的速率增大的倍数要大于放热方向的速率增大的倍数,即υ吸>υ放,故化学平衡向着吸热的方向移动;当降低温度时,υ正和υ逆<υ放,故化学平降低,但吸热方向的速率降低的倍数要大于放热方向的速率降低的倍数,即υ吸衡向着放热的方向移动。
3.压强对于有气体参加且方程式左右两边气体物质的量不等的反应来说,在其他条件不变的情况下,增大压强,平衡向着气体物质的量减小的方向移动;减小压强,平衡向着气体物质的量增大的方向移动。
改变压强对反应速率及平衡的影响曲线[举例反应:mA(g)+n(B)p(C),m+n>p]由曲线可知,当增大压强后,υ正和υ逆均增大,但气体物质的量减小的方向的速率增大的倍数大于气体物质的量增大的方向的速率增大的倍数(对于上述举例反应来说,即'υ正增大的倍数大于'υ逆增大的倍数),故化学平衡向着气体物质的量减小的方向移动;当减小压强后,υ正和υ均减小,但气体物质的量减小的方向的速率减小的倍数大于气体物质的量增大的方向的速率逆减小的倍数(对于上述举例反应来说,即'υ正减小的倍数大于'υ逆减小的倍数),故化学平衡向着气体物质的量增大的方向移动。
【注意】对于左右两边气体物质的量不等的气体反应来说:*若容器恒温恒容,则向容器中充入与反应无关的气体(如稀有气体等),虽然容器中的总压强增大了,但实际上反应物的浓度没有改变(或者说:与反应有关的气体总压强没有改变),故无论是反应速率还是化学平衡均不改变。


or personal use only in study and research; not for commercial use化学平衡图像专题解题思路:一看轴(纵、横坐标的意义),二看线(线的走向和变化趋势),三看点(起点、折点、交点、终点、零点的意义),四看要不要作辅助线(等温线、等压线、平衡线),五看量的变化(如浓度变化、温度变化等),六想规律(外界条件对反应速率的影响规律和化学平衡移动规律)1. 速率-时间图1. 对于达平衡的可逆反应X+Y W+Z,增大压强则正、逆反应速度(v)的变化如上图,分析可知X,Y,Z,W的聚集状态可能是()。
(A)Z,W为气体,X,Y中之一为气体(B)Z,W中之一为气体,X,Y为非气体(C)X,Y,Z皆为气体,W为非气体(D)X,Y为气体,Z,W中之一为气体2. 在一定条件下,反应A(g)+B(g)C(g)(正反应为放热反应)达到平衡后,根据下列图象判断A. B. C. D.E.(1)升温,达到新的平衡的是( )(2)降压,达到新的平衡的是( )(3)减少C的量,移向新平衡的是( )(4)增加A的量,移向新平衡的是( )(5)使用催化剂,达到平衡的是( ) 2. 浓度(物质的量)-时间图3. 在一定温度下,容器内某一反应中M、N的物质的量随反应时间变化的曲线如右图,下列表述中正确的是()A.反应的化学方程式为:2 M NB.t2时,正逆反应速率相等,达到平衡C.t3时,正反应速率大于逆反应速率 D.t1时,N的是M浓度的2倍3. 含量-时间-温度(压强)图4. 可逆反应m A(s)+n B(g ) e C(g)+f D(g),反应过程中,当其它条件不变时,C的百分含量(C%)与温度(T)和压强(P)的关系如下图:下列叙述正确的是()。
(A)达平衡后,加入催化剂则C%增大(B)达平衡后,若升温,平衡左移(C)化学方程式中n>e+f(D)达平衡后,增加A的量有利于平衡向右移动5. 在密闭容器中进行下列反应:M(g)+N(g )R(g)+2L此反应符合下面图像,下列叙述是正确的是()(A) 正反应吸热,L是气体(B) 正反应吸热,L是固体(C) 正反应放热,L是气体(D) 正反应放热,L是固体或液体6. 可逆反应m A(s) + n B(g) p C(g) + q D(g)反应过程中,当其它条件不变时,C的质量分数与温度(T)和压强(P)的关系如图(T2>T1),根据图中曲线分析,判断下列叙述中正确的是()(A)到达平衡后,若使用催化剂,C的质量分数增大(B)平衡后,若升高温度,平衡则向逆反应方向移动(C)平衡后,增大A的量,有利于平衡向正反应方向移动(D)化学方程式中一定n>p+q7. 现有可逆反应A(气)+B(气)3C(气),下图中甲、乙、丙分别表示在不同的条件下,生成物C在反应混和物中的百分含量(C%)和反应时间的关系:(1)若甲图中两条曲线分别表示有催化剂和无催化剂时的情况,则__ _曲线是表示有催化剂时的情况。

高二化学化学平衡图像专题1.图像问题解题步骤(1)看懂图像:①看面(即弄清纵坐标与横坐标的意义);②看线(即弄清线的走向和变化趋势);③看点(即弄清起点、拐点、交点、终点的意义);④看是否要作辅助线(如等温线、等压线);⑤看定量图像中有关量的多少。
(2)联想规律:联想外界条件的改变对化学反应速率和化学平衡的影响规律。
(3)作出判断:根据图像中表现的关系与所学规律相对比,作出符合题目要求的判断。
2.原则 (1)“定一议二”原则在化学平衡图像中,包括纵坐标、横坐标和曲线所表示的三个量,确定横坐标所示的量后,讨论纵坐标与曲线的关系或确定纵坐标所示的量后,讨论横坐标与曲线的关系。
(2)“先拐先平,数值大”原则在化学平衡图像中,先出现拐点的反应则先达到平衡,先出现拐点的曲线表示的温度较高或表示的压强较大。
1. 以速率—时间图像计算平衡浓度例1.在容积固定为2L的密闭容器中,充入X、Y气体各2mol,发生可逆反应:X(g)+2Y(g)⇌2Z(g),并达平衡,以Y表示的反应速度v正、v逆与时间t的关系如图所示,则Y的变化浓度表达式正确的是(式中S是对应区域的面积)()A.2−SaobB.SaobC.SdobD.1−Saob练习1. I2在KI溶液中存在下列平衡:I2(aq)+I−(aq)=I−3(aq)某I2、KI混合溶液中, I−3的物质的量浓度c(I−3)与温度T的关系如图所示(曲线上任何一点都表示平衡状态).下列说法正确的是()A. 反应I2 (aq)+I−(aq)═I−3 (aq)的△H>0B. 状态A 与状态B 相比,状态A 的c (I 2)大C. 若反应进行到状态D 时,一定有v 正>v 逆D. 若温度为T 1、T 2,反应的平衡常数分别为K 1、K 2,则K 1>K 22. 以速率-时间图像描述化学平衡移动的本质 例2. 反应A(g)+B(g) C(g);△H<0已达平衡,升高温度,平衡逆向移动,当反应一段时间后反应又达平衡,则速率对时间的曲线为3.以物质的量(浓度)—时间图像描述可逆反应达平衡的过程 例3. 如图表示反应X (g )⇌4Y (g )+Z (g )△H <0,在某温度时X 的浓度随时间变化的曲线,下列有关该反应的描述正确的是( )A. X 的平衡转化率为85%B. 第6 min 后,反应就终止了C. 若升高温度,X 的平衡转化率将大于85%D. 若降低温度,v 正减小,v 逆增大练习 500℃、20MPa 时,将H 2和N 2置于一容积为2L 的密闭容器中发生反应。





高(Gao)考化学专题复习:化学平衡图像专题1.对反(Fan)应2A(g)+2B(g)3C(g)+D(?),下列图象的描述(Shu)正确的是A. 依(Yi)据图①,若(Ruo)t1时升高温度,则ΔH<0B. 依据图①,若t1时增大压强,则D是固体或液体C. 依据图②,P1>P2D. 依据图②,物质D是固体或液体【答案】B2.下列图示与对应的叙述相符的是A. 图甲表示放热反应在有无催化剂的情况下反应过程中的能量变化B. 图乙表示一定温度下,溴化银在水中的沉淀溶解平衡曲线,其中a点代表的是不饱和溶液,b点代表的是饱和溶液C. 图丙表示25℃时,分别加水稀释体积均为100mL、pH=2的一元酸CH3COOH溶液和HX溶液,则25℃时HX的电离平衡常数大于CH3COOHD. 图丁表示某可逆反应生成物的量随反应时间变化的曲线,由图知t时反应物转化率最大【答案】B3.—定条(Tiao)件下,CO2(g)+3H2(g)CH3OH (g)+H2O(g) △H=-57.3 kJ/mol,往(Wang) 2L 恒容密(Mi)闭容器中充入 1 mol CO2和(He)3 mol H2,在不同催化剂作(Zuo)用下发生反应①、反应②与反应③,相同时间内CO2的转化率随温度变化如下图所示,b点反应达到平衡状态,下列说法正确的是A. a 点 v(正)>v(逆)B. b点反应放热53.7 kJC. 催化剂效果最佳的反应是③D. c点时该反应的平衡常数K=4/3(mol-2.L-2)【答案】A4.如图是可逆反应A+2B2C+3D的化学反应速率与化学平衡随外界条件改变(先降温后加压)而变化的情况,由此推断错误的是A. 正反应是放热反应B. A、B一定都是气体C. D一定不是气体D. C可能是气体【答案】B5.下图是恒温下H2(g)+I2(g)2HI(g)+Q(Q>0)的化学反应速率随反应时间变化的示意图,t1时刻改变的外界条件是A. 升高温(Wen)度B. 增大(Da)压强C. 增大反应(Ying)物浓度D. 加入(Ru)催化剂【答(Da)案】C6.汽车尾气净化的主要反应原理为2NO(g)+2CO(g)2CO2(g)+N2(g)。

专题27 化学平衡图像专练1.已知反应:CH2=CHCH3(g)+Cl2(g)CH2=CHCH2Cl(g)+HCl(g)。
在肯定压强下,按向密闭容器中充入氯气与丙烯。
图甲表示平衡时,丙烯的体积分数(ϕ)与温度(T)、ω的关系,图乙表示反应的平衡常数K与温度T的关系。
则下列说法正确的是A.图甲中11ω>B.若在恒容绝热装置中进行上述反应,达到平衡时,装置内的气体压强将不变C.温度T1、2ω=, Cl2的转化率约为33.3%D.图乙中,线A表示正反应的平衡常数【答案】C【解析】A.ω增大,CH2=CHCH3的转化率增大,则φ减小,由上述分析可知:ω2>ω1,则ω1<1,故A错误;B.该反应在反应前后气体分子数不变,依据图甲上升温度丙烯的体积分数增大,即上升温度平衡逆向移动,正反应放热,在恒容绝热装置中进行题述反应,体系内温度上升,依据PV=nRT,达到平衡时,装置内的气体压强将增大,故B错误;C.由图乙可知,T1时平衡常数为1,设起始时CH2=CHCH3和Cl2的物质的量分别为amol和2amol,达到平衡时转化的Cl2的物质的量为xmol,依据三段式进行计算:CH2=CHCH3(g)+Cl2(g) CH2=CHCH2Cl(g)+HCl(g)起始(mol) a 2a 0 0转化(mol) x x x x平衡(mol) a-x 2a-x x x则(xV)2÷(a xV-×2a xV-)=1,解得x=2/3a,则Cl2的转化率2/3a÷2a×100%=33.3%,故C正确;D.由图甲可知,ω肯定时,温度上升,φ增大,说明正反应是放热反应,故温度上升,正反应平衡常数减小,故图乙中,线A表示逆反应的平衡常数,故D错误。
2.如图所示的各图中,表示2A(g)+B(g)⇌2C(g)(△H<0)这个可逆反应的正确图象为(注:Φ(C)表示C的质量分数,P表示气体压强,C表示浓度)()A.B.C.D.【答案】A【解析】A.该反应为放热反应,温度上升平衡向逆反应方向移动,C的质量分数减小,故A正确;B.依据反应前后的化学计量数的大小可以看出,增大压强平衡向正反应方向移动,正逆反应速率都增大,且V正>V逆,故B错误;C.催化剂同等程度地变更正逆反应速率,平衡不发生移动,故C错误;D.该反应为放热反应,温度上升平衡向逆反应方向移动,A的转化率降低,依据反应前后的化学计量数的大小可以看出,增大压强平衡向正反应方向移动,A的转化率增大,本题温度的曲线不正确,故D错误。
化学平衡图像专题
基础知识:
对于反应mA(g) + nB(g) pC(g)+qD(g) △H<0 m+n>p+q
条件改变变化结果
条件改变ν逆ν正变化K变化平衡移动反应A得浓度C(A) A转化率C得含量
1 C(A)增大
2 C(A)减小
3 C(C)增大
4 C(C)减小
5 温度升高
6 温度降低
7 压强增大
8 压强减小
9 加催化剂
课时探究
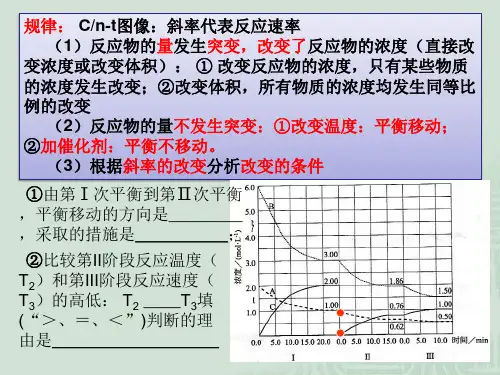
探究一、图像绘制,读图解题
例题1:氨气有广泛用途,工业上利用反应3H2(g)+ N2(g) 2NH3(g) 来合成氨气;某小组为
了探究外界条件对反应得影响,在a b两种条件下分别加入相同浓度得氢气与氮气合成
时间t/min 0 2 4 6 8
条件a c(H2)/10-2mol·L-12、00 1、50 1、10 0、80 0、80
条件b c(H2)/10-2mol·L-12、00 1、30 1、00 1、00 1、00
12 1 T2
0,根据表格数据请在下面画出c(H2)-t图:
(2)a条件下,0~4min得反应速率为;平衡时,H2得转化率为;平衡常
数为;
(3)在a条件下,8min末将容器体积压缩至原来得1/2,11min后达到新得平衡,画出
8min~12min时刻c(H2)得变化曲线。
探究二、图像解题方法
1、反应mA(g) + nB(g) pC(g)+qD(g) △H<0 m+n>p+q
反应速率与时间图如图所示,t1时刻只改变一个影响因素
①图1所示 ,t 1 时刻改变得因素就是 ,平衡向
方向移动, ②图2所示, t 1 时刻改变得因素就是 ,平衡向 方向移动, ③图3所示, t 1 时刻改变得因素就是 ,平衡向 方向移动, ④图4所示 ,t 1 时刻改变得因素就是 ,平衡向 方向移动, ⑤图5所示, t 1 时刻改变得因素就是 ,平衡向 方向移动,
2、①对于反应mA(g)+nB(g) pC(g),右图所示,
请判断温度大小:T 1 T 2,△H 0 ②对于反应mA(g)+nB(g) pC(g),右图所示, 请判断温度大小:T 1 T 2,△H 0
P 1 P 2, m+n p
探究三、陌生图像得解题技能 1、解决得问题就是什么?从图像可以得到什么信息?该信息与所学知识得关联?能用关联解决问题?
例题1:某化学科研小组研究在其它条件不变时,改变某一条件对A 2(g)+3B 2(g)2AB 3(g)化学平
衡状态得影响时,得到如图所示得变化规律(图中n 表示物质得量),根据图示得出得结论中正
确得就是( ) A.反应速率a >b >c
B.a 、c 两点A 2得转化率相等
C.a 点得化学平衡常数小于b 点得化学平衡常数
D.达到平衡时,AB 3得物质得量大小为:c >b >a
例题2:在容积相同得不同密闭容器中内,分别充入同量得N 2与H 2,在不同温度下,任其发生反应:3H 2 + N 2 2NH 3,并分别在t 0秒时测定其中NH 3得体积分数[x(NH 3)],绘成如图得曲线。
(1)A 、B 、C 、D 、E 五点中,尚未达到化学平衡状态得点就是_______。
(2)此可逆反应得正反应就是____(填“放”或“吸”)热反应。
△H 0
mA(g)+nB(g) pC(g)
①y 就是A 得浓度,△H 0,m+n p
②y 就是C 得含量, △H 0,m+n p
(3)B、D两点正反应速率得大小关系就是_____________。
(4)温度T<T3时,x(NH3)逐渐增大得原因就是。
温度T>T3时,x(NH3)逐渐减小得原因就是。
练习:
1、甲醇既就是重要得化工原料,又可作为燃料。
利用合成气(主要成分为CO、CO2与H2)在催化剂作用下合成甲醇,发生得主要反应如下:
①CO(g)+2H2(g)CH3OH(g) △H1
②CO2(g)+3H2(g)CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g)CO(g)+H2O(g) △H3
回答下列问题:
(1)反应①得化学平衡常数K得表达式为;图1中能正确反映平衡常数K随温度变化
关系得曲线为(填曲线标记字母),其判断理由就是。
(2)合成气组成n(H2)/n(CO+CO2)=2、60时,体系中得CO平衡转化率(α)与温度与压强得关系如图2所示。
α(CO)值随温度升高而(填“增大”或“减小”),其原因就
是;图2中得压强由大到小为_________,其判断理由就是。
2、丙烯腈(CH2=CHCN)就是一种重要得化工原料,工业上可用“丙烯氨氧化法”生产,主要副产物有丙烯醛(CH2=CHCHO)与乙腈(CH3CN)等,回答下列问题:
(1)以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)与副产物丙烯醛(C3H4O)得热化学方程式如下:
C3H6(g) + NH3(g) + 3
2O2(g) ===C3H3N(g) +3H2O(g) ΔH= −515 kJ·mol
−1
C3H6(g) +O2(g) == C3H4O(g) +H2O(g) ΔH= −353 kJ·mol−1
两个反应在热力学上趋势均很大,其原因就是;有利于提高丙烯腈平衡产率得反应条件就是;提高丙烯腈反应选择性得关键因素就是。
(2)图(a)为丙烯腈产率与反应温度得关系曲线,最高产率对应得温度为460O C。
低于460O C时,丙烯腈得产率(填“就是”或者“不就是”)对应温度下得平衡产率,判断理由就
是;高于460O C时,丙烯腈产率降低得可能原因就是(双选,填标号)
A.催化剂活性降低
B.平衡常数变大
C.副反应增多
D.反应活化能增大
(3)丙烯腈与丙烯醛得产率与n (氨)/n (丙烯)得关系如图(b)所示。
由图可知,最佳n(氨)/n (丙烯)
约为 ,理由就是 。
进料气氨、空气、丙烯得理论体积比约为 。
参考答案:
例题2、(1)A 、B (2)放热 (3)ν(D)>ν(B)
(4)反应开始v 正>v 逆,反应向右进行生成NH 3,温度升高反应速率加快,故NH 3得体积分数[x(NH 3)]不断增加;当达到平衡以后,温度升高.平衡逆向移动,故NH 3得体积分数[x(NH 3)不断减少。
1、(1);a;反应①为放热反应,平衡常数数值应随温度升高变小
(2)减小 升高温度时,反应①为放热反应,平衡向左移动,使得体系中CO 得量增大,反应
③为吸热反应,平衡向右移动,又使产生CO 得量增大,总结果,随温度升高,使CO 得转化率降低 P 3>P 2>P 1 相同温度下,由于反应①为气体分子数减小得反应,加压有利于提升CO 得转化率;而反应③为气体分子数不变得反应,产生CO 得量不受压强影响,故增大压强时,有利于CO 得转化率升高
2、(1)两个反应均为放热量大得反应;降低温度、降低压强;催化剂; (2)不就是;该反应为放热反应,平衡产率应随温度升高而降低 ;AC
(3)1 ; 该比例下丙烯腈产率最高,而副产物丙烯醛产率最低; 1:7、5:1
0 、
0 0 、2 0 、4 0 、6 0 、8 350 400 450 500 550
产
率 t /
℃ 0 、
0 0 、 2 0 、 4 0 、 6 0 、 8 0 、 4 0 、 6 0 、 8 1 、 0 丙 烯
腈
产
率 图 ( a ) 丙 烯 醛
1 、
2 n ( 氨 )/ n ( 丙烯 )
图 ( b )
2017国甲27
丁烯是一种重要的化工原料,可由丁烷催化脱氢制备。
回答下列问题: (1)正丁烷(C 4H 10)脱氢制1-丁烯(C 4H 8)的热化学方程式如下:
①C 4H 10(g)===C 4H 8(g)+H 2(g) ΔH 1 已知:②C 4H 10(g)+12
O 2(g)===C 4H 8(g)+H 2O(g) ΔH 2=-119kJ·mol -
1
③H 2(g)+12
O 2(g)===H 2O(g) ΔH 3=-242kJ·mol -
1
反应①的ΔH 1为______kJ·mol -
1。
图(a)是反应①平衡转化率与反应温度及压强的关系图,x ________0.1(填“大于”或“小于”);欲使丁烯的平衡产率提高,应采取的措施是________(填标号)。
A .升高温度
B .降低温度
C .增大压强
D .降低压强
(2)丁烷和氢气的混合气体以一定流速通过填充有催化剂的反应器(氢气的作用是活化催化剂),出口气中含有丁烯、丁烷、氢气等。
图(b)为丁烯产率与进料气中n (氢气)/n (丁烷)的关系。
图中曲线呈现先升高后降低的变化趋势,其降低的原因是______。
(3)图(c)为反应产率和反应温度的关系曲线,副产物主要是高温裂解生成的短碳链烃类化合物。
丁烯产率在590℃之前随温度升高而增大的原因可能是_________、__________;590℃之后,丁烯产率快速降低的主要原因可能是________________________。