胶体与表面化学2009A
- 格式:doc
- 大小:51.00 KB
- 文档页数:6

天津工业大学2009-2010学年第一学期应化、化工《胶体与表面化学》课程期末试卷(A卷)班级___________姓名__________ 学号____________一、问答题(45分)1.试解释Tyndall现象产生的原因。
(6分)答:Tyndall现象发生的宏观原因是胶体质点的折射率和周围介质不同,溶胶的这种光学不均匀性,导致光的散射现象;微观原因是由于胶体溶液中的胶粒直径大小(1-100nm)小于可见光的波长(400-700nm),从而表现出胶粒对光的散射作用。
(答对任何一个原因即可)2.简述表面活性剂在水中可形成几种胶束,胶束的形态与表面活性剂的浓度之间有何关系。
(6分)答:表面活性剂在水中可以形成三种类型的胶束:球形(1分)、棒状(1分)和层状胶束(1分)。
在一般情况下,随着水中表面活性剂浓度的增高,球形胶束会首先形成,然后依次是棒状胶束和层状胶束(3分)。
3.试解释过热液体产生的原因。
(6分)答:液体过热现象的产生是由于液体在沸点时无法形成气泡所造成的(3分)。
根据开尔文公式(1分),小气泡形成时期气泡内饱和蒸气压远小于外压,但由于凹液面附加压力的存在,小气泡要稳定存在需克服的压力又必须大于外压(1分)。
因此,相平衡条件无法满足,小气泡不能存在(1分),这样便造成了液体在沸点时无法沸腾而液体的温度继续升高的过热现象。
4. 画出KI 为稳定剂的AgI 溶胶的胶团结构。
(6分)(正确画出每层结构给1分,共3分,正确标记每层结构名称给1分,共3分)5. 什么是电泳现象,产生电泳的原因是什么。
(7分)电泳-在外加电场下,胶体溶液中的胶体粒子在分散介质中定向移动的现象(4分)。
原因:由于在胶体溶液中的胶体粒子带有电荷,因此在电场的作用下,会发生相对运动(3分)。
6. 活性碳从水溶液中吸附脂肪酸,吸附质分别为甲酸、乙酸、丙酸、丁酸试判断吸附量顺序和原因。
(7分)答:吸附量的顺序:甲酸<乙酸<丙酸<丁酸(4分)原因:由于活性炭为非极性吸附剂,水为极性溶剂(1分),因此非极性的吸附剂在极性溶剂中总是容易吸附非极性组分(1分)。

胶体与表面化学胶体是一种由分子间短距离相互作用形成的悬浮系统,涉及分子、原子、基团、团聚体和结晶体的共存交互作用,它的基本特征是粒子的形状和构型的多样性。
胶体与表面化学学科紧密相关,涉及胶体系统中的复合和表面性质,以及其中物理和化学因素对表面性质和复合性质的影响。
表面化学是一门重要的学科,既涉及结构、性质和反应,也涉及物质表面的形成和变化。
物质的表面是其与外部环境的接触界面,表面化学的演化及其变化会飞溅到它与外部环境的互动中,从而带来外部环境的改变。
物质的表面化学可以根据其不同的表面性质来划分,主要包括润湿性、疏水性、亲水性、多层性等性质,可以将这些表面性质用于液体-固体界面物理及化学反应,特别是表面吸附、表面活性剂以及表面改性。
胶体系统中的表面是由胶体分子组成的,它们分为溶液表面和固体表面两种,它们之间具有许多不同的性质。
研究胶体表面的最佳方法是观察固态表面,它以典型的凹凸形式呈现,可以表示胶体分子的空间构型,以及胶体分子的动态行为。
此外,研究表面也可以利用物理表面分析技术,例如扫描电镜,光学显微镜,透射电子显微镜,等离子质谱,X射线表征,原子力显微镜,等工具,来进行表面分析,从而更好地理解表面介质。
表面特性是决定胶体系统性能的重要因素,研究胶体表面特性,可以更深入地理解胶体的物理和化学性质,促进胶体的发展。
比如研究胶体的性质,表明表面张力与胶体系统的智能性能有着紧密的关系,也可以更好地控制胶体系统的可靠性。
具备表面阴离子亲水性及不同层次结构,以及结合胶体分子自组装及激发态动力学等特性,能够极大地增强胶体系统的稳定性。
胶体和表面化学共同发展,研究表面与胶体之间的关系,有助于开发高性能的胶体材料,提高有机胶体的稳定性,发展新型表面活性剂,消除环境污染、维护整个生态系统的平衡。
胶体与表面化学把这些性质有机地结合在一起,使物质具有独特的物理和化学性质,从而创造出新的应用领域。
总的来说,胶体与表面化学是相互补充的,这两个领域紧密联系,胶体系统中的复合性质和表面性质,以及它们之间的化学和物理因素,都可以使胶体科学得以进一步发展,它们是促进物质改变和发展的关键因素,为各种胶体产品的应用创造性地提供有益的信息。


胶体与表面化学 第一章 绪论化学:无机化学、有机化学、物理化学、分析化学 无机化学:(元素化学,研究无机物的制备、合成与性能)如:H 2O有机化学:(生命化学,研究C 、O 、P 、S 等少量元素形成的种类极多的化合物 ,就简单元素的复杂化学。
)小分子:甲烷如:大分子:淀粉 杀虫剂:医药:液晶:物理化学:(用物理模型、数学概念化的手段研究化学)物理:量子间的相互作用 化学:是量子间结合与排列。
热力学:状态——状态:能量转化的过程, 几千种状态方程。
动力学:物质间反应速度的问题(有时热力学分支极多: 能进行但动力学不能进行)电化学:电池:Fe+HCl ——FeCl 2+H 2电子转移 形成电池(Li +) 高能电池 Fe 2+,Fe 3+(提纯难99.99%~99.9999%)胶体与表面化学:气液固按不同形式混合, 泥土在水中分层,纳米材料,牙膏,原油,化妆品。
理论化学:(非实验的推算来解释或预测化合物的各种现象。
)如:用计算机模拟模型推算是否可以达到预期目的,在校正 合成。
分析化学:(研究物质的组成、含量、结构和形态等化学信息的分析方法一门科学)如:三聚氰胺事件分析手段差蛋白质含量(N)一、基本概念❖相:体系中物理化学性质完全相同的均匀部分❖界面:相与相的交接面❖表面:一相为气相的界面❖比表面:单位体积或重量物体的表面积。
S0=S/V对于立方体:S0=6L2/L3=6/L对于球体:S0=3/R❖胶体化学:是研究胶体体系的科学。
它是物理化学的一个重要分支。
随着胶体化学的发展,它已经成为一门独立的学科。
❖表面化学:研究发生在表面或界面上的物理和化学现象的一门科学。
是胶体化学的分支。
(原油催化裂化)二、胶体体系小实验:泥土置于水中沉降。
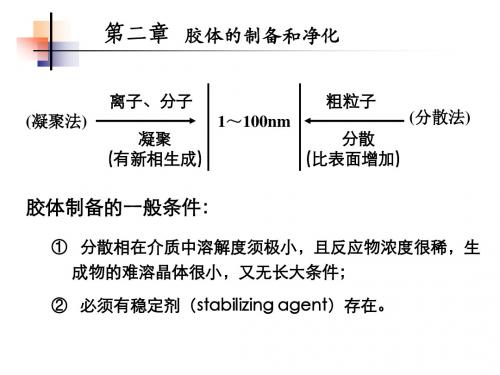
1、分类及定义:分散相粒子半径在1 ~100 nm 的分散体系。
2、特点(1)特有的分散程度——多相项多分散体粒子的大小在10-9~10-7m之间,扩散较慢,不能透过半透膜。

《胶体与界面化学》讲义第一章基本概念第一节胶体与表面一、胶体与胶体分散体系•目前科学地将颗粒大小在10-6~10-9m这样的物质(不管其聚集状态是气态、液态还是固态)称为胶体。
•胶体与其分散在其中的介质组成分散体系,介质可以是气、液和固体并与胶体颗粒间存在相界面,因此它还是高分散的多相的分散体系。
•胶体分散体系一般是两个组分以上的多组分体系,不过也存在极为罕见的单组分胶体分散体系,这类分散体系是液体,但由于分子的热运动而出现的涨落现象,一些分子会在液态内部聚集成较大的聚集体,这种分散体系称为类胶体(iso-colloid)分散体系。
聚合物或大分子量物质•聚合物或大分子量物质过去也称之为胶体分散体系的物质。
•如蛋白质,纤维素以及各种天然的和人工合成的聚合物,其尺寸也在胶体范围、并具有胶体的某些性质,比如慢扩散性,不透过半透膜,电泳行为等。
•因此过去也把它们作为胶体与表面化学的讲解内容。
但由于其迅速的发展,形成一个庞大的大分子家族,而成为一个独立学科去研究,不过它的某些理论和研究方法确系胶体的理论和研究方法。
二、表面和界面•表面(surface):是指凝聚相与真空,空气或其蒸气间的交界•界面(interface):是指凝聚相与其他相间的交界面。
•水的表面张力是水的表面(与空气或蒸汽的交界面)上的表面张力,约为72.8×10-3N/m;水和苯间界面张力为35×10-3N/m;水与汞间界面张力为375×10-3N/m。
•由此可见,界面张力值决定于相邻相的物质。
相边界上“面”的含义•这里所说的“面”是指相边界上的化学概念上的而非数学概念上的面。
数学面只有面积而无厚度,而化学面是有一定厚度的,起码有几个分子大小的厚度。
数学面所示在面上相的性质(如密度、浓度等)发生突变是不可思议的,而化学面中相的性质逐渐变化才是可理解的。
但在描述它时,由于其厚度值与两相本体尺寸比较可忽略不计近似为零。
第8章 表面化学与胶体8.1 重要概念和规律1.比表面能与表面张力物质的表面是指约几个分子厚度的一层。
由于表面两侧分子作用力不同,所以在表面上存在一个不对称力场,即处在表面上的分子都受到一个指向体相内部的合力,从而使表面分子具有比内部分子更多的能量。
单位表面上的分子比同样数量的内部分子多出的能量称为比表面能(也称比表面Gibbs函数)。
表面张力是在表面上的相邻两部分之间单位长度上的相互牵引力,它总是作用在表面上,并且促使表面积缩小。
表面张力与比表面能都是表面上不对称力场的宏观表现,即二者是相通的,它们都是表面不对称力场的度量。
它们是两个物理意义不同,单位不同,但数值相同,量纲相同的物理量。
2.具有巨大界面积的系统是热力学不稳定系统物质表面所多余出的能量γA称表面能(亦叫表面Gibbs函数),它是系统Gibbs函数的一部分,表面积A越大,系统的G值越高。
所以在热力学上这种系统是不稳定的。
根据热力学第二定律,在一定温度和压力下,为了使G值减少,系统总是自发地通过以下两种(或其中的一种)方式降低表面能γA:①在一定条件下使表面积最小。
例如液滴呈球形,液面呈平面;②降低表面张力。
例如溶液自发地将其中能使表面张力降低的物质相对浓集到表面上(即溶液的表面吸附),而固体表面则从其外部把气体或溶质的分子吸附到表面上,从而改变表面结构,致使表面张力降低。
3.润湿与铺展的区别润湿和铺展是两种与固—液界面有关的界面过程。
两者虽有联系,但意义不同。
润湿是液体表面与固体表面相互接触的过程1因此所发生的变化是由固—液界面取代了原来的液体表面和固体表面。
润湿程度通常用接触角表示,它反映液、固两个表面的亲密程度。
当θ值最小(θ=0o)时,润湿程度最大,称完全润湿。
铺展是指将液体滴洒在固体表面上时,液滴自动在表面上展开并形成一层液膜的过程,因此所发生的变化是由固—液界面和液体表面取代原来的固体表面。
铺展的判据是上述过程的∆G:若∆G<0,则能发生铺展;若∆G≥0,则不能铺展。
天津工业大学2009-2010学年第一学期
应化、化工《胶体与表面化学》课程期末试卷(A卷)
班级___________姓名__________ 学号____________
一、问答题(45分)
1.试解释Tyndall现象产生的原因。
(6分)
2.简述表面活性剂在水中可形成几种胶束,胶束的形态与表面活性剂的浓度
之间有何关系。
(6分)
3.试解释过热液体产生的原因。
(6分)
4.画出KI为稳定剂的AgI溶胶的胶团结构。
(6分)
5.什么是电泳现象,产生电泳的原因是什么。
(7分)
6. 活性碳从水溶液中吸附脂肪酸,吸附质分别为甲酸、乙酸、丙酸、丁酸试判断吸附量顺序和原因。
(7分)
7. 根据DLVO理论,试解释外加电解质对带电溶胶稳定性的影响。
(7分)
二. 选择与填空(15分)
1. 在毛细管中装入汞,当在毛细管左端加热,则管内汞()。
A.不发生移动
B. 左右来回移动
C.向右移动
D. 向左移动
2. 空气中直径0.01m的球形肥皂泡(表面张力为0.025N·m-1)所受附加压力为()。
A. 2.5Pa
B. 5Pa
C. 10Pa
D.20Pa
3. 把大分子化合物加入溶胶中,使溶胶的稳定性提高的主要原因是()。
A. ξ电势因这些物质的加入而升高
B. 胶粒表面上的大分子饱和层阻止了质点间的聚集
C. 胶粒表面上大分子非饱和层具有敏化作用
D. 胶粒间的范德华吸引力减小
4.液体B在不互溶液体A上铺展的条件是()。
A.γAB>γA+γB B. γA>γB+γAB
C. γA<γAB+γ B
D. γAB<γA+γ B
5. 设压力为P时,气体在固体表面上的覆盖率和被吸附的体积分别为θ和V, Vm为达到单分子饱和吸附时被吸附气体的体积,假定吸附服从朗格缪尔吸附等温式,则下列关系不确定的是()。
A. 1/θ~ 1/P
B. θ~ P
C. 1/V ~ 1/P
D. P/V ~ P
6. 两种表面活性剂A和B的HLB值分别为14.9和2.1,若用60%的A和40%的B混合,则复合表面活性剂的HLB值为_______________。
7. 若将体积为1.0 m3的立方体分割为1000个等体积的小立方体,则小立方体的总表面积是原立方体表面积的________________倍。
8. 在一定T下,液滴越小,其饱和蒸汽压就越______,而液体中气泡越小,泡内的液体饱和蒸汽压则越_________。
9. 水能润湿洁净玻璃,而水银则不能。
现将一根毛细玻璃管插入水中,管内液面将__________;当毛细管插入水银时,管内液面将________。
10. 在下列表格中填入化学吸附和物理吸附的四点主要区别
三.计算题(25分)
1. 将直径为1×10-3 m的毛细管插入稀水溶液中,管端深入水中0.1 m,为使管口吹出气泡,所需最大压力P为0.116 m水柱压力,试计算此溶液的表面张力(设溶液密度与水密度相同)。
(8分)
2. 已知25℃时,乙二醇在石蜡上的接触角为83°,而且乙二醇和水的表面张力以及乙二醇-石蜡和水-石蜡的界面张力分别为48.3×10-3,72.8×10-3,28.6×10-3,和22.1×10-3 N/m,试计算水在石蜡上的接触角。
(8分)
3. 0℃时用木炭吸附气体CO,当CO的平衡压力分别为2
4.0×103Pa和41.2×103Pa时,对应的吸附量分别为
5.567和8.668 m3/Kg,若该吸附符合Langmuir 吸附等温式,试计算固体表面的覆盖率达90%时,CO的平衡压力为多少。
(9分)
四. 综合题(15分)
有两不互溶的液体苯和水,分别制备出W/O型和O/W型乳状液,请写出1. 常用的乳状液类型的鉴定方法,并详细叙述其中一种方法;2. 影响乳状液稳定性的主要因素; 3. 列出最少4种常用破乳方法。