分光光度法测定苹果酒中的高级醇
- 格式:pdf
- 大小:339.40 KB
- 文档页数:3

1酒的检测指标葡萄酒的质量指标大致分为三类,一是现行国家标准GB/T15037-94中规定的检验指标;二是葡萄酒的特性指标,也就是那些只有真正用葡萄酿造的产品才具有的指标,包括有机酸(苹果酸、柠檬酸、乳酸、酒石酸)、氨基酸、氨基酸态氮、高级醇、脂类、单宁、白黎芦醇等多酚类物质;三是限量指标,即葡萄酒中的一些禁用物质成分,包括防腐剂、色素、甜味剂、农药残留以及钾、钠、钙、镁等金属离子。
2 青梅的作用及价值从青梅果肉的营养成份检测看,水分含量88.6%,固形物11.4%,还原糖1.3%,总酸6.4%,蛋白质0.8%,粗纤维2%,灰分0.9%;从青梅果肉矿物质及维生素含量看,钙29.7,磷29.1,铁1.4,锌0.74,维生素E0.17,黄酮145。
由此,我们可以看出青梅组成成分的特点是:1.低糖高酸。
总酸6.4%,其糖酸比T值为0.2是鸭梨的1/72,杏的1/8,甚至比柠檬的T值还低。
所以青梅是一种优良的天然酸味原料,具有合理的钙磷化。
其比值为1:1,是生产儿童食品和老年食品的上等原料。
3.含维生素B2高达5.6毫克100克,为其它水果的数百倍,而且维生素B2处于很稳定的高酸性环境中,这是XX青梅十分突出的优势所在。
从现代医学看,青梅的保健功能主要体现在以下五个方面:第一,调节酸碱平衡,保持体液弱碱性第二,消除疲劳,增强活动。
第三,有显著的整肠作用。
第四,青梅的解毒作用。
第五,防老抗衰。
以下葡萄酒果酒通用分析方法GB/T 15038—2005 代替GB/T 15038-19943 感官分析(外观香气滋味典型性)3.1 原理感官分析系指评价员通过用口、眼、鼻等感觉器官检查产品的感官特性,即对葡萄酒、果酒产品的色泽、香气、滋味及典型性等感官特性进行检查与分析评定。
3.2 品酒3.2.1品尝杯品尝杯见图1。
3.2.2 调温调节去除标贴后的酒的温度,使其达到:起泡、加气起泡葡萄酒9℃~10℃;白葡萄酒(普通)10℃~11℃;桃红葡萄酒12℃~14℃;白葡萄酒(优质)13℃~15℃;红葡萄酒(干、半干、半甜)、果酒(半干、半甜)16℃~18℃;加香葡萄酒、甜红葡萄酒、甜果酒18℃~20℃。
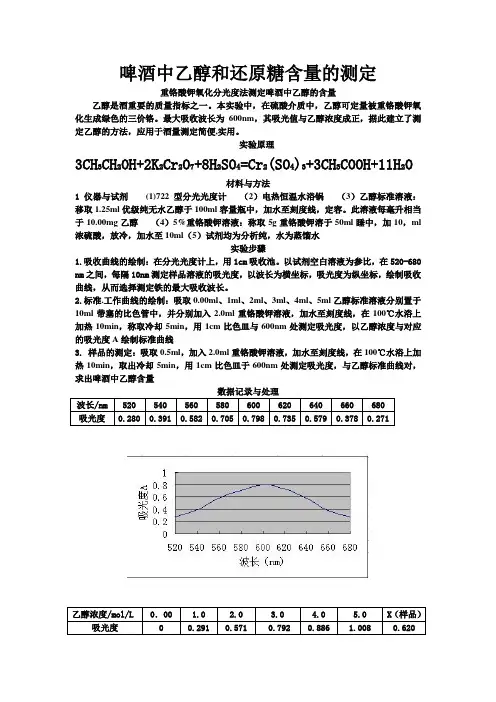
啤酒中乙醇和还原糖含量的测定重铬酸钾氧化分光度法测定啤酒中乙醇的含量乙醇是酒重要的质量指标之一。
本实验中,在硫酸介质中,乙醇可定量被重铬酸钾氧化生成绿色的三价铬。
最大吸收波长为600nm,其吸光值与乙醇浓度成正,据此建立了测定乙醇的方法,应用于酒量测定简便,实用。
实验原理3CH3CH2OH+2K2Cr2O7+8H2SO4=Cr2(SO4)3+3CH3COOH+11H2O材料与方法1 仪器与试剂(1)722型分光光度计(2)电热恒温水浴锅(3)乙醇标准溶液:移取1.25ml优级纯无水乙醇于100ml容量瓶中,加水至刻度线,定容。
此溶液每毫升相当于10.00mg乙醇(4)5%重铬酸钾溶液:称取5g重铬酸钾溶于50ml睡中,加10,ml 浓硫酸,放冷,加水至10ml(5)试剂均为分析纯,水为蒸馏水实验步骤1.吸收曲线的绘制:在分光光度计上,用1cm吸收池。
以试剂空白溶液为参比,在520-680 nm之间,每隔10nm测定样品溶液的吸光度,以波长为横坐标,吸光度为纵坐标,绘制吸收曲线,从而选择测定铁的最大吸收波长。
2.标准.工作曲线的绘制:吸取0.00ml、1ml、2ml、3ml、4ml、5ml乙醇标准溶液分别置于10ml带塞的比色管中,并分别加入2.0ml重铬酸钾溶液,加水至刻度线,在100℃水浴上加热10min,称取冷却5min,用1cm比色皿与600nm处测定吸光度,以乙醇浓度与对应的吸光度A绘制标准曲线3. 样品的测定:吸取0.5ml,加入2.0ml重铬酸钾溶液,加水至刻度线,在100℃水浴上加热10min,取出冷却5min,用1cm比色皿于600nm处测定吸光度,与乙醇标准曲线对,求出啤酒中乙醇含量数据记录与处理数据分析与总结由浓度与吸光度的图中可得:当A=0.620时 X=2.3mg/ml啤酒中乙醇的含量=(2.3X10)/0.5=46mg/ml参考文献1.与配制酒卫生标准的分析方法.GB/T5009.48-2003.[S].20032.生.彭榕妹.邓湘卫.等曙红内酯吸光度法测定酒中的乙醇含量J 李华检验-化学分册.1996.31啤酒中还原糖的测定(前言)实验原理将一定量的碱性酒石酸铜甲,乙液等量混合,立即生成蓝色的氢氧化铜沉淀,.这种沉淀很快与酒石酸甲钠反应,生成深蓝色的可溶性酒石酸钾钠铜络合物。

果酒检测实验报告尊敬的评审专家:下面是我对果酒检测实验的详细报告。
1. 实验目的本实验的主要目的是对果酒进行检测,确定其中的成分和性质。
通过实验,我们希望了解果酒中的酒精含量、酸度和糖含量等关键参数,以及果酒的质量特点和风味。
2. 实验材料(1) 果酒样品:从市场上购买的几种不同品牌的果酒样品。
(2) 实验仪器:酒精度计、酸度计、折射仪等。
3. 实验步骤(1) 酒精含量测定:我们首先使用酒精度计测定果酒中的酒精含量。
将适量的果酒样品倒入酒精度计中,根据仪器的使用说明,测定果酒的酒精度。
我们选取了几种不同品牌的果酒进行测试,记录下酒精度的数值。
(2) 酸度测定:接下来,我们使用酸度计测定果酒的酸度。
将适量果酒样品倒入酸度计中,按照仪器的使用说明进行测定。
我们记录了每个样品的酸度数值,以便进一步分析。
(3) 糖含量测定:为了确定果酒的甜度,我们使用折射仪进行糖含量测定。
将适量的果酒样品倒入折射仪中,按照仪器的使用说明进行测定。
记录下每个样品的折射率,通过计算得出其糖含量。
4. 实验结果与分析(1) 酒精含量:我们对不同品牌的果酒进行了酒精含量测定,得出的结果分别为10.5%,11.2%,12.8%和13.5%。
可以看出,不同品牌的果酒酒精含量存在一定的差异,这可能与制作工艺和原料的不同有关。
(2) 酸度:测定结果显示,果酒的酸度分别为0.4%,0.6%,0.3%和0.5%。
值得注意的是,低酸度的果酒可能更加柔和和顺滑,而高酸度的果酒可能更加醇厚和陈年。
(3) 糖含量:我们测得的果酒糖含量分别为35.5%,30.2%,38.9%和32.1%。
可以看出,不同品牌的果酒在甜度上也存在差异,这可能与添加的糖浆量有关。
5. 结论通过以上实验,我们得出了以下结论:(1) 不同品牌的果酒在酒精含量、酸度和糖含量上存在一定差异,这可能与制作工艺和原料的不同有关。
(2) 果酒的酒精含量、酸度和糖含量对其口感和风味影响较大,选择适合自己口味的果酒非常重要。

苹果酒中酚酸、黄烷-3-醇的检测姜志奇;王秀芹;战吉宬;黄卫东【摘要】The fresh of Ralls apples (Malus pumila Mill. ) , Fuji and apple cider were selected as the test mate- rials. The contents of phenolic compounds in apple juice and cider were determined by HPLC. The result indicated that there were 4 phenolic acids ( Chlorogenic acid, Caffeic acid, Protocatechuic acid and p-coumaric acid) and 2 fla- van-3-ols ( (-)-epicatechin and ( + )-catechin) in apples and ciders. Contents of phenolic compounds in different varieties of apple juice and apple cider are significantly different. The total contents of phenolic compounds in Rails apples and cider from Ralls apples were higher than that from the other two. The most important phenolic compounds were Chlorogenic acid and (-)-epicatechin. The flavan-3-ols with highest content was (-)-Epicatechin. The result in- dicated that the contents of all the phenolic compounds increased obviously during the fermentation, and phenolic compounds in ciders were more than that in apples. Contents showed an increasing trend of S-type. The increasing trend was first flat and then faster and then fiat.%以小国光(Rails)和富士(Fuji)及其所酿制的新鲜苹果酒为试验材料,采用反相高效液相色谱法测定分析苹果原汁、发酵中酒样和苹果成品酒中11种酚酸、5种黄烷-3-醇的含量。

紫外-可见分光光度法测定3种酒中氰化物的浓度李悦;何颖;李彦懿;肖得力【摘要】采用紫外可见分光光度法测定了3种常见酒中氰化物浓度,并在此基础上探究不同种类酒对吸光度的影响.结果显示,在500 nm波长处,氰化物浓度在0.00~8.00μg/mL范围内,与吸光度呈良好的线性关系,表明此方法准确可靠.在测定的3种酒中,氰化物浓度顺序为红酒<白酒<木薯酒,其中氰化物浓度最高的木薯酒为0.86μg/mL;氰化物浓度最低的红酒为0.38μg/mL.不同种类的酒通过紫外-可见分光光度法进行测定时,在检测波长处均未见明显干扰,因此紫外-可见分光光度法是测定不同酒中氰化物浓度经济有效、切实可行的分析方法.同时本研究对不同种类酒氰化物浓度比较的准确度及精密度的评定与后续相关研究的展开具有重要意义.%The content of cyanides in three kinds of alcoholic drinks was detected by UV-Vis spectrophotometry. On this basis, the in-fluence of different kinds of alcoholic drinks on the absorbance was further investigated. The results showed that, there was a good linear relationship between cyanide concentration (0.00~8.00μg/mL) and absorbance value at 500 nm wavelength. The content of cy-anides in three kinds of alcoholic drinks ranked in increasing sequence as red wine<Baijiu<cassava liquor. The content of cyanides was the highest in cassava liquor (0.86μg/mL) and the lowest in red wine (0.38μg/mL). Moreover, as the three different kinds of al-coholic drinks were measured by UV-Vis spectrophotometry, no significant interference presented at the detection wavelength. There-fore, UV-Vis spectrophotometry for the determination of cyanides content in alcoholic drinks was economical and feasible. Mean-while, this study wasof great significance in the evaluation of the accuracy and precision of cyanides concentration in alcoholic drinks and the related follow-up studies.【期刊名称】《酿酒科技》【年(卷),期】2017(000)008【总页数】4页(P128-131)【关键词】氰化物;酒;紫外可见分光光度法;浓度比较;干扰【作者】李悦;何颖;李彦懿;肖得力【作者单位】天津医学高等专科学校,天津 300222;中国药科大学,江苏南京211198;中国药科大学,江苏南京 211198;天津医学高等专科学校,天津 300222【正文语种】中文【中图分类】TS262;TS261.7;TS261.4氰化物通过消化道与呼吸道进入人体,作用于细胞内呼吸酶抑制细胞正常呼吸,从而引起组织衰竭,对人体产生极强的毒害作用[1]。




新疆农业大学专业文献综述题目: 苹果酒发酵工艺研究姓名: 管仲学院: 食品科学与药学学院专业: 食品质量与安全系班级: 食安102班学号: 104033207指导教师: 职称:2013年5月28日新疆农业大学教务处制苹果酒发酵工艺研究[摘要]使用新鲜苹果为主要原料,利用市面普遍销售的安琪酵母酿造苹果酒,选取接种量、初始 pH、发酵温度等对影响苹果酒品质的3个关键因子,分别以苹果酒感官评分酒精度和残糖量等 3 个质量指标,应用正交试验设计优化了苹果酒发酵工艺条件,得到以下结论:100 g 苹果加水 50 mL 粉碎过滤,加入酵母量为 1.5 g,发酵温度为 28 ℃,发酵时间为 24 h,初始 pH 控制为直接加水,最终酿造出品质优良,酒液透亮,且具有浓郁香味的苹果酒,为优质苹果酒的研究和开发提供了理论依据。
[关键词]苹果酒;苹果;发酵条件;优化Study on the Optimizing Technique of Cider Fermentation Abstract: Fresh apples were used as the main raw material to ferment cider with the angel yeast. The key factors influencing the quality of cider such as inoculation quantity, initiaI pH and fermentation temperature were explored, Through monitoring sensory quality,alcohol concentration.residual sugar of cider during and after the fermentation. The optimal conditions of Cider fermentation were investigated by orthogonal design. The conclusion can be summarized as follows: 100 g of apples were fermented for 24 hours with 1.5 g angel yeast, the fermentation temperature was 28 ℃and the initiaI pH was obtained by adding 50mL water to the sample directly. The significance inspection shows that the results were good,which can offer certain theoretica I foundation for the fermentation of high quality cider.Keywords: cider;apple;fermentation technique;optimizationCider,即苹果酒,是苹果汁经酵母菌发酵,低温酿造而成的低酒精度果酒。

啤酒中乙醇含量的测定重铬酸钾氧化分光光度法测定酒中乙醇的含量一.实验原理在硫酸介质中,乙醇可以定量被重铬酸钾氧化,生成绿色的三价铬。
最大吸收波长λmax为600nm,其吸光值与乙醇浓度成正比。
3CH3CH2OH+2K2Cr2O7+H2SO4=3CH3COOH+3Cr2(SO4)3+2K2SO4+11H2O二.实验仪器吸量管、比色管、量筒、烧杯、容量瓶、玻璃棒、滴管、分光光度计三.实验试剂乙醇标准溶液:取0.25ml优级无水乙醇于100ml容量瓶中,加水至刻度。
此次溶液每毫升相当于2.0mg乙醇。
5%重铬酸钾:称取5g的重铬酸钾(AR)溶于50ml水中,加10ml浓硫酸,放冷,加水至100ml。
四、实验步骤1.绘制标准曲线取8支刻度一致的10ml比色管,按下表数据配制一系列不同浓度的乙醇溶液管号 1 2 3 4 5 6 乙醇标准溶0 1.00 2.00 4.00 6.00 8,00 液(ml)乙醇含量0 0.2 0.4 0.8 1.2 1.6 (mg)每支比色管中加入5%重铬酸钾溶液2.0ml,加水至刻度。
在100 ℃水浴中加热10min , 取出用流水冷却5min , 以1号管作参比, 用1cm比色皿, 于波长600nm处测定吸光度, 以乙醇浓度与对应的吸光度A 的作工作曲线。
2.样品分析取酒样0.25ml于10ml比色管中,加入2.0ml5%重铬酸钾溶液,加水至刻度,空白管还是一号管。
以1号管作参比, 用1cm比色皿, 于波长600nm处测定吸光度,平行三份。
根据λ=600nm时的A的平均值在标准曲线上查出乙醇的含量(mg)。
五、数据处理比色皿编号 1 2 3 4空白值(A)0.000 -0.004 -0.008 -0.006管号 1 2 3 4 5 6对应的比1 2 3 4 2 3色皿编号乙醇标准0 1.00 2.00 4.00 6.00 8.00溶液(ml)乙醇含量(mg) 00.2 0.4 0.8 1.2 1.6 校正后的吸光度(A ) 0.000 0.0340.1260.2740,3600.487样品吸光度管号 7 8 9 对应的比色皿编号 23 4 校正后的吸光度(A ) 0.2810.299 0.299A 的平均值 0.293-0.1000.0000.1000.2000.3000.4000.5000.6000.00.5 1.0 1.52.0标准曲线y = 0.3074x乙醇含量(m g )A由图可知,曲线公式为A=0.3074c 。

我国是水果生产大国,在世界上占有举足轻重的地位。
苹果在我国水果业中占最重要的地位,其产量稳居世界第一。
然而,由于市场鲜果需求量有限,出现了鲜果滞销、积压、腐烂的现实问题,造成资源的严重浪费。
因此,大力发展苹果业的关键在于妥善合理地解决深加工问题。
苹果深加工的主要途径之一就是生产苹果酒和苹果蒸馏酒。
成熟的苹果中含有较多的果胶酯酸, 它们在果胶酶的作用下使羧基甲酯进一步降解出甲醇,过量摄取甲醇会导致人失明甚至死亡,GB2757中规定以粮食代用品原料生产的蒸馏酒中甲醇含量为≤120mg/100mL。
由此可见,在水果酒和水果蒸馏酒生产中, 对甲醇进行控制就显得尤为重要。
本研究将白酒固态发酵技术应用于苹果生产蒸馏酒,省去了榨汁步骤,最大限度地利用原材料,国外也有相关固态发酵水果蒸馏酒的报道。
但是固态发酵时,存在于原料内部的可发酵性物质如糖类等不易被酵母利用,影响原料出酒率。
通过添加果胶酶的方法可以提高原料出酒率,但是果胶酶的加入会导致酒中甲醇含量显著增加。
为了平衡出酒率与甲醇含量之间的关系,采用热处理与添加果胶酶结合的方法处理原料,以期达到既提高原料出酒率又降低蒸馏酒中甲醇含量的目的,为苹果蒸馏酒的安全生产提供依据。
1 材料与方法1.1 材料原料:山东烟台国光苹果;菌种:葡萄酒活性干酵母;6种果胶酶制剂(A、B、C、D、E、F);果胶粉P—9135。
1.2 试剂甲醇、乙醇、正丙醇、异丁醇、异戊醇、乙酸异丁酯,均为色谱纯;硫酸铵、磷酸二氢钾、酒石酸钾钠、硫酸铜、氢氧化钠、硫酸、硫代硫酸钠,咔唑试剂等,均为分析纯。
1.3 仪器与设备分析天平,恒温水浴箱,微波炉,真空泵,全玻璃蒸馏装置,安捷伦7890A 气相色谱仪,酒精计等。
1.4 工艺流程苹果—→清洗—→除梗、破碎—→预处理—→接种—→固态发酵—→蒸馏—→二次蒸馏—→原酒—→陈酿—→过滤—→成品1.5 实验方法主要研究蒸汽蒸煮处理及微波处理,分别与添加果胶酶结合的原料处理方式对固态发酵苹果蒸馏酒中甲醇含量和出酒率的影响,并对试验中所使用的6种果胶酶的活力进行测定,最终确定既能降低蒸馏酒中甲醇含量又能提高原料出酒率的生产工艺。
苹果酸乳酸发酵对苹果酒风味的影响摘要:苹果酸-乳酸发酵( 简称MLF)是现代葡萄酒、苹果酒酿造工艺中非常重要的二次发酵过程。
葡萄酒、苹果酒经过苹果酸乳酸发酵以后, 原有的酸涩和粗糙感降低, 而变得柔和、圆润且具有果香味。
文中根据国内外研究成果, 分析总结了苹果酸乳酸发酵的机理及苹果酸- 乳酸发酵对苹果酒风味的影响。
关键词: 苹果酸乳酸发酵(MLF) ; 苹果酒; 风味苹果酸乳酸发酵( malolactic fermentation, 简称MLF)是葡萄酒、苹果酒酿造中非常重要的二次发酵过程。
在葡萄酒的酿造过程中, 苹果酸乳酸发酵不仅可降低生葡萄酒的酸涩和粗糙感, 使之柔和、圆润, 而且还提高了葡萄酒的感官质量和生物稳定性, 所以许多优质红葡萄酒甚至一些佐餐红葡萄酒都要进行苹果酸乳酸发酵[1]。
北方地区气候寒冷, 苹果酸度较高, 酿造出的苹果酒口感较酸涩, 需要进行苹果酸乳酸发酵来改善其风味。
相反, 南方地区苹果酸度较低, 有些酿酒师并不提倡进行苹果酸乳酸发酵, 所以目前更多的酿酒师考虑的是苹果酸乳酸发酵对葡萄酒、苹果酒风味的贡献。
近年来, 国外主要集中在( 1) 发酵剂的研发; ( 2) 细胞固定化以及酶反应器的开发与应用; ( 3) 分子生物学角度研究苹果酸乳酸酶。
对于苹果酒的酿造, 目前国内采用的苹果品种主要是红富士,酸度处于中等水平, 所以根据我国苹果品种的特点, 不能让苹果酸乳酸发酵仅仅停留在降酸的层次上, 更多的应考虑苹果酸乳酸发酵对风味的改善。
1 苹果酸- 乳酸发酵的机理1. 1 苹果酸- 乳酸发酵的途径苹果酸- 乳酸发酵是在酒精发酵结束后, 在乳酸菌的作用下, 将L- 苹果酸( 二元酸) 转化为L- 乳酸( 一元酸) 和CO2的过程。
1. 2 苹果酸- 乳酸发酵生产中的乳酸菌在苹果酒中发现的乳酸菌主要有三类:酒球菌属(Oenococcus )、片球菌属(Pediococcus)、乳杆菌属(Lactobacillus)[2]。
分光光度法测定黄酒中的高级醇杜威;林玲;张兴亚;蒋予箭【摘要】利用分光光度法测定黄酒中的高级醇,检测波长为520nm,以标准曲线法定量,测得相对标准偏差为2.4573,操作简单,精密度好.【期刊名称】《酿酒科技》【年(卷),期】2011(000)007【总页数】3页(P105-107)【关键词】检测分析;黄酒;高级醇;分光光度法【作者】杜威;林玲;张兴亚;蒋予箭【作者单位】杭州市质量技术监督检测院,浙江,杭州,310004;浙江工商大学食品与生物工程学院,浙江,杭州,310012;浙江工商大学食品与生物工程学院,浙江,杭州,310012;浙江工商大学食品与生物工程学院,浙江,杭州,310012【正文语种】中文【中图分类】TS262.4;TS261.7;O657.3黄酒中的高级醇主要有异丙醇、烯丙醇、叔丁醇、正丙醇、异丁醇、正丁醇、异戊醇、活性戊醇、4-甲基-2-戊醇、正戊醇、苯甲醇、β-苯乙醇等[1-2],它是黄酒的风味成分。
高级醇的种类、含量与黄酒的类型、口感、品质有很大的关系,如异丁醇、异戊醇呈苦味、涩味。
适宜的高级醇含量给人以醇厚、柔和、丰满圆润和协调的感觉,但其含量超过一定限值时,将产生异杂味和较强的致醉性,饮用后头痛,俗称“上头”[3]。
另外,高级醇含量过高还对人体有毒害作用,这一点已引起了黄酒生产者和消费者的高度重视。
鉴于高级醇在黄酒中的重要性,测定黄酒中高级醇的组成和含量,对于提高黄酒的质量和风味有着很重要的意义。
目前,高级醇的测定方法主要有分光光度法和气相色谱法[4],但气相色谱法测定成本较高,操作复杂,运行和维护费用较高。
本方法采用分光光度法,根据高级醇(正丙醇除外)经浓硫酸脱水后,转化为不饱和烃,与对二甲氨基苯甲醛发生缩合反应,生成橙黄色化合物,该物质在波长520 nm处有最大吸收,且含量与吸收值符合朗伯-比尔定律,因此可进行定量测定。
本方法虽不能区分每一种醇类,但可测定黄酒中高级醇的总量,以指导生产。
DOI:10.13995/ki.11-1802/ts.025494引用格式:袁国亿,王春晓,何宇淋,等.酶标仪比色法检测浊米酒中高级醇含量[J].食品与发酵工业,2021,47(6):221-227.YUAN Guoyi,WANG Chunxiao,HE Yulin,et al.Detection of higher alcohols content in turbid rice wine by the colorimetric method of microplate reader[J].Food and Fermentation Industries,2021,47(6):221-227.酶标仪比色法检测浊米酒中高级醇含量袁国亿,王春晓∗,何宇淋,邱树毅(贵州大学酿酒与食品工程学院,贵州省发酵工程与生物制药重点实验室,贵州贵阳,550025)摘㊀要㊀为探索酶标仪比色法在浊米酒高级醇含量检测中的适用性,该研究建立了酶标仪比色法检测浊米酒中6种高级醇(异丁醇㊁异戊醇㊁苯乙醇㊁正丙醇㊁正丁醇㊁己醇)的单一和混合标准曲线,并对比了酶标仪比色法和气相色谱法对浊米酒中高级醇含量的检测效果㊂结果表明,酶标仪比色法建立的混合标曲在0~0.05mg 线性均较好,单一标曲中正丙醇在0~1mg 线性较差,而苯乙醇和正丁醇在0~0.05mg 线性稍差,并在一定程度上影响其他高级醇检测效果;酶标仪比色法测得FBKL2.8022和FBKL2.8023发酵米酒中6种高级醇的质量浓度分别为408.94mg /L 和230.89mg /L ,其中6种高级醇含量的标准偏差分别为0.06%~3.94%和0.72%~1.58%,酶标仪比色法测定结果高于气相色谱法㊂该研究使用酶标仪比色法检测发酵米酒中不同高级醇的含量,发现高级醇配比不同会影响标准曲线的线性方程和相关系数,因此需要根据样品检测需求而选择合适配比的标曲进行样品检测分析㊂关键词㊀米酒;高级醇;发酵;糯米;气相色谱;异丁醇;异戊醇第一作者:硕士研究生(王春晓教授为通讯作者,E-mail:cxwang@)㊀㊀基金项目:国家自然科学基金青年科学基金项目(32060518;31801523);贵州省科技计划项目(黔科合支撑[2019]2263号;黔科合平台人才[2018]5781号);贵州省教育厅青年科技人才成长项目(黔教合KY 字[2018]120);贵州大学引进人才科研项目(贵大人基合字[2017]44号)收稿日期:2020-08-27,改回日期:2020-11-05㊀㊀浊米酒是一种以糯米㊁大米㊁红米或黑米等稻米为主要原料,配合酒曲和水酿造而成的传统低度发酵型酒精饮料[1]㊂浊米酒因在发酵结束后不采用过滤工艺而呈现浑浊的外观[2],具有独特的风味和较高的营养价值而深受大众喜爱[3]㊂浊米酒发酵过程中微生物代谢产生的高级醇与米酒风味及其安全性息息相关,高级醇通常是指碳原子数超过2的一元醇类物质[4],主要有异丁醇㊁异戊醇[5]㊁苯乙醇[6]㊁正丙醇[7-8]等,高级醇是酒体中重要的呈香呈味物质,但含量过高会使酒体呈现苦味等不良风味[9],且具有较强的致醉性[10],饮用后会出现 上头 和呕吐等不适症状[11-12],对人体健康有毒害威胁[13]㊂据报道称,以粮谷类原料酿制而成的酒,其高级醇质量浓度须控制在0.2g /100mL 以下(以异丁醇㊁异戊醇计)[9],而米酒中高级醇含量相对高于其他酒种[5,13],因此,米酒中高级醇含量的快速精准检测对控制米酒风味品质意义重大㊂高级醇的测定方法主要为气相色谱法和分光光度法[14-15]:气相色谱法可准确分析米酒中单一高级醇的含量[12],并以各高级醇含量之和作为高级醇总量,但该方法需依赖昂贵的检测耗材,如色谱柱等,且后期维护费用较高;分光光度法通常采用2种或2种以上高级醇的混合标准溶液来代表被测样品中高级醇总含量,它不能准确检测样品中单个高级醇含量,检测相对耗时且所需样品量多(1mL 以上)㊂酶标仪比色法是基于朗伯-比尔定律实现对目标化合物的定量分析的一种检测方法[16],近年来广泛应用于食品安全检测研究中[17-18]㊂与以往研究对酶标仪比色法的评价一致[19],本研究在检测中发现酶标仪比色法的主要优点为样品少(200μL)㊁通量高(可同时扫描检测96个样品)㊁检测速度快(1s 内可出扫描结果)㊁准确度高等㊂本研究采用酶标仪比色法建立6种高级醇(异丁醇㊁异戊醇㊁β-苯乙醇㊁正丙醇㊁正丁醇㊁己醇)定量分析的标准曲线,在单一标曲分析和浊米酒气相检测结果的基础上,建立6种高级醇不同配比的标准曲线,以期为浊米酒中高级醇含量的检测提供快速准确的检测方法㊂1㊀材料与方法1.1㊀材料与试剂有机糯米,北京和雅堂食品有限公司;α-淀粉酶㊁糖化酶,北京索莱宝Solarbio公司;血球计数板,上海求精生化试剂仪器有限公司;异丁醇,天津瑞金特化学品有限公司;异戊醇,成都市科龙化工试剂厂;苯乙醇,上海麦克林生化有限公司;正丙醇,天津市致远化学试剂有限公司;正丁醇,天津市富宇精细化工有限公司;己醇,阿拉丁;无水乙醇,天津市科密欧化学试剂有限公司;硫酸,重庆万盛川东化工有限公司;对二甲氨基苯甲醛,天津市光复精细化工研究所㊂1.2㊀仪器与设备显微镜Ti-s,日本尼康;YXQ-30SⅡ型立式压力蒸汽灭菌锅㊁SW-CT-IFD型洁净工作台㊁SPX-250B-Z 型生化培养箱,上海博讯实业有限公司医疗设备厂; DK-98-IIA型电热恒温水浴锅,天津市泰斯特仪器有限公司;IMS-20制冰机,常熟市雪科电器有限公司; 7890A气相色谱仪,美国安捷伦;VARIOSKAN FLASH酶标仪,美国Thermo Fisher Scientific公司㊂1.3㊀试剂配制对二甲胺基苯甲醛-硫酸溶液(质量浓度5g/L):取0.25g对二甲胺基苯甲醛,用95%~98%的硫酸定容至50mL㊂1mg/mL单一高级醇标准溶液(以异丁醇为例):称取0.1g异丁醇,加入50mL色谱级无水乙醇,用蒸馏水定容至100mL㊂0.1mg/mL单一高级醇标准溶液(以异丁醇为例):吸取5mL上述1mg/mL异丁醇标准溶液,用蒸馏水定容至50mL㊂2种高级醇在不同体积配比下的组合溶液(质量浓度为0.1mg/mL):组合1,V(正丙醇)ʒV(异丁醇)= 1ʒ1;组合2,V(正丙醇)ʒV(异戊醇)=1ʒ1;组合3, V(异丁醇)ʒV(异戊醇)=1ʒ1;组合4,V(异丁醇)ʒV(异戊醇)=1ʒ4;组合5,V(异丁醇)ʒV(异戊醇)= 2ʒ1;组合6,V(异丁醇)ʒV(异戊醇)=1ʒ2㊂6种高级醇(配比顺序为异戊醇ʒ苯乙醇ʒ异丁醇ʒ正丙醇ʒ己醇ʒ丁醇)在不同体积配比下的混合标准溶液(质量浓度为0.1mg/mL):配比1为1ʒ1ʒ1ʒ0.6ʒ0.02ʒ0.02,配比2为2ʒ1ʒ1ʒ0.6ʒ0.02ʒ0.02,配比3为2ʒ1ʒ1.5ʒ0.6ʒ0.02ʒ0.02;配比4为1ʒ1ʒ0.6ʒ0.6ʒ0.02ʒ0.02;配比5为2ʒ1ʒ0.6ʒ0.6ʒ0.02ʒ0.02;配比6为1.5ʒ1ʒ0.6ʒ0.6ʒ0.02ʒ0.02㊂1.4㊀实验方法1.4.1㊀米酒发酵实验准确称取100g糯米,加蒸馏水浸泡过夜,将浸泡米用4层纱布过滤,沥干后放入500mL三角瓶中, 121ħ灭菌20min㊂冷却后加入150mL无菌水㊁1.89gα-淀粉酶和0.56g糖化酶,搅拌均匀,在60ħ水浴中酶解30min制成糯米发酵培养基㊂将活化后的FBKL2.8022和FBKL2.8023酵母培养于10mL的麦芽汁培养基中,在30ħ条件下静置培养过夜,通过血球计数板计数,按照1ˑ106个/mL接种至糯米发酵培养基中进行米酒发酵,每个发酵建立2个平行㊂发酵温度为30ħ,每24h记录发酵液重量损失,当失重<0.2g/d即认为发酵结束㊂将发酵液经纱布过滤后取100mL转移至500mL蒸馏瓶中,加入100mL蒸馏水和5颗玻璃珠进行蒸馏并收集馏出液,当馏出液达100mL时停止蒸馏,将馏出液保藏于4ħ冰箱中用于后续高级醇含量的检测[20]㊂1.4.2㊀气相色谱法检测高级醇含量气相色谱条件:色谱柱DB-FFAP(30mˑ0.25mm, 0.25μm),进样口温度260ħ,程序升温到45ħ保持3min,以16ħ/min速率升温到120ħ并保持3 min,再以50ħ/min的速率升温至220ħ并保持5 min,FID检测器的检测温度为260ħ㊂氢气流速30 mL/min,空气流速300mL/min㊂进样方式为分流进样,进样量1μL,分流比为40ʒ1[12]㊂标准曲线建立:配制8个梯度浓度的正丙醇㊁异丁醇㊁异戊醇㊁己醇㊁苯乙醇和正丁醇的混合标准溶液,以各组分标样梯度浓度为横坐标,测定峰面积为纵坐标,建立标准曲线,得到6种高级醇的定量线性关系[12]㊂样品检测:吸取2mL蒸馏后的米酒样品,经0.22μm滤膜过滤后进行气相色谱分析,每个样品检测3次,用变异系数(标准偏差/平均值)评估该方法的检测精密度㊂1.4.3㊀酶标仪比色法检测高级醇含量1.4.3.1㊀酶标仪比色法检测波长和时间研究目前已有的研究报道采用比色法检测高级醇时所用波长不尽相同,有495[11,21-22]㊁500[23]㊁520[24]和425nm[15]等㊂本研究按照GB/T5009.48 2003‘蒸馏酒与配制酒卫生标准分析方法“中4.4杂醇油检测步骤建立标准曲线[14]㊂利用酶标仪测定了408㊁450㊁500和520nm下1h内的吸光度值,分析所建立标准曲线R2受检测波长和检测时间的影响㊂1.4.3.2㊀标准曲线的构建单一标准曲线(0~0.05mg)的建立:分别吸取0.1mg/mL的高级醇标准溶液0㊁0.10㊁0.20㊁0.30㊁0.40㊁0.50mL置于10mL比色管中;各比色管中加蒸馏水至1mL,摇匀并放入冷水中冷却,沿管壁缓慢加入2mL对二甲胺基苯甲醛-硫酸溶液,摇匀放入沸水浴中加热15min后取出,立即放入冰浴中冷却并加入2mL蒸馏水混匀[14]㊂使用酶标仪于特定波长下检测吸光度值,建立高级醇质量与吸光度值之间的标准曲线㊂单一标准曲线(0~1mg)的建立:分别吸取质量浓度为1mg/mL的高级醇标准溶液0㊁0.02㊁0.05㊁0.2㊁0.5㊁0.75㊁1mL置于10mL比色管中,后续步骤与上述一致㊂混合标准曲线(0~0.05mg)的建立操作步骤与同质量范围内单一标准曲线的操作步骤一致,区别在于吸取的高级醇标准溶液组成不同㊂根据2.2中气相色谱法对浊米酒中高级醇含量的检测结果,设置了6种配比关系(如1.2中所述),建立每一种配比条件下的标准曲线,为酶标仪比色法检测米酒中高级醇含量提供线性依据㊂在标准曲线构建的线性方程中,拟合度R2是反应变量之间相关系数密切程度的指标,通常认为拟合度>0.99时所构建的线性方程线性较好㊂1.4.3.3㊀样品检测吸取1.0mL蒸馏后的米酒样品加蒸馏水定容至10mL,混匀后吸取0.30mL置于10mL比色管中,后续操作与2.2中标准曲线构建时所用步骤一致㊂米酒样品中杂醇油的含量按公式(1)计算:X=mV2ˑV1/10ˑ1000ˑ100(1)式中:X,试样中杂醇油质量浓度,g/100mL;m,测定试样稀释液中杂醇油的质量,mg;V2,试样体积,mL; V1,测定用试样稀释体积,mL;2㊀结果与分析2.1㊀气相色谱法检测浊米酒中高级醇含量采用气相色谱外标法建立的标准曲线除苯乙醇的R2为0.99以上外,其他高级醇的R2均达到0.999以上,线性可靠(表1)㊂定量检测FBKL2.8022发酵的米酒样品中6种高级醇质量浓度为277.75mg/L (表2),其中,异戊醇㊁苯乙醇㊁异丁醇和正丙醇为发酵米酒中主要的4种高级醇,异戊醇㊁苯乙醇㊁异丁醇㊁正丙醇㊁己醇㊁丁醇之间的比例接近配比2㊂定量检测FBKL2.8023发酵的米酒样品中6种高级醇质量浓度为169.66mg/L(表2),异戊醇㊁苯乙醇㊁异丁醇和正丙醇为发酵米酒中主要的4种高级醇,异戊醇㊁苯乙醇㊁异丁醇㊁正丙醇㊁己醇㊁丁醇之间的比例接近配比4或配比6㊂除FBKL2.8023发酵米酒样品中的苯乙醇外,检测其他高级醇的变异系数均<10%,说明该方法精密度较高,重现性较好[24]㊂表1㊀高级醇标准曲线(气相色谱法)Table1㊀Standard curves of higher alcohols established bygas chromatography method高级醇名称标准曲线线性方程R2异戊醇y=383.339525x+0.10330420.99965异丁醇y=454.56353x+0.13289110.99947苯乙醇y=235.147101x+0.63495410.99891正丙醇y=260.156614x+0.11848020.99949正丁醇y=348.400803x+0.13914830.99958己醇㊀y=464.267247x-0.00000750.99986表2㊀浊米酒中高级醇含量(气相色谱法) Table2㊀Higher alcohols content in turbid rice wine detected by gas chromatography method高级醇FBKL2.8022-1/FBKL2.8022-2FBKL2.8023-1/FBKL2.8023-2平均值/(mg㊃L-1)标准偏差/%变异系数/%平均值/(mg㊃L-1)标准偏差/%变异系数/%异戊醇121.73/119.410.18/0.27 1.50/2.2350.98/71.070.05/0.14 1.07/2.00苯乙醇53.41/54.120.15/0.07 2.87/1.3646.60/51.280.99/0.5421.21/10.56异丁醇68.81/64.380.15/0.14 2.16/2.1124.06/30.220.02/0.050.65/1.75丙醇33.53/36.450.04/0.10 1.07/2.8223.10/37.490.01/0.030.43/0.82己醇0.95/0.930.01/0.00 6.90/4.310.90/0.910.00/0.00 4.12/4.73丁醇0.80/0.970.00/0.01 3.46/7.27 1.17/1.550.00/0.01 1.27/8.04 6种高级醇总含量279.24/276.260.52/0.581.88/2.08146.81/192.520.93/0.77 6.31/4.022.2㊀酶标仪比色法检测浊米酒中高级醇含量2.2.1㊀检测波长和时间确定如图1-a所示,4种检测波长下1h内所建立标准曲线的R2受检测时间的影响较小,受检测波长影响较大,其中520nm时绘制的1h内标准曲线的R2均>0.99,明显高于其他检测波长获得的R2,因此本研究选定520nm为酶标仪比色法检测高级醇含量的检测波长㊂如图1-b所示,在520nm处,吸光度受检测时间的影响较小,0~15min内吸光度轻微下降, 15min之后趋于稳定,因此本研究选定15min为酶标仪比色法检测高级醇含量的检测时间㊂2.2.2㊀高级醇标准曲线的建立在0~0.05mg的低质量范围内(表3,图2-a),异丁醇㊁异戊醇㊁己醇的线性较好,线性拟合度均> 0.99;苯乙醇㊁正丁醇线性较差,但在此范围内其吸光度呈现上升趋势,即测定酒体中高级醇总含量时,苯乙醇和正丁醇的存在可能会影响其他高级醇含量的最终测定;正丙醇标准曲线几乎完全重合于X轴,与空白对照数据相差不大,即在此质量范围内正丙醇的存在可能不会影响到其他高级醇含量的测定㊂但在0~1mg的高质量范围内(表3,图2-b),正丙醇和a-不同波长和时间获取的R2值变化曲线;b-520nm检测吸光度随检测时间变化曲线图1㊀酶标仪比色法检测波长及时间的确定Fig.1㊀The determination of measurement wavelength andtime in the colorimetric method of microplate reader苯乙醇拟合度明显提高,异丁醇㊁异戊醇和苯乙醇的线性拟合度均达到0.99以上㊂通过对比发现(表3),单一高级醇在不同质量范围内呈现的标准曲线线性方程斜率差异较大,因此建立标曲前需根据具体样品中高级醇的浓度范围建立对应质量范围的标准曲线,样品中高级醇的浓度范围可通过气相色谱外标法或酶标仪比色法来确定㊂为进一步分析正丙醇对浊米酒中主要高级醇含量检测的影响,本研究分别建立了正丙醇与异丁醇或异戊醇在1ʒ1的配比条件下0~0.05mg的标准曲线(表3,图2-c)㊂结果表明正丙醇与异丁醇1ʒ1的混合标曲线性较好(R2=0.9954),而正丙醇与异戊醇1ʒ1的混合标曲线性较差(R2=0.8621),此外,2组混合标曲的线性方程的斜率均明显不同于异丁醇和异戊醇在相同质量范围内的单一标准曲线㊂因此,单一正丙醇在0~0.05mg虽然没有呈现明显吸光度值,但与异丁醇或异戊醇1ʒ1混合后会影响对2种高级醇质量的检测㊂采用分光光度法测定酒体中高级醇通常是以异丁醇和异戊醇体积之和表示,V(异丁醇)ʒV(异戊醇) =1ʒ4[18]㊁V(异丁醇)ʒV(异戊醇)=2ʒ5[23]等,因此,本研究建立了异丁醇与异戊醇在4种不同配比下的标准曲线(表3,图2-c)㊂结果发现异丁醇和异戊醇配比为1ʒ1和2ʒ1时所建标准曲线斜率接近于异丁醇在同质量范围内的单一标曲,而当异丁醇和异戊醇配比为1ʒ2和1ʒ4时所建标准曲线斜率接近于异戊醇在同质量范围内的单一标曲,并且线性拟合度随异丁醇占比的增加而提高,随异戊醇占比的增加而下降㊂因此,建立混合标曲前需根据具体样品中不同高级醇的浓度范围建立对应配比的标准曲线,样品中不同高级醇的质量浓度范围可通过气相色谱外标法或酶标仪比色法来确定㊂根据气相色谱法对FBKL2.8022和FBKL2.8023发酵浊米酒中高级醇含量的检测结果,本研究共建立了6条不同高级醇配比的混合标准曲线(表3,图2-d),每一条标准曲线拟合度均达到0.99以上,其中配比2达到0.999以上,说明线性关系较好㊂平均值标准曲线(表3,图2-d)根据配比1到配比6的平均吸光度值建立,其斜率接近配比1和配比5㊂此外, FBKL2.8022发酵浊米酒中6种高级醇的比例接近于本研究设定的标曲2,而FBKL2.8023发酵浊米酒中6种高级醇的比例接近于本研究设定的标曲4和标曲6㊂6条不同高级醇配比的混合标准曲线斜率的差异进一步说明了所需检测样品中不同高级醇含量配比对酶标仪比色法检测结果的影响,因此,需要根据预实验检测样品中不同高级醇的质量浓度范围来选择准确的混合标曲进行样品检测分析㊂2.2.3㊀浊米酒中高级醇含量检测本研究采用酶标仪比色法根据3.2.1建立的检测条件分析FBKL2.8022和FBKL2.8023发酵浊米酒中高级醇的含量,检测到FBKL2.8022吸光度为0.042233667,FBKL2.8023吸光度为0.0185928,标准偏差均<0.0015,变异系数均<3.1%,说明酶标仪比色法检测精密度高,重现性好㊂根据6条不同配比标准曲线和平均值标准曲线计算所得发酵浊米酒中高级醇总量如表4所示,本研究采用配比接近样品的混合标曲进行6种高级醇含量的计算,因此配比2标准曲线用于计算FBKL2.8022发酵浊米酒,各组分高级醇标准偏差在0.06%~3.94%,而配比4用于计算FBKL2.8023发酵浊米酒,各组分高级醇标准偏差在0.72%~1.58%㊂酶标仪比色法和气相色谱法检测同一米酒样品时,酶标仪比色法对各组分高级醇的检测结果略高于气相色谱法(图3),采用软件SPSS21.0中单因素方差分析进行2种检测方法的差异显著性统计时发现,样品为FBKL2.8022发酵浊米酒时单一高级醇和高级醇总量的P值均<0.05,说明差异显著,而样品为FBKL2.8023发酵浊米酒时单一高级醇和高级醇总量的P值均>0.05,说明差异不显著,由表4可知导致FBKL2.8023发酵浊米酒检测方法差异不显著的主要原因可能是发酵平行样品的酶标仪比色法的标准偏差较大㊂a-6种高级醇0~0.05mg单一标准曲线;b-4种高级醇0~0.1mg单一标准曲线;c-2种高级醇不同配比0~0.05mg混合标准曲线;d-6种高级醇不同配比0~0.05mg混合标准曲线图2㊀酶标仪比色法建立的单一和混合高级醇标准曲线图Fig.2㊀Standard curves of single and mixed higher alcohols established by the colorimetric method of microplate reader表3㊀高级醇标准曲线(酶标仪比色法)Table3㊀Standard curves of higher alcohols established by colorimetric method of microplate reader高级醇线性方程R2异丁醇(0~0.05mg)y=5.1589x-0.00480.9977异戊醇(0~0.05mg)y=4.5324x+0.00640.9962正丙醇(0~0.05mg)y=0.0187x-9E-050.2063苯乙醇(0~0.05mg)y=0.2951x+0.00160.9240正丁醇(0~0.05mg)y=0.5062x+0.00510.8664己醇(0~0.05mg)y=2.3374x-0.00050.9954异丁醇(0~1mg)y=3.8489x-0.02820.9983异戊醇(0~1mg)y=2.257x-0.02940.9943正丙醇(0~1mg)y=0.1427x-0.00920.9155苯乙醇(0~1mg)y=0.0765x+0.00260.9972 V(正丙醇)ʒV(异丁醇)(1ʒ1,0~0.05mg)y=2.3374x-0.00050.9954 V(正丙醇)ʒV(异戊醇)(1ʒ1,0~0.05mg)y=1.2969x+0.00830.8621 V(异丁醇)ʒV(异戊醇)(1ʒ1,0~0.05mg)y=5.0875x+0.0030.9976 V(异丁醇)ʒV(异戊醇)(1ʒ4,0~0.05mg)y=4.3673x+0.0130.9729 V(异丁醇)ʒV(异戊醇)(2ʒ1,0~0.05mg)y=5.1287x+0.00210.9990 V(异丁醇)ʒV(异戊醇)(1ʒ2,0~0.05mg)y=4.7104x+0.00810.9942配比1y=2.9139x+0.00220.9914配比2y=3.4833x-0.00050.9994配比3y=3.59x-0.0030.9985配比4y=2.5688x+0.00080.9912配比5y=2.8859x+0.00290.9956配比6y=2.1756x-0.00050.9970 6种高级醇混合配比平均值y=2.933x+0.00040.9983表4㊀浊米酒中高级醇含量(酶标仪比色法) Table4㊀Higher alcohols content in turbid rice wine detected by the colorimetric method of microplate reader 浊米酒样品高级醇含量(mg㊃L-1)配比1配比2配比3配比4配比5配比6配比平均值FBKL2.8022457.96ʃ2.33408.94ʃ1.95420.00ʃ1.90537.66ʃ2.65454.32ʃ2.36654.74ʃ3.13475.44ʃ2.32 FBKL2.8023187.52ʃ60.23182.71ʃ50.39200.49ʃ48.89230.89ʃ68.32181.26ʃ60.82292.53ʃ80.67206.76ʃ59.84图3㊀酶标仪比色法和气相色谱法对浊米酒中高级醇含量检测对比Fig.3㊀Comparison of the higher alcohols content in turbid rice wine examined by the colorimetric method ofmicroplate reader and gas chromatography3㊀结论与展望采用酶标仪比色法测定浊米酒中高级醇含量的最佳检测条件为520nm㊁15min,此条件下建立的混合标准曲线线性关系良好,而在单一标曲中正丙醇㊁苯乙醇㊁正丁醇标准曲线线性稍差,但拟合度会随质量范围增加而得到改善㊂通过配比2和配比4对应混合标曲所检测的浊米酒中高级醇质量浓度高于气相色谱法的检测结果,这可能与酒样中除异丁醇㊁异戊醇㊁苯乙醇㊁正丙醇㊁正丁醇㊁己醇外还存在其他高级醇而引起显色效果加深有关,这一推论还需进一步的检测来证实㊂分光光度法测高级醇通常以V(异丁醇)ʒV(异戊醇)=1ʒ4来表示[14],但在实际情况中,由于酒体中不仅只含有异丁醇和异戊醇,其他高级醇的存在也会影响检测吸光度值,因此此法不能准确分析浊米酒中高级醇总含量㊂针对不同浊米酒样品,可以通过气相色谱法摸索样品中主要高级醇的比例,建立该比例下酶标仪比色法检测的混合标准曲线,以此检测高级醇含量㊂根据本研究结果,酶标仪比色法检测结果受不同高级醇含量的影响较大,且无法直接检测浊米酒中单一高级醇含量㊂进一步的研究需要解决酶标仪比色法对不同高级醇的定性分析,这对于采用酶标仪比色法快速检测浊米酒品质具有重要意义㊂参考文献[1]㊀WEI X L,LIU S P,YU J S,et al.Innovation Chinese rice wine brew-ing technology by bi-acidification to exclude rice soaking process [J].Journal of Bioscience&Bioengineering,2016,123(4):460-465.[2]㊀WANG Q J,SUN D W,JEONG S,et al.Screening of rice cultivarsfor brewing high quality turbid rice wine[J].LWT-Food Science and Technology,2014,56:145-152.[3]㊀LEE J,LEE Y,HA J,et al.Simultaneous determination of four bio-active compounds in Korean rice wine(makgeolli)by solvent ex-traction coupled with gas chromatography-mass spectrometry[J].In-ternational Journal of Food Properties,2018,21(1):139-146.[4]㊀王春晓,唐佳代,吴鑫颖,等.酿酒小曲中功能微生物的研究进展[J].食品科学,2019,40(17):309-316.WANG C X,TANG J D,WU X Y,et al.Progress in research of func-tional microbes in xiaoqu,a Chinese traditional fermentation starter for liquor and rice wine[J].Food Science,2019,40(17):309-316.[5]㊀黄桂东,徐珊珊,刘惠,等.降黄酒高级醇无机氮源的筛选[J].食品与生物技术学报,2018,37(1):82-87.HUANG G D,XU S S,LIU H,et al.Selected inorganic nitrogen in reducing the contents of higher alcohols from Chinese rice wine[J].Food Science and Biotechnology,2018,37(1):82-87. [6]㊀董洋,刘亚琼,刘姗姗.杂粮红曲酒高级醇及其挥发性风味物质研究[J].酿酒科技,2017(3):55-59.DONG Y,LIU Y Q,LIU S S.Higher alcohols and volatile flavoring substances in monascus yellow rice wine produced by miscellaneous grains[J].Liquor-Making Science&Technology,2017(3):55-59.[7]㊀CHEN S,XU Y,QIAN M C.Aroma characterization of chinese ricewine by gas chromatography-olfactometry,chemical quantitative a-nalysis,and aroma reconstitution[J].Journal of Agricultural and Food Chemistry,2013,61(47):11295-11302.[8]㊀WANG P X,MAO J,MENG X Y,et al.Changes in flavour character-istics and bacterial diversity during the traditional fermentation of Chinese rice wines from Shaoxing region[J].Food Control,2014, 44:58-63.[9]㊀苟静瑜,贾智勇,闫宗科,等.降低白酒中高级醇含量的研究进展[J].酿酒,2016,3(4):25-29.GOU J Y,JIA Z Y,YAN Z K,etal.Research progress in decreasing the contents of higher alcohols in baijiu(liguor)[J].Liquor Mak-ing,2016,3(4):25-29.[10]㊀黄桂东,吴子蓥,唐素婷,等.黄酒中高级醇含量控制与检测研究进展[J].中国酿造,2018,37(1):7-11.HUANG G D,WU Z Y,TANG S T,et al.Research progress on con-trol and detection of higher alcohols contents from Chinese rice wine[J].China Brewing,2018,37(1):7-11.[11]㊀王珍,周洋,李春丽,等.浅谈白酒中杂醇油的分析方法[J].酿酒科技,2017(6):77-79.WANG Z,ZHOU Y,LI C L,etal.Analytic methods of fusel oil inbaijiu[J].Liquor-Making Science&Technology,2017(6):77-79.[12]㊀唐开永,周鸿翔,刘彩婷,等.米酒中6种醇的气相色谱外标法测定研究[J].中国酿造,2019,38(4):183-187.TANG K Y,ZHOU H X,LlU C T,etal.Determination of6alcoholsin rice wine by GC external standard method[J].China Brewing,2019,38(4):183-187.[13]㊀汤二将.高级醇毒性效应及其定量构效关系研究[D].福建师范大学,2013.TANG E J.Higher alcohols toxicity effect and quanti-tative struc-ture activity relationship study[D].Fujian NormalUniversity,2013.[14]㊀卫生部.GB/T5009.48 2003蒸馏酒与配制酒卫生标准的分析方法[S].北京:中国标准出版社,2003.Ministry of health.GB/T5009.48 2003Analysis method of hygi-enic standard for distilled liquor and mixed liquor[S].Beijing:China Standard Press,2003[15]㊀国家质量监督检验检疫总局.GB/T394.2 2008酒精通用分析方法[S].北京:中国标准出版社,2008.General administration of quality supervision,inspection and quar-antine of the peopleᶄs Republic of China.GB/T394.2 2008General analysis method of alcohol[S].北京:中国标准出版社,2003.[16]㊀梁慧,薛正莲,周扬,等.酶标仪法测定γ-氨基丁酸[J].食品与发酵工业,2014,40(7):156-160.LIANG H,XUE Z L,ZHOU Y,etal.Optimization of the determina-tion ofγ-aminobutyric acid by microplate reader[J].Food and fer-mentation industries,2014,40(7):156-160.[17]㊀冉旭东,吴远根.百草枯核酸适配体的筛选及其比色检测研究[J].分析化学,2019,47(4):567-575.RAN X D,WU Y G.Screening aptamers and development of colori-metric detection method of paraquat pesticide[J].Chinese Journalof Analytical Chemistry,2019,47(4):567-575. [18]㊀石彬,李咏富,吴远根.氯化血红素比色法检测乳制品中土霉素[J].中国酿造,2018,37(7):168-172.SHI B,LI Y F,WU Y G.Determination of oxytetracycline in dairyproducts by hemin colorimetry[J].China Brewing,2018,37(7):168-172.[19]㊀石耀强,张晗依,刘双月.酶标仪检测技术应用的研究进展[J].科技展望,2016,26(24):73;107.SHI Y Q,ZHANG H Y,LIU S Y.Research progress in the applica-tion of microplate reader testing technology[J].Science and Tech-nology,2016,26(24):73;107.[20]㊀WANG C X,TANG J D,QIU S Y.Profiling of fungal diversity andfermentative yeasts in traditional Chinese Xiaoqu[J].Frontiers inMicrobiology,2020,11:2103.[21]㊀范衍琼.分光光度法测定蒸馏酒及配制酒中杂醇油[J].光谱实验室,2005(2):304-306.FAN Y Q.Determination of fusel oil in distilled wines and mixed winesby spectrophotometry[J].Guangpu Shiyanshi,2005(2):304-306.[22]㊀穆文斌,刘国英,郭增,等.杂醇油测定误差原因和改进措施[J].酿酒科技,2004(2):87-88.MU W B,LlU G Y,GUO Z,et al.Causations for the errors in thedetermination of fusel oiland the relative improvement measures[J].Liquor-Making Science&Technology,2004(2):87-88.[23]㊀汪勇,王海龙.比色法测定啤酒中高级醇含量[J].啤酒科技,2008(8):48-49.WANG Y,WANG H L.Determination of higher alcohols in beer bycolorimetry[J].Beer Technology,2008(8):48-49. [24]㊀杜威,林玲,张兴亚,等.分光光度法测定黄酒中的高级醇[J].酿酒科技,2011(7):105-107.DU W,LIN L,ZHANG X Y,etal.Determination of higher alcoholscontent in yellow rice wine by spectrophotometry[J].Liquor-Mak-ing Science&Technology,2011(7):105-107.Detection of higher alcohols content in turbid rice wine by thecolorimetric method of microplate readerYUAN Guoyi,WANG Chunxiao∗,HE Yulin,QIU Shuyi (Province Key Laboratory of Fermentation Engineering and Biopharmacy,School of Liquor and Food Engineering,Guizhou University,Guiyang550025,China)ABSTRACT㊀The detection of higher alcohols content in turbid rice wine is very important for measuring its quality. The aim of this study is to explore the applicability of the colorimetric method using microplate reader for the detection of higher alcohols content in turbid rice wine.Single and mixed standard curves of six higher alcohols(isobutanol,isoamyl alcohol,phenylethanol,n-propanol,n-butanol,hexanol)were established for their detection in turbid rice wine using the colorimetric method of microplate reader.The contents of higher alcohols in turbid rice wine were examined and com-pared between the colorimetric method of microplate reader and gas chromatography method.The results showed that lin-earity of mixed standard curves was reliable in the range of0-0.05mg,and the linearity of a single standard curve of n-propanol was worse in the range of0-1mg,whereas the linearity of phenylethanol and n-butanol was not good in the range of0-0.05mg.The content of n-propanol,phenylethanol,and n-butanol would affect the detection of other high-er alcohols to a certain extent.The mass concentration of six higher alcohols in rice wine fermented by FBKL2.8022and FBKL2.8023was examined to be408.94and230.89mg/L,respectively.The standard deviation range was0.06%-3.94%in the rice wine fermented by FBKL2.8022,and0.72%-1.58%in the rice wine fermented by FBKL2.8023. The content of higher alcohols examined by the colorimetric method of microplate reader was generally higher than the gas chromatography method.Different ratios of higher alcohols would affect the linear equation and correlation coefficient of standard curve established in the detection of higher alcohols in turbid rice wine using colorimetric method of microplate reader.When analyzing sample,it is necessary to select the standard curve with appropriate ratios of different higher al-cohols base on the sample detection requirements.Key words㊀rice wine;higher alcohols;fermentation;glutinous rice;gas chromatography;isobutanol;isoamylo。
分光光度法测定苹果酒中的高级醇
甄会英;王颉;李长文;张伟;袁丽
【期刊名称】《酿酒科技》
【年(卷),期】2005(000)005
【摘要】利用分光光度法测定苹果酒中的高级醇,检测波长477 nm,以标准曲线法定量,测得相对标准偏差为2.0313,回收率为103.632%,具有操作简便、快捷、精密度好、准确度高的特点.
【总页数】3页(P104-106)
【作者】甄会英;王颉;李长文;张伟;袁丽
【作者单位】河北农业大学食品科技学院,河北,保定,071001;河北农业大学食品科技学院,河北,保定,071001;河北农业大学食品科技学院,河北,保定,071001;河北农业大学食品科技学院,河北,保定,071001;河北农业大学食品科技学院,河北,保
定,071001
【正文语种】中文
【中图分类】TS262.7;O657.3
【相关文献】
1.分光光度法测定高级醇 [J], 王德昌;明明;周维广
2.苹果酒高级醇生成控制的研究 [J], 于涛;杨婷婷;杨林;王燕
3.分光光度法测定黄酒中的高级醇 [J], 杜威;林玲;张兴亚;蒋予箭
4.酿酒酵母中BAT2基因敲除对桑葚酒中高级醇的影响 [J], 徐佳;黄雪芹;杨建飞;
易媛;马倩;胡琨;左勇
5.高产酯低产高级醇酿酒酵母在丢糟酒中的应用 [J], 韩雨辰;刘小敏;肖冬光
因版权原因,仅展示原文概要,查看原文内容请购买。