药物化学喹诺酮类抗菌药
- 格式:ppt
- 大小:915.00 KB
- 文档页数:32
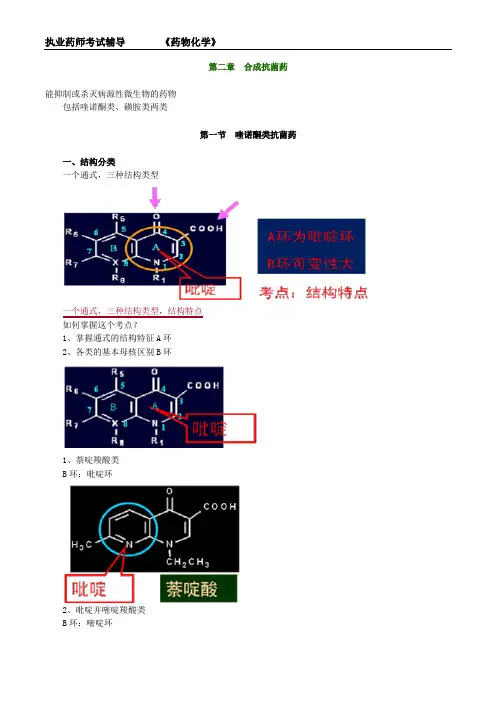
第二章合成抗菌药能抑制或杀灭病源性微生物的药物包括喹诺酮类、磺胺类两类第一节喹诺酮类抗菌药一、结构分类一个通式,三种结构类型一个通式,三种结构类型,结构特点如何掌握这个考点?1、掌握通式的结构特征A环2、各类的基本母核区别B环1、萘啶羧酸类B环:吡啶环2、吡啶并嘧啶羧酸类B环:嘧啶环3、喹啉羧酸类二、理化性质和毒性喹诺酮药物共同性质如何掌握这个考点?1、掌握各类药物化学结构通式的特点2、结构的基本母核以及有什么取代基3、这些结构特征决定了药物的基本理化性质(通性)4、这些结构特征对药物的稳定性、使用过程有什么影响以诺氟沙星为例(1)3位羧基酸性,可溶于碱(成盐)(2)4位酮基(3)7位哌嗪碱性,可溶于酸(成盐)诺氟沙星(1)酸碱两性(羧基,哌嗪)在酸碱中均溶解(2)3位羧基和4位酮基易和金属离子(钙、镁、铁、锌)等形成螯合物,降低活性,同时也使体内的金属离子流失,尤其对妇女、老人和儿童引起缺钙、贫血、缺锌等副作用。
理化性质和毒性(其他类似物举一反三)(3)光照分解(产生光毒性,用药期间避免日晒);光照3位脱羧(产物无活性)(4)7位哌嗪杂环分解,7位哌嗪增加中枢毒性(5)8位有F,有光毒性三、喹诺酮药物代谢特点:代谢是考点(补充知识)药物代谢:在酶的作用下,将药物转变成极性分子,再排出体外的过程,称为代谢。
药物代谢的主要反应有:氧化、还原、水解、结合等1、3位羧基与葡萄糖醛酸结合反应2、哌嗪3’位氧化成羟基,进一步氧化成酮四、喹诺酮药物代表药如何掌握这个考点?1、共5个代表药2、掌握诺氟沙星(代表该类药物共同的特点)3、取代基的区别4、各自的特殊性1、盐酸诺氟沙星2、盐酸环丙沙星3、左氧氟沙星特点:活性好水溶性好毒副作用最小补充手性药物的基本知识:药物分子的手性和手性药物凡是连有4个不同的原子或基团的碳原子称为手性碳原子,具手性原子的称手性药物当药物分子结构中引入手性中心后,得到一对互为实物与镜象的对映异构体(R构型、S构型)n个手性碳有2n个异构体键表示取代基在背面键表示取代基在前方手性碳药物的四个基本概念:.1、构型:R、S(氨基酸、糖等习惯用D、L)2、旋光性:(+)右旋、(-)左旋、(±)消旋手性药物都具有旋光性:偏振光的振动面习惯称为偏振面。

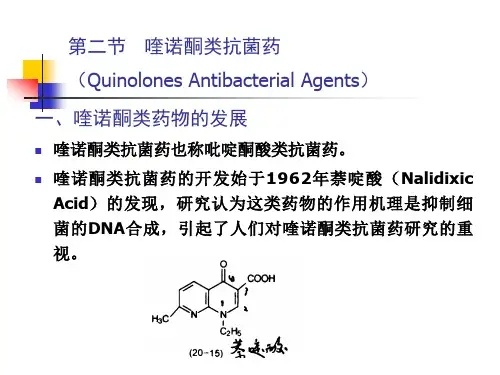





正确认识喹诺酮类抗菌药物一、历史回顾喹诺酮类属化学合成的抗菌药物,自从1960年合成第一代喹诺酮类药物萘酸后,于1973年合成了第二代喹诺酮药吡哌酸等,1978年合成了第三代喹诺酮药物。
第三代喹诺酮类药物的共同特点是在化学结构7位上连续哌嗪环,6位处又引入了氟原子,从而大大提高了菌活性,增宽了抗菌谱,疗效显著,同时副作用也小,因第三代喹诺酮类药物结构中均有氟原子,故又称氟喹诺酮类(fluoroquinolones)。
也有人根据喹诺酮类药物的抗菌作用、副作用等将其分为四个阶段:第一阶段是指1962-1969年上市的萘啶酸和吡咯酸,它们对大多数兰氏阴性菌有活性,但对革兰氏阳性菌和绿脓杆菌无活性。
此药口服吸收良好,在体内被代谢和灭活,24小时尿中回收率为50%-90%;而原药和活性代谢物仅占给药量的10%左右。
尽管如此,由于在泌尿道、胆道和肠道中浓度较高,可以治疗这些系统感染。
第二阶段在1970-1977年以吡哌酸和西诺沙星主代表,此类对革兰氏阴性菌有活性,在抗菌谱方面,与第一阶段药物相比,对绿脓杆菌有一定作用,对萘啶酸和吡咯酸有高度耐药的菌株也有活性。
此类药物体内代谢稳定,有尿中24小时回收率近90%,其中原药含量>50%,且组织渗透性好,除治疗泌尿道、胆道和肠道感染外,还用于耳、鼻等部位的感染。
第三阶段在1978-1964年,代表药有诺氟沙星、氧氟沙星、环西沙星、诺美沙星等;抗菌谱扩大为G+菌、G-菌和葡萄糖非酵解菌。
此类药具有良好的组织渗透性,除脑组织和脑脊液外,对各种组织均有良好的分布,所以不仅有广泛的抗菌谱,而且有广泛的适应症。
第四阶段指1986年以后所上市的一些喹诺酮类药物,与前几类相比,他们有抗菌谱方面,有些药对葡萄球菌、肺炎球菌、脆弱类杆菌、支原体、衣原体、军团菌等都有很好的作用;有些药对结核分枝杆菌的活性是第三阶段喹诺酮的3-30倍,与异烟腓和利福平相当。
此类药物由于吸收迅速,分布良好,血药浓度大,半衰期长,生物利用度高,所以临床可应用于泌尿感染、呼吸道感染、消化道感染、皮肤和软组织感染、眼、耳、鼻、喉科、口腔科等感染。



喹诺酮类药物结构特点与特性、作用机制、特点、分类和抗菌谱喹诺酮类药物是化学合成抗菌药,该类药物化学结构、作用机制均不同于其他抗菌药,且具有抗菌谱广、对革兰阴性菌抑制作用强于革兰阳性菌特点,是治疗各种感染性疾病高效且安全一类药物。
喹诺酮类结构特点与特性喹诺酮类是以4-喹诺酮为基本结构的合成类抗菌药,在4-喹诺酮母核N1位、C5位、C6位、C7位、C8位引入不同基团,形成各具特点喹诺酮类药物。
1.抗菌活性C6位引入氟原子同时,C7位引入哌嗪基后,药物与DNA回旋酶亲和力和抗菌活性显著提高,抗菌谱明显扩大,药动学性质显著改善。
N1位引入环丙基后,环丙沙星、司帕沙星、莫西沙星、加替沙星和加雷沙星等药物对革兰阳性菌、衣原体、支原体杀灭作用进一步增强,C6位脱去氟原子且C8位引入二氟甲基的加雷沙星对革兰阴性菌、革兰阳性菌、厌氧菌、支原体、衣原体均具有与莫西沙星类似的良好活性和药动学特征,毒性更低,诞生C6非氟氟喹诺酮类药物。
2.脂溶性C7位引入甲基哌嗪环,可增加氧氟沙星、氟罗沙星和左氧氟沙星药物脂溶性,提高口服生物利用度和对细菌的穿透力。
C8位引入氯原子或氟原子,进一步提高药物口服生物利用度,延长药物消除半衰期,提高药物脂溶性具有扩大抗菌谱和增强抗菌活性效果。
3.光敏反应C8位引入氯原子或氟原子后,在提高疗效同时,增强药物光敏反应,药物包括司帕沙星、氟罗沙星和洛美沙星。
以甲氧基取代C8位氯原子或氟原子时,在提高疗效同时还可降低光敏反应,药物包括莫西沙星和加替沙星。
4.中枢神经系统毒性C7位哌嗪环取代基团与γ-氨基丁酸受体拮抗剂结构相似,可拮抗GABA受体产生中枢神经系统症状。
喹诺酮类药物与茶碱或非甾体类抗炎药合用时易产生中枢毒性。
C6位有疏水性的氟原子使喹诺酮类药物具有一定脂溶性,易于透过血脑屏障。
去掉C6位氟原子的加雷沙星与NSAID合用不诱发惊厥反应,不影响GABA与γ-氨基丁酸A型受体结合,中枢神经系统毒性显著减低。
奎喏酮类抗生素
简介
奎喏酮类抗生素是一种广谱抗菌药物,常用于治疗革兰氏阳性菌和革兰氏阴性菌感染。
其药理机制为干扰细菌细胞壁的合成和代谢,从而导致细菌死亡。
奎喏酮类抗生素主要包括氯霉素、四环素、青霉素等。
氯霉素
氯霉素是一种广谱的抗生素,常用于治疗革兰氏阳性菌和革兰氏阴性菌感染。
其药理机制为干扰细菌蛋白质的合成,从而导致细菌死亡。
氯霉素有很多副作用,包括造成贫血、肝功能损害、肾功能损害等。
因此,在使用氯霉素时需要谨慎,并遵循医生建议。
四环素
四环素是一种广谱的抗生素,常用于治疗革兰氏阳性菌和革兰氏阴性菌感染。
其药理机制为干扰细菌蛋白质的合成,从而导致细菌死亡。
四环素有一些副作用,包括光敏感性、肝功能损害、肾功能损害等。
因此,在使用四环素时需要谨慎,并遵循医生建议。
青霉素
青霉素是一种广谱的抗生素,常用于治疗革兰氏阳性菌和革兰氏阴性菌感染。
其药理机制为破坏细菌细胞壁的合成和代谢,从而导致细菌死亡。
青霉素通常被认为是一种较为安全的抗生素,但在一些人身上可能会出现过敏反应。
奎喏酮类抗生素是一类常用于治疗细菌感染的药物,其中包括氯霉素、四环素和青霉素等。
在使用时需要谨慎,遵循医生的建议,并注意副作用和过敏反应。