人教版初三化学下册实验方案设计与实验报告专题学案
- 格式:docx
- 大小:25.06 KB
- 文档页数:7

《化学实验设计》教学设计广州市越秀区育才实验学校李君蕾教学地位分析:《广州市2010年初中毕业生学业考试化学考试大纲》提出了“能用规范的学科语言描述实验现象,对实验现象进行合理的解释”、“具有初步的条件控制意识,能进行简单的实验方案设计”、“了解物质的分类的思想和方法”等化学学科思想和研究方法的考试要求。
再结合近三年的《广州市初中毕业生学业考试年报》上传递的精神:近三年都出现了实验方案设计题目,通过鉴别一些常见的物质,综合地考查了常见物质(离子)的检验、物质分类的思想和开放性思维能力,又考查了学生包括制定计划、解释与结论以及书面表达等科学探究要素在内的科学探究能力。
因此有必要在常规教学中渗透训练和复习阶段进行系统地综合训练,让学生的学科素养得到升华。
教学目标一.知识与技能1、了解实验设计主要包括实验原理、实验操作步骤的设计;2、能熟练运用化学反应原理进行化学实验方案的设计,并能用准确规范的语言书写实验报告。
3、能针对一个化学问题所设计的多种实验方案,进行优劣可行性的判断,或在多个实验方案中选择符合实际的合理方案,同时对自己的判断做出合理解释。
二.过程与方法1、先让学生尝试解决一道设计化学实验方案的题目,并进行讨论、评价;2、与学生共同寻找实验方案设计的具体内容、注意要点、解题策略以及实验原理设计上体现的分类、思维有序性等学科思想方法;3、在熟练掌握化学实验的基本操作及实验基本原理的基础上,进行简单实验的设计,并多方面考虑合理性、评价优劣可行性。
三.情感态度与价值观1、发展学生善于动脑、敢于置疑的科学精神,培养求知欲和探究激情。
2、通过对问题讨论、探究和分析,培养学生严谨、实事求是的科学态度。
3、使学生在实验探究、讨论中学会与别人交流,增强协作精神。
4、通过对一些简单探究实验的设计,增强学生学习的创新意识。
重点和难点:1、学会设计简单的化学实验方案;2、对实验方案进行合理评价;3、正确用科学语言表述实验原理、实验操作、现象和结论,分析实验是否合理、可行。

人教版初中九年级下册化学教案设计三篇导读:本文人教版初中九年级下册化学教案设计三篇,仅供参考,如果觉得很不错,欢迎点评和分享。
《常见的酸和碱》教学目标【教学目标】1.知识与技能(1)了解常见酸碱指示剂及其变色情况。
(2)了解几种常见的酸及酸的通性。
(3)认识浓硫酸的腐蚀性。
2.过程与方法(1)进一步认识和体验科学探究的过程。
(2)运用实验的方法获取信息,运用比较概括的方法对获取的信息进行加工。
3情感态度与价值观增强对化学现象的探究欲,培养善于合作、勤于思考的科学精神。
教学重难点【教学重点】1.运用酸碱指示剂检验溶液的酸碱性。
2.浓硫酸的腐蚀性。
3.酸的化学性质。
【教学难点】1.酸碱指示剂的变色情况。
2.酸的化学性质。
教学工具【教具准备】白醋、苹果汁、石灰水、盐酸、氢氧化钠溶液、酚酞溶液、石蕊溶液、试管(若干)、牵牛花、万寿菊、蝴蝶兰花、玫瑰、月季、紫甘蓝、硫酸、玻璃棒等。
教学过程【导入新课】在日常生活中,你听说过、接触过酸和碱吗?【交流回答】接触过的酸有:碳酸、醋酸、盐酸、硫酸;碱有:氨水、石灰水、烧碱。
【提出问题】用什么较简单的方法区分酸和碱呢?【展示交流】请同学们做教材P50实验10-1,交流实验结果。
【阅读记忆】请同学们阅读并理解教材P51内容,归纳什么叫指示剂?指示剂遇酸和碱溶液变色有什么规律?【阅读回答】石蕊试液遇酸溶液变红,遇碱溶液变蓝;酚酞溶液遇酸溶液不变色,遇碱溶液变红。
【提出问题】请同学讨论白醋、石灰水、盐酸、氢氧化钠溶液这4种物质中,哪些可能是酸溶液,哪些可能是碱溶液。
【交流回答】白醋,盐酸是酸溶液;石灰水,氢氧化钠是碱溶液。
【归纳总结】检验溶液酸碱性的方法:取少量溶液,滴入几滴石蕊试液,若溶液呈红色,则说明该溶液为酸性溶液,若溶液呈蓝色,则说明该溶液为碱性溶液。
【过渡】酸碱指示剂的种类很多,不只是石蕊试液和酚酞试液。
在日常生活中指示剂随处可见,同学们可通过后面的活动体验一下。

实验活动7 溶液酸碱性的检验实验目的:1.初步学会用酸碱指示剂检验溶液的酸碱性。
2.初步学会用PH试纸测定溶液的酸碱度。
3.初步学会自制酸碱指示剂,并用制得的指示剂检验溶液的酸碱性。
4.通过探究活动的分工、配合,增强学生的协作意识、合作能力。
5.通过对检测溶液酸碱性的意义分析,提高学生的环保意识。
实验重点:用PH试纸测定溶液的酸碱度实验难点:自制酸碱指示剂能检验溶液的酸碱性的原因实验用品:预案:实验准备酒精灯、铁架台(带铁圈)、石棉网、剪刀、注射器、漏斗、烧杯、试管、研钵、玻璃棒、玻璃片、纱布、胶头滴管、塑料袋······1.2.PH撕一小片PH试纸,放在洁净的_________,用_________蘸取待测液________到PH试纸上,______分钟内与标准比色卡比较(注:两者不能相碰),读出溶液的PH.3.你准备选取哪些植物制作酸碱指示剂?_____、_______。
理由支持:______________________________。
4.你了解自制酸碱指示剂的一般方法和步骤吗?(1)在研钵里__________;(2)加入3—5ml__________浸泡;(3)用纱布将浸泡出的汁液__________或________;(4)你还有别的妙法自制酸碱指示剂吗?______________________________________________________________________________________;你认为比较完美的指示剂应具备什么样的特点?____________________________________________________。
5.检测溶液的酸碱性具有实际意义吗?(1).________________________;(2).________________________________;(3).____________________________________;(4).······二、实验步骤1.自己选择植物的花瓣或果实,在研钵中捣烂,加入酒精浸泡; 用纱布将浸泡出的汁液过滤或挤出。
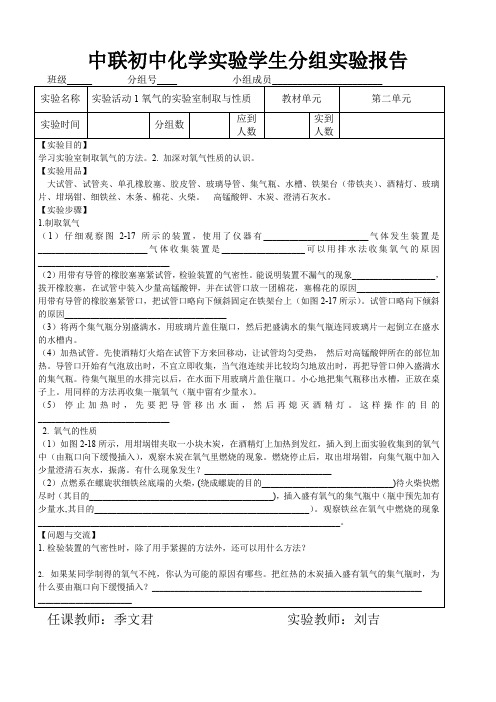

学生实验报告单学科:化学九年级班小组记录人员1、比较几种金属活动性大小。
实验名称金属活动次序研究实验目的2、理解置换反响观点。
药品仪器试管、稀盐酸、镁带、锌粒、铁屑、铜丝、稀硫酸。
1、分别在4支试管中装入5ml稀盐酸,编号为1、2、3、4。
实验步骤 2、分别投入少量的镁带、锌粒、铁屑、铜丝,察看现象。
3、用稀硫酸取代稀盐酸重作以上实验。
现象稀盐酸稀硫酸镁带产生大批气泡产生大批气泡实验现象锌粒产生大批气泡产生大批气泡铁屑产生气泡产生气泡铜丝无气泡无气泡1、Mg+2HCl=MgCl+H2↑,Fe+2HCl=FeCl=FeCl+H2↑Zn+2HCl=ZnCl+H2↑,四种金属活动性次序为剖析结论>>>。
2、如以上反响,由一种单质和一种化合物生成另一种单质和另一种化合物的反响,叫置换反响。
学生实验报告单学科:化学九年级班小组记录人员实验名称金属活动次序研究实验目的学习比较金属活动性的方法药品仪器试管、铝丝、硫酸铜溶液、铜丝、硝酸银溶液、硫酸铝溶液1、把一根铝丝浸入硫酸铜溶液中,过一会拿出,察看现象。
2、把两根铜丝分别浸入硝酸银和硝酸铝溶液中,过一会拿出,实验步骤察看现象。
1、蓝色溶液变浅,铝丝上有色固体。
2、伸入硝酸银溶液溶中的铜丝出现有色固体,硝酸铝实验现象溶液中无明展现象。
、Ag、Cu三种金属的活动性:>>2.在金属活动性次序里,位于前方的金属能把后边的金属从它们剖析结论化合物的溶液里置换出来。
学生实验报告单学科:化学九年级班小组记录人员金属的物理性质和某1、稳固和加深对金属性质的实验名称实验目的些化学性质认识。
2、培育实验设计能力。
试管、试管夹、酒精灯、坩埚钳、电池、导线、小灯泡、火柴、药品仪器镁条、锌粒、铝片、铁片、铁粉、铜片、黄铜片、稀盐酸、稀硫酸、硫酸铜溶液、硝酸银溶液1、金属的物理性质(1)察看并描绘镁、铝、铁、铜的颜色和光彩。
(2)采纳互相刻画的方法,比较铜片和铝片、铜片和黄铜片的硬度。
实验方案设计与实验报告(第二课时) 班级: _____________________ 专题姓名: _________________________ 【课前练习】1.简述如何检验 NaCI 溶液中有N Q CQ【解题笔记】 2.某同学发现,上个月做实验的氢氧化钾溶液忘记盖瓶盖了,对于 该溶液是否变质,是否完全变质,同学提出了如下猜想: 【思考】该同学认为溶液变质的原因是,用化学方程式说明: 【猜想与假设】猜想一: KOH 猜想二:KOH K 2CC 3 猜想三: ______________________ 【实验验证】验证猜想二正确(已知:K 2CC 3的化学性质与 Na 2CC 3相似) 试剂:稀盐酸、酚酞溶液、澄清石灰水、 MgCl 2溶液、CaC 2溶液3.设计实验方案,探究该地区酸雨是否存在硫酸和盐酸,填写下 表.(已知硫酸银微溶于水.) 限选试剂:NaOH 溶液、BaCl 2溶液、Ba ( NO ) 2溶液、AgNO 溶液 清液于试管中,【解题思路】1•判断是纯净物还是混合物检验: ___________________2. 确定检验的混合物成分(离子): _________________ 目标离子: ___________________3. 目标离子的检验方法判断是否有干扰离子存在4.若有干扰,考虑如何除去干扰离子。
4.皮蛋是我国传统的蛋制品,深受人们喜爱,由少量NaCI、CaQ和过量的N Q CO混合得到的粉末状混合物A是制皮蛋的配方之一。
(1 )某化学兴趣小组从市场获取少量的混合物于烧杯中,缓慢加入足量的蒸馏水,边加边搅拌,静置,过滤得滤液。
①该过程发生的方程式 ___________________________________________ 、 ________________________________________②滤液中含有Cl-、QH,还含有的阴离子是_____________________ ;(2 )在混合物中加入少量的ZnSQ可改善皮蛋品质,该兴趣小组获得某样品,探究混合物中是否添加了少量的ZnSO;设计实验方案,完成下述表格。
限选用品与试剂:稀、试纸、2溶液、蒸馏水、溶液5•硬水中因溶有较多的可溶性钙、镁化合物,给我们的生活、生产带来许多麻烦。
小明想知道家里的自来水是否还有钙、镁离子,请你帮他设计一个实验。
限制用品与试剂:Q溶液、2溶液、溶液1. 某实验小组的同学想用碳酸钠溶液与饱和石灰水反应来制取少量氢氧化钠.(1 )该复分解反应能发生的理由是_______________________ .(2)有人提出:实验时没有注意药品的用量,所得到的氢氧化钠溶液可能不纯.猜想一:只含NaOH猜想二:含有NaOH和Na2CO3猜想三:__________________(3)为了验证猜想一成立,请你根据可选用的试剂,完成实验设计方案并填写以下表格. 可选试剂:2. 某同学家中有一袋化肥,可能混入了其他化肥,且化肥包装袋上字迹模糊。
该同学进行了如下探究,请你参与探究并填空:[提出问题]该化肥中含有什么物质?[收集信息]经询问得知,该化肥可能为铵态氮肥。
[提出猜想]该化肥所含的阴离子可能是Cl-、CO2-、SQ2-中的一种或几种。
[实验、记录与分析]实验结论若该化肥中只含有一种阳离子,则其中一定含有的物质是(写化学式)[实验反思]若步骤(2)中用氯化钡溶液代替硝酸钡溶液 __________________________ (选填“是”或“否”) 可行, 请简要说明原因:3. 如图是模拟海水制盐的流程(1) ________________________________ 操作a 的名称是 _________________________ ,所需要的玻璃仪器有 (只写其中一种玻璃仪器)(2) 为了证明第①步所加的 Ca ( OH )2溶液已过量,某同学取少量①反应后的上层清液,向其中 继续加入Ca(OH )2溶液,若_ __ _ (填实验现象),则证明Ca (OH )2溶液已过量.(3) 实验结束后,兴趣小组对滤液进行探究【提出问题】滤液中除了含有水和氯化钠外,还含有哪些溶质? 【提出猜想】根据实验①②③的操作后,作出如下猜想猜想一:由于在②中加入了过量 Na 2CO 3溶液,所以滤液中除了含有水和 NaCI 夕卜,还含过量的 _ 猜想二:由于在①加入了过量的氢氧化钙,发生反应生成了氢氧化镁和氯化钙,所以滤液中除了含 有水和氯化钠外,只含有反应生成的氯化钙. 猜想三:由于②所加的过量碳酸钠在①之后,所加的碳酸钠把①中反应生成的氯化钙和过量的氢氧 化钙全部除去,所以滤液中除了含有水和氯化钠外,还含有 __ 和 _ _【反思与拓展】为了使制得的精盐水只含有水和氯化钠,步骤④的作用是除去杂质, 请写出其中一个反应的化学方程式: __一如果要将精盐水继续提纯成NaCI 晶体,应进行 ________________________________ 操作.橙養水 船入試豪的foCiCh) ®加入过it 的捷作③McCOHhftA r*^OCOjiCK_ *A«t ___ -r 丽n 第曦■丽刃参考答案: 【课前练习】1. 【考点】实验探究物质的组成成分以及含量;溶液的酸碱度测定;酸的化学性质.【分析】根据题目给出的信息可知:要探究该地区酸雨是否存在硫酸和盐酸,硫酸根离子一般用钡 离子检验,为了避免对氯离子的鉴定产生干扰,应该选用硝酸钡溶液;氯离子一般用银离子检验, 因为硫酸银微溶于水,因此要先鉴定硫酸根离子,再检验氯离子. 【解答】 实验步骤预期现象和结论步骤1 :适量酸雨于试管中, 滴加过量的Ba ( NO 3) 2溶液 步骤2:取适量步骤1中的上层清液于试管中,滴 加AgNO 3溶液【点评】 有关实验方案的设计和对实验方案的评价是中考的热点之一,设计实验方案时,要注意用 最少的药品和最简单的方法;关于对实验设计方案的评价,要在两个方面考虑,一是方案是否可行, 能否达到实验目的;二是设计的方法进行比较,那种方法更简便.【课堂练习】2.(1)① CaO+H 2O=Ca(OH )2 Ca(OH )2 +Na 2CO 3=CaCO 3 妊2NaOH②CO 32—(2)【解析】 试题分析:(1)混合物 A 滚于水后,先 CaCKH z O=Cai OH):,后 Car OH): *Na 2COx=CaCO 3l-2NaOH J 由 于C10少崑血!C©过量,故反应后Na :CO :剩余,滤液中有NaOH . N 逊CO. NaCl, 滤液中含有的阴离子有C1- .0H- . COr- 0步骤1所得的濬液中含有CT 、OH- . COF ,在检验是否有SO?' , CO3-的存在会干扰, 所以先扣入圧量的稀盐酸排除COr 的干扰,然后再扣入BaCl.濬浓检验°3.1【思考】2KOH+CO=K 2CQ+H 20 【猜想与假设】K 2CO 3有白色沉淀生成,说明有硫酸有白色沉淀生成,说明有盐酸2. 【答案】(1)有刺激性气味;(2)CO2-;(3)有白色沉淀生成;【实验结论】(写化学式):(NH)2SQ、NHCI。
【实验反思】否因为若用氯化钡溶液溶液代替硝酸钡溶液,会对判断该化肥是否所含CI-造成干扰【解析】试题分析:根据实验结论可知(1)取少量该化肥样品和少量熟石灰放在研钵混合研磨,产生有刺激性气味的气体,;(2 )另取少量该化肥样品于试管中,加入适量的水完全溶解,滴加足量的硝酸钡溶液,再滴加少量稀硝酸,过滤。
产生白色沉淀,沉淀不溶解,说明没有碳酸根离子存在;(3)取(2)所得滤液少量于试管中,滴加AgNQ溶液。
有白色沉淀生成,说明有氯离子;【实验结论】若该化肥中只含有一种阳离子,则其中一定含有的物质是(NH)2SQ、NH4CI ;【实验反思】若步骤(2 )中用氯化钡溶液代替硝酸钡溶液是不可行的,因为用氯化钡溶液溶液代替硝酸钡溶液,会对判断该化肥是否所含CI-造成干扰考点:物质成分探究3. 【答案】(1)有沉淀生成,符合复分解反应的条件. (2)Na2C03和Ca (OH)2;(3)过量的稀盐酸;滴入碳酸钠溶液;没有沉淀生成,证明原溶液中不含有氢氧化钙【解析】试题分析:(1)复分解反应发生的条件是生成物中有气体、沉淀或水生成。
而碳酸钠和氢氧化钙反应生成了碳酸钙沉淀和氢氧化钠,符合复分解反应发生的条件;(2)碳釀钠和氢氧化钙发生反应生成了碳釀钙沉淀和氢氧化钠'当碳酸钠和氢氧化钙恰好反应时,溶液中只含有含NaOHj当碳酸钠过量时,濬液中NaOH和NazCOj、当氢氧化钙过量是时』濬濟中含有NaOH 和Cd (OH)所以猜想三是:NNaOH和Ca (OH) 2;⑶要证明猜想一正确,那么即宴证明濬液中不合碳酸钠或氢氧化钙。
可根据它们的性质进行检验,由于碳酸^能与盐酸反应生成了二氧化碳气体,能与氢氧化钙反应生成碳酸钙沉淀,故可分别加入稀盐酸和碳釀钠,若即没有气泡产生,也没有沉淀生成,则证明溶液中既不含碳酸钠,也不含氢氧化钙,那么只含有氢氧化钠。
考点:物质的检验,实验探究4.【答案】(1)过痣;漏斗(或玻璃棒或烧杯)(2)无白色沉淀产生【提出猜想】猜想一’碳酸钠;猜想三:氢氧化钠主碳讓钠【验证猜想】【反思与拓展】XaOH-Ha=NaCl-H:O或N抚CO厂::HCN2W亠H:X6T;蒸发结晶【解析】试题分析:(1)过滤操作可以将固体和碾体进行分禽,经过坤:岸二洽,得到了祖盐和母義,所以操作2展、过瀛过滤需要的玻璃仪器有烧杯、帰斗、璃%「⑴氢氧化钙的作用是除去氯化镁生戚氢缰化镁沉淑若所加的Ca(OH)寸關已过壘,二周学取少重①反应后的上层清海向其中越加入Ca(OH) :颐无白芭沉淀产生;⑶【提山病想】猜S-:由于左②中加入了过重的碳酸钠沼潢,所嬉複还仅含过歳的磯聯乩猜想三由于②斫加的过量碳酸fflSCD之后,所加的碳酸钠把①中反应生成的氨化钙和过童的氢氧化钙全襯除去,所以痣破中除了舍有水和氟优钠外,还含育反应生廉的氢軍化的;和磯瞻内【验证猜想】取少重滤酿于试管中,加入过重的更化钙沼酿,振苏静直如臬有白色沉淀生咸,说明滿液中还有碳酚内’取步骤1反应后的混合液过涛后,取滤液少量于试管中加入无色酚猷试液,如果溶菠变红色,说明痣襪中还含有氢氧化朗.【反患与拓展】盐讓会与氢氧化钠和碳鵲衲反应, 方程式为NaOH-HCl=NaCl-H;O和Na:CO^2Ha=2NaCl^H:CH:O;T?可通过蒸发结晶纯咸XaC:晶体.。