第七章 多环芳烃
- 格式:doc
- 大小:120.00 KB
- 文档页数:6





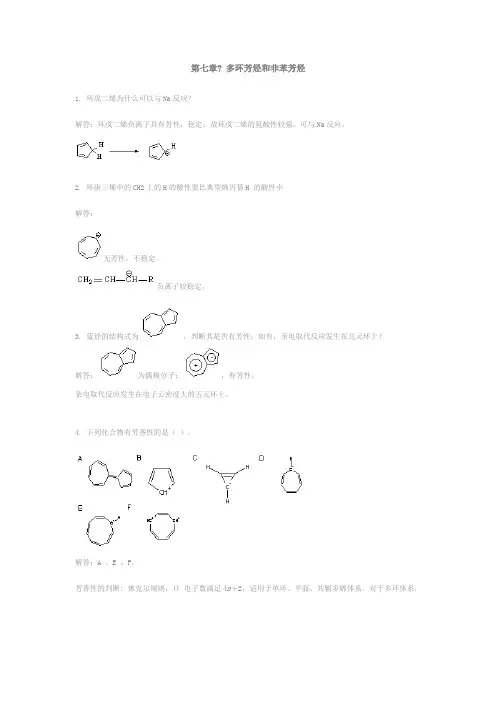
第七章? 多环芳烃和非苯芳烃
1. 环戊二烯为什么可以与Na反应?
解答:环戊二烯负离子具有芳性,稳定;故环戊二烯的氢酸性较强,可与Na反应。
2. 环庚三烯中的CH2上的H的酸性要比典型烯丙基H 的酸性小
解答:
无芳性,不稳定。
负离子较稳定。
3. 蓝烃的结构式为,判断其是否有芳性;如有,亲电取代反应发生在几元环上?
解答:为偶极分子:,有芳性。
亲电取代反应发生在电子云密度大的五元环上。
4. 下列化合物有芳香性的是()。
解答:A 、E 、F。
芳香性的判断: 休克尔规则,Π电子数满足4n+2,适用于单环、平面、共轭多烯体系。
对于多环体系,
处理如下:
5. 分子式为C8H14的A,能被高锰酸钾氧化,并能使溴的四氯化碳溶液褪色,但在汞盐催化
下不与稀硫酸作用。
A经臭氧化,再还原水解只得到一种分子式为C8H14O2的不带支链的
开链化合物。
推测A的结构,并用反应式加简要说明表示推断过程。
解答:
即环辛烯及环烯双键碳上含非支链取代基的分子式为C8H14O2的各种异构体,例如以上各种异构体。



第七章 多环芳烃1、 联苯及其衍生物2、 稠环芳烃:萘、蒽、菲及其衍生物的结构和化学性质1、 芳香体系与休克尔规则基本要求:1.熟练掌握稠环芳烃萘蒽等衍生物的命名。
2.熟练掌握萘的化学性质及萘环上亲电取代产物的定位规律。
3.掌握H ückel 规则,理解芳香性的概念,能应用H ückel 规则判断环状化合物的芳香性。
分子中含有多个苯环的烃称作多环芳烃。
多环芳烃可分如下三种:联苯和联多苯类:这类多环芳烃分子中有两个或两个以上的苯环直接以单键相联结。
稠环芳烃:这类多环芳烃分子中有两个或两个以上的苯环以共用两个碳原子的方式相互稠合。
多苯代脂肪类:这类多环芳烃可看作是脂肪烃中两个或两个以上的氢原子被苯基取代。
7.1联苯及其衍生物联苯是两个苯环通过单键直接连接起来的二环芳烃。
其结构为:联苯为无色晶体,熔点70℃,沸点254℃。
不溶于水而溶于有机溶剂。
因其沸点高和具有很好的热稳定性,所以工业上常用它作热传导介质(热载体)。
联苯的化学性质与苯相似,在两个苯环上均可发生磺化、硝化等取代反应。
联苯环上碳原子的位置采用下列所示的编号来表示:联苯可看作是苯的一个氢原子被苯基取代,而苯基是邻对位定位基,所以,当联苯发生取代反应时,取代基进入苯的对邻位和对位。
但由于邻位上的空间位阻较大,主要生成对位产物。
7.2稠环芳烃有多个苯环共用两个或多个碳原子稠合而成的芳烃称为稠环芳烃。
简单的稠环芳烃如萘、蒽、菲等。
稠环芳烃最重要的是萘。
7.2.1萘(naphthalene)萘的结构:平面结构,所有的碳原子都是sp 2杂化的,是大π键体系。
分子中十个碳原子不是等同的,为了区别,对其编号如下: 萘的一元取代物只有两种,二元取代物两取代基相同时有10种,不同时有14种。
萘的物理性质:萘是白色晶体,熔点80.5℃,沸点218℃,有特殊气味,易升华,不溶于水,易溶于热的气醇及乙醚,常用作防柱剂。
萘在染料合成中应用很广,大部分用于制造邻苯二甲酸酐。
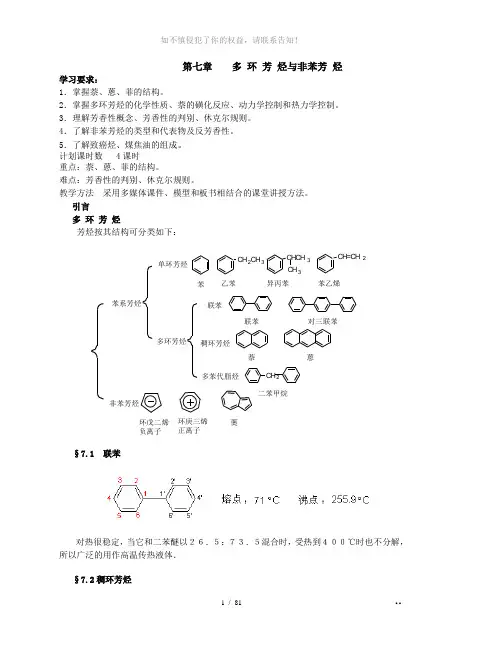
第七章 多 环 芳 烃与非苯芳 烃学习要求:1.掌握萘、蒽、菲的结构。
2.掌握多环芳烃的化学性质、萘的磺化反应、动力学控制和热力学控制。
3.理解芳香性概念、芳香性的判别、休克尔规则。
4.了解非苯芳烃的类型和代表物及反芳香性。
5.了解致癌烃、煤焦油的组成。
计划课时数 4课时重点:萘、蒽、菲的结构。
难点:芳香性的判别、休克尔规则。
教学方法 采用多媒体课件、模型和板书相结合的课堂讲授方法。
引言多 环 芳 烃芳烃按其结构可分类如下:§7.1 联苯对热很稳定,当它和二苯醚以26.5:73.5混合时,受热到400℃时也不分解,所以广泛的用作高温传热液体. §7.2稠环芳烃2CH 3CHCH 32CH 3CH 2苯系芳烃非苯芳烃单环芳烃多环芳烃联苯稠环芳烃多苯代脂烃苯乙苯异丙苯苯乙烯联苯对三联苯萘 蒽二苯甲烷环戊二烯负离子环庚三烯正离子薁7.2.1萘(一)萘的结构平面结构,所有的碳原子都是sp 2杂化的,是大π键体系。
分子中十个碳原子不是等同的,为了区别,对其编号如下:萘的一元取代物只有两种,二元取代物两取代基相同时有10种,不同时有14种。
(二)萘的反应和用途 1. 加成反应萘比苯易加成,在不同的条件下,可发生部分或全部加氢。
2. 氧化反应 萘比苯易氧化3. 取代反应(1)消化 萘与混酸在常温下就可以反应,产物几乎全是α-硝基萘。
存在于煤焦油中,白色闪光状晶体,熔点80.6,℃,沸点218有特殊气味,能挥发并易升华,不溶于水。
萘是重要的化工原料.。
也常用作防蛀剂(如卫生球)0.142nm说明萘环中各碳原子的P 轨道重叠的程度不完全相同,稳定性不如苯。
12345678109αβαααβββ1、4、5、8位又称为 位αβ2、3、6、7位又称为 位电荷密度αβ>+ 2H 2Pd / C3H 2四氢化萘十氢化萘O OO 2+ 9O 2V O 400~550℃+ 4CO 2 + 4H 2O 邻苯二甲酸酐重要的有机化工原料N H 24+C OOH C OOH含邻、对位基时同环氧化NO 24+含间位基时异环氧化(2)磺化反应磺化反应的产物与反应温度有关。
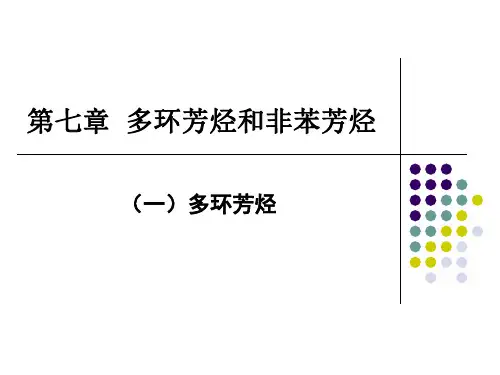
第7章 多环芳烃和非苯芳烃多环芳烃按照苯环相互联结方式可分为:(1)联苯、多连苯类;联苯 对三联苯(2)多苯取代的脂肪烃;二苯甲烷1,2-二苯乙烯(3)稠环芳烃。
萘 蒽 菲7.1 联苯及其衍生物+700~800C -H 2乌尔曼反应(Ullmann Reaction):碘苯在铜的作用下得到联苯。
+ 2 Cu24a) 联苯的化学性质与苯相似,在两个苯环上均可发生磺化,硝化等取代反应; b) 若一个环上有活化基团,则取代反应发生在同环上; c) 若一个环上有钝化基团,则取代反应发生在异环;d) 苯基是邻,对位取代基,取代基主要进入苯基的对位。
O 2HNO 3H SO 2222次由于两个环的邻位有取代基存在时,由于取代基的空间阻碍联苯分子的自由旋转。
产生异构体。
2对映体7.2 稠环芳烃7.2.1 萘及其衍生物(一) 萘的结构平面分子;每个碳原子采取sp 2杂化; 10个 电子;萘分子C 原子的编号:ββα'β3萘衍生物的命名:以奈为母体。
231-氯萘(α-氯萘)2-氯萘(β-氯萘)1,5-二硝基萘4-甲基-1-萘磺酸(对甲基萘磺酸)(二) 萘的性质萘具有255kJ/mol 的共振能(离域能,苯(高)具有152 kJ/mol ,所以萘的稳定性比苯弱,萘比苯容易发生加成和氧化反应,萘的取代反应也比苯容易进行。
(1)萘的亲电取代反应:一般发生在α-。
因为α-取代的σ络合物的共振式中有两个保持了苯环的结构,所以更稳定。
α-β-傅-克酰基化反应:3动力学控制热力学控制磺化和酰基化的时候低温生成动力学控制的α-取代产物;高温时生成热力学控制的更稳定的β-取代产物。
布赫雷尔(Bucherer)反应NH4HSO3o2NaHSO3这是一个可逆的反应。
(2) 萘环二取代的定位规则:1-位上有活化基,第二取代基进入4-位:3(主要产物)2-位有活化基,苯二取代基进入位:33324环上有致钝基,第二取代基进入另一环α-位。
7.1联苯及其衍生物 7.2稠环芳烃
7.2.1萘及其衍生物
萘是有光亮的白色片状晶体,熔点80.2 o C ,沸点218 o C ,不溶于水,易溶于乙醇、乙醚和苯等有机溶剂。
燃烧时光亮弱、烟多。
萘挥发性大,易升华,有特殊气味,具有驱虫防蛀作用,过去曾用于制作“卫生球”。
近年来研究发现,萘可能有致癌作用,现使用樟脑取代萘制造卫生球。
萘在工业上主要用于合成染料、农药等。
萘的来源主要是煤焦油和石油。
1.萘的结构和萘的衍生物的命名
萘的分子式为C 10H 8,是由两个苯环共用两个相邻的碳原子稠合而成,两个苯环处于
同一平面上。
萘分子中每个碳原子均以sp 2
杂化轨道与相邻的碳原子形成碳碳σ键,每个碳原子的p 轨道互相平行,侧面重叠形成一个闭合共轭大π键,因此同苯一样具有芳香性。
但萘和苯的结构不完全相同,萘分子中两个共用碳上的p 轨道除了彼此重叠外,还分别与相邻的另外两个碳上的p 轨道重叠,因此闭合大π键电子云在萘环上不是均匀分布的,导致碳碳键长不完全等同,所以萘的芳香性比苯差。
萘分子中碳碳键长数据如下:
萘的芳香性不如苯还可通过离域能数据看出。
苯的离域能为150.5kJ•mol -1
,如果萘的芳香性和苯一样,萘的离域能应为苯的离域能的2倍,而事实上萘的离域能仅是
250kJ•mol -1。
由于萘环上各碳原子的位置并不完全等同,因此萘的衍生物命名时,无论萘环上有几个取代基,取代基的位置都要注明。
萘环的编号方法如下:
其中,1、4、5、8位置相同,称做α-位;2、3、6、7位置相同,称做β-位。
12345678
ααααβββ
β CH 3CH 3
SO 3H NO 2甲基萘甲基萘硝基 萘磺酸--甲基萘甲基萘12--αβ--52-nm 0.1418nm
0.1415nm 0.1421nm
0.1363
2.萘的化学性质
由于萘环上闭合大π键电子云密度分布不是完全平均化的,因此它的芳香性比苯差。
(1)取代反应 萘比苯更易发生亲电取代反应。
根据测定,萘环的α-位电子云密度比β-位高,因此亲电取代主要发生在α-位。
但由于β-位取代产物的热力学稳定性大于α-位取代产物,所以当温度较高时,主要为β-位取代产物。
在三氯化铁催化下,将氯气通入萘的苯溶液中,主要生成α-氯萘。
萘用混酸进行硝化,主要生成α-硝基萘。
α-硝基萘是合成染料和农药的中间体。
萘在较低的温度下磺化,主要生成α-萘磺酸。
在较高温度时磺化,主要生成β-萘
磺酸。
因磺化反应是可逆的,温度升高使最初生成的α-萘磺酸转化为对热更为稳定的β-萘磺酸。
萘环上亲电取代反应的定位规律: 萘环上有一供电子的定位基时,主要发生同环取代(即取代发生在定位基所在的苯环上)。
若定位基位于α位,取代基主要进入同环的另一α位。
若定位基位于β位,取代基则主要进入定位基相邻的α位。
当萘环上有一吸电子的定位基时,主要发生异环取代,取代基主要进入异环的两个α位。
(2)氧化反应 萘比苯容易被氧化,在不同的条件下,可分别被氧化生成邻苯二甲
酸酐和1,4-萘醌。
氯萘-αCl FeCl
3
Cl 2+( )
95%90 95~%( )硝基萘
NO 2
H 2SO 4
HNO 3
-
α+萘磺酸萘磺酸
-
3H
H 2SO 4
+β-1 4,
,-萘醌邻苯二甲酸酐O
O C 。
33O
O O C
C 。
450V 2O 5
O 2+~
一般来说,萘氧化的产物为苯的衍生物,仍保留一个苯环,表明苯比萘稳定。
7.2.2其它稠环芳烃
蒽和菲的分子式都是C 14H 10,互为同分异构体。
它们都是由三个苯环稠合而成的,并且三个苯环都处在同一平面上。
不同的是,蒽的三个苯环的中心在一条直线上,而菲的三个苯环的中心不在一条直线上。
蒽、菲每个碳原子上的p 轨道互相平行,从侧面重叠形成闭合大π键,因此它们都具有芳香性。
但各个p 轨道重叠的程度不完全等同,环上电子云密度分布比萘环更加不均匀,所以蒽、菲的芳香性比萘差。
在蒽环和菲环上,9,10位(也称γ-位)的电子云密度最高,使得9,10位最活泼,大部分反应发生在这两个位置上。
蒽为无色片状晶体,有蓝紫色荧光,熔点215 o C ,沸点340 o C ,不溶于水,难溶于乙醇、乙醚等,易溶于热苯。
蒽的化学性质比萘更加活泼,容易发生氧化、加成及亲电取代反应。
菲为带光泽的白色片状晶体,溶液发蓝色荧光。
熔点100.5 o C ,沸点340 o C ,不溶于水,能溶于乙醚、乙醇、氯仿和冰醋酸等。
可用于制造农药和塑料,也用作高效低毒农药和无烟火药的稳定剂。
除萘、蒽、菲外,煤焦油还含有一些其它稠环芳烃。
例如:
煤、烟草、木材等不完全燃烧也会产生较多的稠环芳烃,其中某些稠环芳烃具有致癌作
蒽的结构式
1098
7643
2
1菲的结构式10
987654
32
1茚芴芘屈3 4,-苯并芘123456
7
89
1011
234562
3
4二苯并蒽二苯并菲1 2 5 6,,,1 2 3 4-,,,-
Na
N2
Na
成环共平面
π电子= 4
非环状闭合共轭
C
无
芳
性
成环共平面
π电子= 6
环状闭合共轭
C有
芳
性
n=1
其典型代表物为二茂铁,见第十六章元素有机化合物P525
用,如苯并芘类稠环芳烃,特别是3,4-苯并芘有强烈的致癌作用。
3,4-苯并芘为浅黄色晶体,1933年从煤焦油分离得来。
煤的干馏、煤和石油等的燃烧焦化时,都可产生3,4-苯并芘,在煤烟和汽车尾气污染的空气以及吸烟产生的烟雾中都可检测出3,4-苯并芘,这是环境化学值得注意的严重问题。
测定空气中3,4-苯并芘的含量,是环境监测项目的重要指标之一。
7.3非苯芳烃
7.3.1休克尔规则
一百多年前,凯库勒就预见到,出了苯外,可能存在其他具有芳香性的环状
共轭多烯烃。
为了解决这个问题,化学家们作了许多努力,但用共价键理论没有
很好的解决这个问题。
1931年,休克尔(E.Huckel)用简单的分子轨道计算了
单环多烯烃的π电子能级,从而提出了一个判断芳香性体系的规则,称为休克尔
规则。
休克尔提出,单环多烯烃要有芳香性,必须满足三个条件。
(1) 成环原子共平面或接近于平面,平面扭转不大于0.1nm;
(2) 环状闭合共轭体系;
(3) 环上π电子数为4n+2 (n= 0、1、2、3……);
符合上述三个条件的环状化合物,就有芳性,这就是休克尔规则。
例如:
其他不含苯环,π电子数为4n+2的环状多烯烃,具有芳性,我们称它们为非苯
系芳烃。
7.3.2非苯芳烃
1.具有芳香性的离子
(1)戊二烯负离
(2)环庚三烯正离子
个π电子
n = 1
个π电子
n = 2
610
(3) 环辛四烯双负离子
2.薁
薁有明显的极性,其中五元环是负性的,七元环是正性的,可表示如下:
薁有明显的芳香性,表现在能起亲电取代反应上。
例如,薁能起酰基化反应, 取代基进入1,3-位:
薁的衍生物如1,4-二甲基-8-异丙基薁存在于香精中,若含有万分之一时,
就显蓝色,它又叫愈创蓝油烃,是治疗烧伤、烫伤和冻疮的药物。
3
.轮烯
具有交替的单双键的多烯烃,通称为轮烯。
轮烯的分子式为(CH )X ,χ≥10, 命名是将碳原子数放在方括号中,称为某轮烯。
例如:χ=10的叫[10]轮烯。
轮烯有否芳性,决定于下列条件: a
.π电子数符合4n+2规则。
b .碳环共平面(平面扭转不大于0.1nm 。
c .轮内氢原子间没有或很少有空间排斥作用。
(1)
[10]轮烯
H
H
3+-X -X -
无芳性
有芳性
0.1462nm
1
334n m 2K,THF
=2K +
成环
不在同一平面π电子= 8
不能形成环状共轭体系
C 无芳性
成环
在同一平面π电子= 10环状闭合共轭体系
C 无芳性
n = 21
2
34
5
678
天蓝色片状固体,熔点90°含10个π电子,成环C 都在同一平面
是闭环共轭体系,有芳性COCH 3COCH 3COCH 3
AlCl 3
3+
(2) [14] 轮烯
(3)[18] 轮烯
[18]轮烯受热至230℃任然稳定,可发生溴代,硝化等反应,足可见其芳性。
π电子=10,
n = 2
但由于轮内氢原子间的斥力大,使环发生扭转不能共平面,故无芳香性
,π电子=14,
n = 3
但由于轮内氢原子间的斥力大,使环发生扭转不能共平面,故无芳香性
,π电子=18,
n = 4
轮内氢原子间的斥力微弱,环接近于平面故有芳香性
,H H H H
H
H。