高一化学第一学期丰富多彩的物质世界 江苏教育版
- 格式:doc
- 大小:70.34 KB
- 文档页数:5


高中化学学习材料唐玲出品专题1 化学家眼中的物质世界编者叶华斌本专题课程标准内容标准活动与探究建议1.能根据物质的组成和性质对物质进行分类;知道胶体是一种常见的分散系。
2.初步学会物质的检验、分离、提纯和溶液配制等实验技能;认识实验方案的设计。
3.初步认识化学变化的本质。
4.认识摩尔是物质的量的基本单位,能用于进行简单的化学计算,体会定量研究的方法对研究和学习化学的重要作用。
1.尝试按不同的方法对物质进行分类;2.实验探究:①粗盐的提纯;②NH4+、CO32-、Cl-、SO42-、K+等离子的检验③配制一定物质的量浓度的溶液④氢氧化铁胶体的制备⑤铝盐和铁盐的净水作用课时训练第一单元丰富多彩的化学物质第一课时物质的分类和转化本课时课标要求:1.掌握物质的分类方法2.理解单质、氧化物、酸、碱、盐等物质之间的相互转化关系。
3.初步了解通过化学反应实现物质相互转化的重要意义,知道氧化还原反应的特征。
1.下列物质中属于有机化合物的是()A.空气 B.纯碱 C.乙醇(C2H5OH) D.氯化钠2.下列各类物质中一定含有氢、氧两种元素的有()A、单质B、氧化物 C、盐 D、含氧酸3.用Mg、MgO、Mg(OH)2、H2SO4溶液、CuSO4溶液五种物质两两进行反应,能得到MgSO4的方法有()A.3种 B.4种 C.5种 D.无法确定4.下列反应属于氧化还原反应但不属于置换反应的是()A.2HCl+CaCO3====CaCl2+H2O+CO2↑ B.Zn+H2SO4====ZnSO4+H2↑C.C +H2O 高温 CO +H2 D.Fe3O3 +3CO 高温 2Fe +3CO25.请填写下列物质的化学式并按物质组成分类法填写物质类别名称生石灰硫酸铜氖气氯化铁氢氧化镁化学式CaO Ne类别6.盐酸是一种非氧化性强酸,不但能使紫色的石蕊试液变红,还能与下列物质反应:①铁、②氧化铝(Al2O3)③氢氧化铝④碳酸氢钠等,请写出上述反应的化学方程式,并判断反应类型。

高中新课标化学《必修1》专题1 化学家眼中的物质世界第一单元丰富多彩的化学世界【单元分析】本单元教材是以“物质的分类及转化”、“物质的聚集状态”、“物质的分散体系”等化学物质的一般属性为主线进行编写的。
由于物质的分类和转化实质是分子等微观微粒的变化,物质聚集状态的变化实质是分子等微观微粒间相互作用的变化和分子间距离的变化、物质的分散体系也涉及分子等微观微粒,所以本单元很自然地引出了“物质的量”、“气体摩尔体积”等基本概念。
这样编写一方面可以与初中化学进行合理衔接,另一方面又为高中化学后续内容的学习准备必要的基础知识。
在初中化学的学习中,学生已掌握了一些化学反应,知道化学反应的四种基本类型和物质转化的一些实例,但初中化学中没有系统学习和研究有关酸、碱、盐、氧化物等物质之间的转化规律,没有对这些物质的转化反应进行整理总结。
本单元中关于物质的分类和转化内容正好可对初中化学中学习过的化学反应进行总结和归纳,并进行适当的拓展和提高,帮助学生更好地认识化学物质。
还可以为后阶段学习钠、镁、氯、氮和硫等元素化合物的性质和转化规律打下必要基础。
在初中化学的学习中,学生已经接触过气体物质、固体沉淀、溶液、浊液等具体实例,本单元中有关“物质的聚集状态”、“物质的分散体系”的内容就是在这个基础上引导学生从微观角度理解化学物质的存在状态,在原有基础上提升对化学物质的认识,同时为后续内容的学习准备重要的基础。
从化学学科的知识体系来看,物质的量、气体摩尔体积、胶体等都是非常重要的基本概念,被广泛应用于生产、科学研究中,是学生提高自身科学素质所必需的基础知识。
从本专题的三个单元之间的关系看,经过第一单元的学习学生已经了解有关原子的一些基础知识,本单元转向从分子层面去认识化学物质,同时又为第三单元“研究物质的实验方法”打下基础,起着承前启后的作用。
从知识与技能、过程与方法、情感态度和价值观等教学目标角度分析,本单元内容和编排为教学留下了自主发挥的余地。


丰富多彩的化学物质——苏教版必修一、教学目标:1. 让学生了解和掌握常见化学物质的性质、用途和制备方法,培养学生的实验操作能力和科学思维。
2. 通过化学物质的学习,使学生认识化学与生活的密切关系,提高学生的学习兴趣和社会责任感。
3. 培养学生运用化学知识解决实际问题的能力,提升学生的科学素养。
二、教学内容:第一章:生活中的化学物质1. 糖类、脂肪和蛋白质的性质、功能及应用。
2. 生活中的酸、碱、盐的识别及作用。
3. 生活中的氧化物及其应用。
第二章:金属与非金属1. 常见金属的性质、用途及制备方法。
2. 常见非金属的性质、用途及制备方法。
3. 金属及非金属的合金性质与应用。
第三章:有机化合物1. 烃类的性质、用途及制备方法。
2. 醇类、醚类的性质、用途及制备方法。
3. 羧酸、酯类的性质、用途及制备方法。
第四章:化学反应与能量1. 氧化还原反应的基本概念及应用。
2. 酸碱中和反应及其应用。
3. 沉淀反应、络合反应及其应用。
第五章:实验技能与科学探究1. 实验基本操作技能训练。
2. 常见化学物质的性质分析与鉴别。
3. 化学实验方案的设计与评价。
三、教学方法:1. 采用问题驱动法,引导学生主动探究化学物质的性质和应用。
2. 运用案例分析法,使学生了解化学物质在生活和生产中的实际应用。
3. 利用实验教学法,培养学生的实验操作能力和科学思维。
四、教学评价:1. 平时成绩:包括课堂表现、作业完成情况、实验操作能力等。
2. 单元测试:考察学生对各章节知识的掌握情况。
3. 学期末考试:全面检测学生的学业成绩。
五、教学资源:1. 教材:《苏教版必修——丰富多彩的化学物质》。
2. 实验器材:实验室常用仪器和化学试剂。
3. 多媒体教学设备:用于展示教学内容和实验操作。
4. 网络资源:用于拓展学生的知识视野。
六、教学内容:第五章:实验技能与科学探究(续)1. 化学实验数据的处理与分析。
2. 实验安全与环保。
3. 科学探究的方法与步骤。


丰富多彩的物质世界单元剖析一、内容剖析教材从宏观和微观联合的角度经过两个方面描绘了物质的多样性。
一是物质因齐集状态不一样,能够分红气态、液态和固态,并明确指出:三种状态下因为微观构造、微粒的运动方式不一样,物质所表现的宏观性质也不一样。
二是物质因分别状态不一样,能够分红溶液、浊液、胶体,此中分别质的粒子大小有所不一样。
即即是同一种分别系——溶液,如食盐溶液和蔗糖溶液,它们在水中的存在形式又各不同样,这与溶质在水中能否电离有关。
这就初步揭露了物质的微观构造是造成物质世界丰富多彩的重要原由。
在介绍了物质转变的定性关系后,教材明确提出新的问题:物质的研究应关注转变过程中的定量关系。
联合对化学反响中实质参加反响粒子的质量和数目的剖析,让学生了解“将必定数目的微观粒子与可称量物质联系起来”的物理量——物质的量,并联合简单的化学反响议论了物质的量之间的关系,经过标准情况下对气体行为的描绘介绍了气体摩尔体积和计量关系的详细应用。
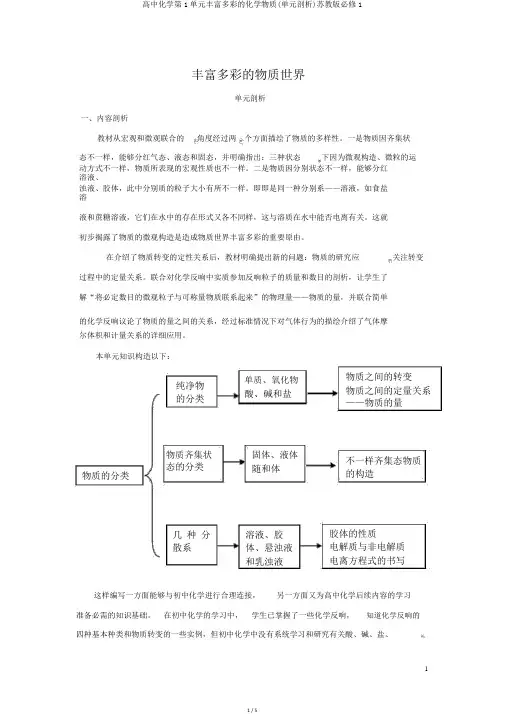
本单元知识构造以下:纯净物的分类物质齐集状态的分类物质的分类几种分散系单质、氧化物酸、碱和盐固体、液体随和体溶液、胶体、悬浊液和乳浊液物质之间的转变物质之间的定量关系——物质的量不一样齐集态物质的构造胶体的性质电解质与非电解质电离方程式的书写这样编写一方面能够与初中化学进行合理连接,另一方面又为高中化学后续内容的学习准备必需的知识基础。
在初中化学的学习中,学生已掌握了一些化学反响,知道化学反响的四种基本种类和物质转变的一些实例,但初中化学中没有系统学习和研究有关酸、碱、盐、氧化物等物质之间的转变规律,没有对这些物质的转变反响进行整理总结。
本单元中对于物质的分类和转变内容正好可对初中化学中学习过的化学反响进行总结和概括,并进行适合的拓展和提高,帮助学生更好地认识化学物质;同时,还能够为后边学习钠、镁、氯、氮和硫等元素化合物的性质和转变规律打下必需基础。
在初中化学的学习中,学生已经接触过气体物质、固体积淀、溶液、浊液等详细实例,本单元中有关“物质的齐集状态”、“物质的分别系统”的内容就是在这个基础上指引学生从微观角度理解化学物质的存在状态,在原有基础上提高对化学物质的认识,同时为后续内容的学习准备重要的基础。


高中化学——苏教版(必修1)——第一章——化学家眼中的物质世界——第一单元丰富多彩的化学世界(2)物质的量教案【三维目标】知识与技能:1、知道摩尔是物质的量的基本单位。
2、了解物质的量、物质的粒子数、物质的质量、摩尔质量之间的关系。
3、体会摩尔这一概念的重要作用,懂得阿伏加德罗常数的涵义。
过程与方法:1、初步学会物质的量、摩尔质量、质量之间的简单计算。
2、初步培养学生演绎推理、归纳推理、逻辑推理和运用化学知识进行计算的能力。
情感、态度与价值观:通过对概念的透彻理解,培养学生严谨、认真的学习态度,使学生掌握科学的学习方法。
【新课标】认识摩尔是物质的量的基本单位,能用于进行简单的化学计算,体会定量研究的方法对研究和学习化学的重要作用。
【教学重点】物质的量及其单位【教学难点】摩尔质量和有关计算【教具准备】多媒体投影仪【课时安排】2课时物质的量(第一课时)【教学过程】【引言】前面我们了解了不同物质之间的分类和相互转化,在研究物质的转化过程中,常常涉及到原子、分子的量的关系。
分子、原子、离子等我们肉眼看不见的粒子,可以构成客观存在的、具有一定质量的物质。
这说明,在我们肉眼看不见的粒子与物质的质量之间,必定存在着某种联系。
那么,联系他们的桥梁是什么呢?科学上,我们用“物质的量”这个物理量把一定数目的原子、分子、或离子等微观粒子与可称量的物质联系起来。
今天我们一起来学习“物质的量”的有关知识。
【过渡】什么是物质的量呢?它就是本节课我们所要认识的对象。
【板书】物质的量【讲解】就像长度可用来表示物体的长短,温度可表示物体的冷热程度一样,物质的量可用来表示物质所含粒子数目的多少,其符号为n,它是国际单位制中的基本物理量,四个字不能分开。
长度、温度的单位分别是米和开尔文,物质的量的单位是摩尔,符号mol,简称摩。
【板书】二、物质的量1、物质的量是一个物理量,符号为n,单位为摩尔(mol)。
【过渡】既然物质的量是用来表示物质所含粒子数目的多少的,那么,物质的量的1个单位即1 mol表示的数目是多少呢?指导学生阅读,分析书上有关内容,并得出结论。

31《从实验学化学》单元测试题(A 卷)
班别 学号 姓名 成绩
相对原子量:H 1 C 12 N 14 Na 23 S 32
一、选择题(每小题只有一个正确答案,每小题4分,共56分。
)
1、下列实验操作均要用玻璃棒,其中玻璃棒的作用及其目的相同的是
① 过滤 ② 蒸发 ③ 溶解 ④ 向容量瓶转移液体
A .①和②
B .①和③
C .③和④
D .①和④
2、实验中的下列操作正确的是
A .用试管取出试剂瓶中的Na 2CO 3溶液,发现取量过多,为了不浪费,又
把过量的试剂倒入试剂瓶中
B .Ba(NO 3)2 溶于水,可将含有Ba(NO 3)2 的废液倒入水池中,再用水冲入
下水道
C .用蒸发方法使NaCl 从溶液中析出时,应将蒸发皿中NaCl 溶液全部蒸
干才停止加热。
D .用浓硫酸配制一定物质的量浓度的稀硫酸时,浓硫酸溶于水后,应冷却
至室温才能转移到容量瓶中
3、下列事故处理方法正确的是
A. 汽油失火时,立即用水灭火
B. 电线短路失火时,要用泡沫灭火器灭火
C. 浓 NaOH 溶液溅到皮肤上,立即用水冲洗,然后涂上稀硼酸溶液
D. 浓硫酸溅到皮肤上,立即用稀 NaOH 溶液洗涤
4、萃取碘水中的碘,可用的萃取剂是 ①四氯化碳 ②汽油 ③酒精
A. 只有①
B. ①和②
C. ①和③
D. ①②③
5、从碘的四氯化碳溶液中分离出碘、并回收四氯化碳,所采用的方法是
A. 蒸发
B. 蒸馏
C. 过滤
D. 分液
6、在蒸馏实验中,下列叙述不正确的是
A. 在蒸馏烧瓶中盛约 体积的自来水,并放入几粒沸石
B. 将温度计水银球插入自来水中
C. 冷水从冷凝管下口入,上口出
D. 收集蒸馏水时,应弃去开始馏出的部分
7、右图是 10ml 量筒的一部分,数字XY 之间相差 1ml
x y
若X=5,则量筒所盛液体的体积是
A. 5.7 ml
B. 4.4 ml
C. 4.3 ml
D. 6.3 ml
8、用托盘天平称取10.1g NaOH 试样,下列操作中,正确的是
A. 将NaOH 放在天平左边托盘中的纸片上
B. 将NaOH 放入烧杯中(烧杯事先已称重),并放在天平右边托盘上
C. 用镊子取出标定为10.1g 的砝码放在天平右边的托盘上
D. 用镊子取出标定为10g的砝码放在天平右边的托盘上,并将游码向右移到
0.1g位置上
9、某溶液中滴入BaCl2溶液,产生白色沉淀,再滴入稀硝酸,沉淀不溶解,则该溶液中
A. 一定有SO42-
B. 可能有SO42-或Ag+
C. 一定无Ag+
D. 还可能有CO32-
10、下列叙述正确的是
A. 1 mol CO2的质量为44g/mol
B. CO2的摩尔质量为44g
C. CO2的摩尔等于CO2的相对分子质量
D. N A个CO2的质量与CO2的相对分子质量在数值上相同
11、已知1.505×1023个X气体分子的质量为8g,则X气体的摩尔质量是
A.16g B.32g C.64g /mol D.32g /mol 12、科学家已发现一种新型氢分子,其化学式为H3,在相同条件下,等质量的
H3和H2相同的是
A.原子数B.分子数C.体积D.物质的量
13、欲配制100ml 1.0 mol/L Na2SO4溶液,正确的方法是
①将14.2 g Na2SO4 溶于100ml水中
②将32.2g Na2SO4·10H2O溶于少量水中,再用水稀释至100 ml
③将20 ml 5.0 mol/L Na2SO4溶液用水稀释至100 ml
A.①②B.②③C.①③D.①②③
14、用N A表示阿伏加德罗常数,下列叙述正确的是
A. 64g SO2含有氧原子数为1N A
B. 物质的量浓度为0.5mol/L Mg Cl2溶液,含有Cl-离子数为1N A
C. 标准状况下,22.4L H2O的分子数为1N A
D. 常温常压下,14g N 2含有分子数为0.5N A
二、非选择题(44分)
15、(6分)(1)有两瓶C Cl 4和水都是无色液体,只用试管,不用任何其它试剂,如何鉴别?简要写出实验方案
;
(2)有一小块外表不规则且质地坚实的碳酸钙,设计一个实验方案用以测定
这种碳酸钙的密度,提供的仪器有:托盘天平,100ml 量筒,要用到的试剂
可任意取用
16、(15分)氯化钠样品含有少量的Na 2SO 4 和 Na 2CO 3,按下列流程进行净化,
请在流程中的( )中写上合适的试剂,在[ ]中写上实验操作名称
写出有关反应的化学方程式:
第步② 第步③ 第步⑤
17、(14分)用18mol/L 浓硫酸配制100 ml 3.0mol/L 稀硫酸的实验步骤如下:
① 计算所用浓硫酸的体积 ② 量取一定体积的浓硫酸 ③ 溶解 ④ 转
移、洗涤 ⑤ 定容、摇匀
回答下列问题
(1)所需浓硫酸的体积是 ,量取浓硫酸所用的量筒的规格
是
(从下列中选用 A. 10ml B. 25ml C. 50ml D. 100ml )
氯化钠 样品 溶液 ( ) [ ]
溶合液 溶合液 澄清溶液 ( ) ( ) [ ] ( ) 纯净溶液 [ ] NaCl 晶体 ① ② ③ ④ ⑤ ⑥
20
V m (2)第③步实验的操作是
(3)第⑤步实验的操作是
(4)下列情况对所配制的稀硫酸浓度有何影响?(用偏大、偏小、无影响填写)
A. 所用的浓硫酸长时间放置在密封不好的容器中
B . 容量瓶用蒸馏洗涤后残留有少量的水
C. 所用过的烧杯、玻璃棒未洗涤
D . 定容时俯视溶液的液凹面
18.(9分)计算题
取1.43g Na 2CO 3·XH 2O 溶于水配成10ml 溶液,然后逐滴滴入稀盐酸直至没有
气体放出为止,用去盐酸 2.0ml ,并收集到112ml CO 2(标况)。
求(1)稀盐酸物质的量浓度(2)Na 2CO 3·xH 2O 的摩尔质量(3)x 值
A 卷参考答案
1.D
2.C
3.C
4.B
5.B
6.B
7.C
8.D
9.B 10.D
11.D 12.A 13.B 14.D
15.(1)用试管取少量其中1种液体,再向试管滴入另1种液体,下层的是CCl 4,
上层的是水(或其它合理的方法,如闻气味等)(3分)
(2)先用天平称出CaCO 3质量为mg ,再用量筒量取20 ml 水,然后把CaCO 3固
体放入量筒中,读出液凹面刻度为Vml ,则ρ(CaCO 3) = g/cm 3 (3分)
16. ① 蒸馏水;溶解 ② BaCl 2溶液 ③ Na 2CO 3溶液 ④ 过滤 ⑤ 稀
盐酸
⑥ 蒸发结晶(每空1分,共7分)
② Na 2SO 4 + BaCl 2 = BaSO 4↓+ 2NaCl ,Na 2CO 3 + BaCl 2 = BaCO 3↓+2NaCl
③ BaCl 2 + Na 2CO 3 = BaCO 3↓+ 2NaCl
⑤ Na 2CO 3 + 2HCl = 2NaCl + H 2O + CO 2↑(每一式2分,共8分)
17、(1)16.7ml B (3+1分)
(2)先向烧杯加入30ml 蒸馏水,然后将浓硫酸沿烧杯内壁缓慢倒入烧杯中,并用玻璃棒搅拌。
(3分)
(3)继续向容量瓶注入蒸馏水至离刻度线1-2cm处,改出胶头滴管向容量瓶滴加至液凹面与刻度线相切为止。
塞紧瓶塞,倒转摇匀。
(3分)
(4)A. 偏小 B. 无影响 C. 偏小 D. 偏大(各1分,共4分)
18、(1)5.0mol/l (2)286g/mol (3)10(各3分,共9分)。