8.晶体的各向异性和多晶型性
- 格式:doc
- 大小:64.00 KB
- 文档页数:3

第二章晶体学终极重点:1、晶体特征,晶体与非晶体区别 2、晶向与晶面指数确定步骤1.晶体的性能特征:均一性,各向异性,自限性,对称性,最小内能性;2.对称操作与对称要素:对称轴,对称面,对称中心,倒转轴;3.晶向指数与晶面指数:确定步骤;4.球体的堆积:六方,面心立方,体心立方5.鲍林规则;6.各种典型晶体构型;7.硅酸盐晶体结构与实例:岛状,链状,层状,架状;8.同质多晶现象:可逆转变,不可逆转变,重建型转变,位移型转变。
1.晶体的性能特征:均一性,各向异性,自限性,对称性,最小内能性(1)晶体的基本特征晶体的性能特征结晶均一性:在晶体内部任意部位上具有相同的性质;各向异性:在晶体不同方向上表现出的性质差异;自限性:能够自发形成封闭的凸几何多面体外形的特性;对称性:晶体中的相同部分(晶面,晶棱,等等)以及晶体的性质能够在不同方向或位置上有规律地重复;最小内能性:在相同的热力学条件下,晶体与同组成的气体、液体及非晶态固体相比具有最小内能,即最为稳定。
(2)对称操作与对称要素:对称操作:使晶体的点阵结构和性质经过一定程序后能够完全复原的几何操作;对称要素:实施对称操作所依赖的几何要素(点,线,面等);1.旋转操作与对称轴:一个晶体如能沿着某一轴线旋转360 / n(n = 1, 2, 3, 4, 6)后使晶体位置完全回复原状,则该晶体具有n 重对称轴;2.反映操作和对称面:一个晶体中如果存在某一个平面,使平面两边进行反映操作,而令晶体复原,则这个平面称为对称面;3.反演操作和对称中心:一个晶体中央在某一个几何点,使晶体外形所有晶面上各点通过该几何点延伸到相反方向相等距离时,能够使晶体复原的操作。
该几何点称为对称中心。
4.旋转反演操作和对称反轴:旋转之后进行反演使晶体复原的操作;只有4¯是新的独立对称要素。
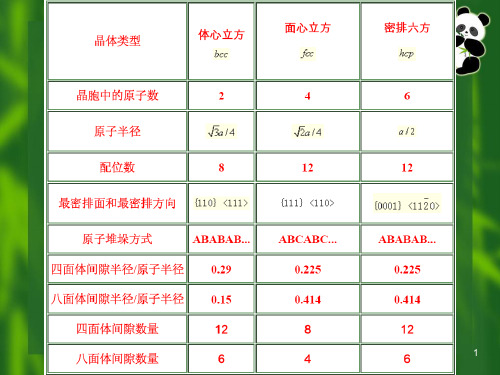
(3)晶向指数与晶面指数:确定步骤晶向指数:以晶胞的某一阵点O为原点,过原点O的晶轴为坐标轴x,y,z,以晶胞点阵矢量的长度作为坐标轴的长度单位;过原点O作一直线OP,使其平行于待定晶向;在直线OP上选取距原点O最近的一个阵点P,确定P点的3个坐标值;将这3个坐标值化为最小整数u,v,w,加以方括号,[ u v w ]即为待定晶向的晶向指数。


材料科学基础名词解释第一章固体结构1、晶体 :原子按一定方式在三维空间内周期性地规则重复排列,有固定熔点、各向异性。
非晶体 :原子没有长程的周期排列,无固定的熔点,各向同性等。
2、中间相 : 两组元 A 和 B 组成合金时,除了形成以 A 为基或以 B 为基的固溶体外,还可能形成晶体结构与 A,B 两组元均不相同的新相。
由于它们在二元相图上的位置总是位于中间,故通常把这些相称为中间相。
3、晶体点阵:由实际原子、离子、分子或各种原子集团,按一定几何规律的具体排列方式称为晶体结构或晶体点阵。
4、配位数 :晶体结构中任一原子周围最近邻且等距离的原子数。
5、晶格:描述晶体中原子排列规律的空间格架称之为晶格。
6、晶胞 :在点阵中取出一个具有代表性的基本单元(最小平行六面体)作为点阵的组成单元,称为晶胞。
7、空间点阵:由周围环境相同的阵点在空间排列的三维列阵成为空间点阵。
8、晶向:在晶格中,穿过两个以节点的任一直线,都代表晶体中一个原子列在空间的位向,称为晶向。
9、晶面:由节点组成的任一平面都代表晶体的原子平面,称为晶面。
10、晶向指数(晶面指数):为了确定晶面、晶向在晶体中的相对取向、就需要一种符号,这种符号称为晶面指数和晶向指数。
国际上通用的是密勒指数。
一个晶向指数并不是代表一个晶向,二十代表一组互相平行、位向相同的晶向。
11、晶向族:原子排列相同但空间位向不同的所有晶向称为晶向族,以<uvw>表示。
12、晶面间距:相邻两个平行晶面之间的垂直距离。
低指数晶面的面间距较大,而高指数晶面的面间距较小。
晶面间距越大,则该晶面上原子排列越紧密,该原子密度越大。
13、配位数:每个原子周围最近邻且等距离的原子数目,称为配位数。
14、多晶型性:有些金属固态在不同温度或不同压力范围内具有不同的晶体结这种性质构,称为晶体的多晶型性。
15、多晶型性转变:具有多晶型性的金属在温度或压力变化由一种结构转变为另一种结时,构的过程称为多晶型性转变,也称为同素异构转变。

《晶体的类型和性质》练习题1.晶体具有各向异性。
如蓝晶石(Al 2O 3·SiO 2)在不同方向上的硬度不同;又如石墨在与层垂直的方向上的导电率与层平行的方向上的导电率1∕104。
晶体的各向异性主要表现在是( )①硬度 ②导热性 ③导电性 ④光学性质A .①③B .②④C .①②③D .①②③④2.组成晶体的质点(分子、原子、离子)以确定的位置在空间作有规则排列,具有一定几何形状的空间格子,称为晶格,晶格中能代表晶体结构特征的最小重复单位称为晶胞。
在冰晶石(Na 3AlF 6)晶胞中,AlF 63-占据的位置相当于NaCl 晶胞中C1-占据的位置,则冰晶石晶胞中含有的原子数与食盐晶胞中含有的原子数之比为( )A .2:1B .3:2C .5:2D .5:13.SiCl 4的分子结构与CCl 4类似,对其做出如下推断:①SiCl 4晶体是分子晶体;②常温常压SiCl 4不是气体;③SiCl 4分子是由极性键构成的非极性分子;④SiCl 4熔点高于CCl 4。
其中正确的是( ) A .只有① B .只有①② C .只有②③ D .①②③④4.下列物质的熔、沸点高低顺序正确的是( )A .金刚石,晶体硅,二氧化硅,碳化硅B .CI 4>CBr 4>CCl 4>CH 4C .MgO>H 2O>O 2>N 2D .金刚石>生铁>纯铁>钠5.科学家最近发现一种由钛原子和碳原子构成的气态团簇分子,如右上图所示:图中顶角和面心的原子都是钛原子,棱的中心和体心的原子都是碳原子。
该分子的化学式是( ) A .Ti l3C 14 B .Ti 14C 13 C .Ti 4C 5 D .TiC6.下图是从NaCl 或CsCl 晶体结构图中分割出来的部分结构图,其中属于从NaCl 晶体中分割出来的结构图是( )A .图(1)和图(3)B .图(2)和图(3)C .图(1)和图(4)D .只有图(4)7.朱经武(Paul Chu)教授等发现钇钡铜氧化合物在90K 温度下即具有超导性,该化合物的结构如图所示。

晶体是什么意思有哪些特征原⼦、离⼦或分⼦按⼀定空间次序排列⽽成的固体,具有规则的外形。
⾷盐、⽯英、云母、明矾等都可形成晶体。
也叫结晶体或结晶。
晶体的特征(1)⾃然凝结的、不受外界⼲扰⽽形成的晶体拥有整齐规则的⼏何外形,即晶体的⾃范性。
(2)晶体拥有固定的熔点,在熔化过程中,温度始终保持不变。
(3)单晶体有各向异性的特点。
(4)晶体可以使X光发⽣有规律的衍射。
宏观上能否产⽣X光衍射现象,是实验上判定某物质是不是晶体的主要⽅法。
(5)晶体相对应的晶⾯⾓相等,称为晶⾯⾓守恒。
晶体的特性晶体的分布⾮常⼴泛,⾃然界的固体物质中,绝⼤多数是晶体。
⽓体、液体和⾮晶物质在⼀定的合适条件下也可以转变成晶体。
1.长程有序:晶体内部原⼦在⾄少在微⽶级范围内的规则排列。
2.均匀性:晶体内部各个部分的宏观性质是相同的。
3.各向异性:晶体中不同的⽅向上具有不同的物理性质。
4.对称性:晶体的理想外形和晶体内部结构都具有特定的对称性。
5.⾃限性:晶体具有⾃发地形成封闭⼏何多⾯体的特性。
6.解理性:晶体具有沿某些确定⽅位的晶⾯劈裂的性质。
7.最⼩内能:成型晶体内能最⼩。
8.晶⾯⾓守恒:属于同种晶体的两个对应晶⾯之间的夹⾓恒定不变。
晶体化学原理⾸先涉及键型、构型以及它们随组成⽽变异的规律,其原理的表达主要通过组成晶体结构的原⼦、离⼦的数量关系、⼤⼩关系和作⽤⼒的本质及其变异等要素来进⾏。
性能中⾸要的是决定某⼀物质或化合物能否存在的稳定性,⽽晶体及其所包含的分⼦的其他物理或化学性质也⽆不由其结构来决定。
现代晶体化学是在⼤量实测系列晶体结构信息的基础上总结出规律的。
因此,它⼀⽅⾯有其坚实的实践基础,另⼀⽅⾯能对材料科学、合成化学、⽣物化学、地球化学和矿物学等相邻学科起重要的指导作⽤。
五,晶体的各向异性晶体具有各向异性的原因是由于在不同品向上的原子紧密程度不同所致。
原子的紧密程度不同,意味着原子之间的距离不同,则导致原子间结合力不同,从而使晶体在不同晶向上的物理,化学和力学性能不同具体性能即无论是弹性模量、断裂抗力,屈服强度,还是电阻率、磁导率、线膨胀系数以及在酸中的溶解度等方面都表现出明显的差异例如具有体心立方晶格的Fe -α单晶体100晶向的原子密度即单位长度的原子数为a 1,110晶向为a7.0,而111晶向为a16.1,所以111为最大原子密度晶向,其弹性模量GPa E 290=,100晶向的GPa E 135=,前者是后者的两倍多。
同样,沿原子密度最大的晶向的屈服强度,磁导率等性能,也显示出明显的优越性。
在工业用的金属材料中通常却见不到这种各向异性特征如上述Fe -α的弹性模量不论方向如何其弹性模量E 均在GPa 210左右这是因为,一般固态金属均是由很多结晶颗粒所组成,这些结晶颗粒称为晶粒。
由于多晶体中的晶粒位向是任意的,晶粒的各向异性被互相抵消,因此在一般情况下整个晶体不显示各向异性,称之为伪等向性一般固态金属均是由很多结晶颗粒所组成这些结晶颗粒称为晶粒图1-27为纯铁的显微组织图1-28为纯铜的显微组织图中的每一颗晶粒由大量的位向相同的晶胞组成晶粒与晶粒之间存在着位向上的差别如图1.29所示凡由两颗以上晶粒所组成的晶体称为多晶体一般金属都是多晶体只有用特殊的方法才能获得单个的晶体即单晶体特殊的加工工艺获得各向异性已在工业生产中得到了应用:如果用特殊的加工处理工艺,使组成多晶体的每个晶粒的位向大致相同,那么就将表现出各向异性,这点已在工业生产中得到了应用用特殊的工艺可以制备单个的晶体即单晶体少数金属以单晶体形式使用单晶铜:伸长率高电阻率低和极高的信号传输性能,可作为生产集成电路微型电子器件及高保真音响设备所需的高性能材料六,多晶型性多晶型性和同素异构转变:● 大部分金属只有一种晶体结构,但也有少数金属如Sn Be Ti Mn Fe ,,,,等具有两种或几种晶体结构,即具有多晶型。
为什么单晶体具有各向异性,而多晶体在一般情况下不显示各向异性?答:在单晶体中不同晶面和晶向上的原子密度不同,原子间的结合力就不同,因而晶体在不同方向上性能各异。
而多晶体是由许多位向不同的单晶体组成的,各个晶粒在整块金属内的空间位向是任意的,整个晶体各个方向上的性能则是大量位向各不相同的晶粒性能的均值,所以一般不显示各向异性。
综述晶体缺陷对金属强度的作用和机理。
答:①空位、置换原子、间隙原子均提高材料强度(固溶强化)。
点缺陷造成晶格畸变,与位错相互作用,增大了位错运动阻力。
间隙原子的作用最大,置换原子次之,空位的作用最小。
②当位错密度非常低时,位错降低强度,因为位错破坏了晶体的完整性,通过位错滑移比完整晶体的滑移更容易进行。
但当位错密度较高时,随位错密度的增大强度提高,因为位错与位错交割时增大了位错阻力。
③位错不能直接通过大角度晶界、相界、孪晶界,所以提高强度(细晶强化),小角度晶界对位错运动也有一定阻碍作用也能提高强度,但效果很小。
1.假设过冷液体中出现一个立方体晶胚,证明形核功ΔGc=1/3Ac σ(Ac 为临界晶核表面积)。
说明形核功和临界晶核尺寸的意义。
证明:设晶核边长为a ,则 σ⨯⨯+∆=∆236a G a G vσσσσσσσσσσc c v v v c v c c vv c v A a G G G a G a G G G a a G a daG d 312)(32)(96)(64643120123222323232==∆=∆+∆-=+∆=∆∆-=∆-==+∆=∆得: 3.简述湿润角θ,杂质粒子的晶体结构和表面形态对异质形核的影响。
答:①θ角越小,形核率越大。
②杂质粒子的晶体结构与固相晶体结构越相似,形核率越大。
③凹面比凸面形核率大。
4.根据形核理论说明变质处理细化晶粒的机理。
答:根据形核理论,形核需要一定的形核功,变质处理减小了形核功,因而更容易形核,提高了形核率,或者降低长大速度,增大形核率与长大速率的比值,使晶粒细化,从而使铸件的晶粒细化。
五,晶体的各向异性
晶体具有各向异性的原因
是由于在不同品向上的原子紧密程度不同所致。
原子的紧密程度不同,意味着原子之间的距离不同,则导致原子间结合力不同,从而使晶体在不同晶向上的物理,化学和力学性能不同
具体性能
即无论是弹性模量、断裂抗力,屈服强度,还是电阻率、磁导率、线膨胀系数以及在酸中的溶解度等方面都表现出明显的差异
例如具有体心立方晶格的Fe -α单晶体
100晶向的原子密度即单位长度的原子数为a 1,110晶向为a
7.0,而111晶向为a
16.1,所以111为最大原子密度晶向,其弹性模量GPa E 290=,100晶向的GPa E 135=,前者是后者的两倍多。
同样,沿原子密度最大的晶向的屈服强度,磁导率等性能,也显示出明显的优越性。
在工业用的金属材料中通常却见不到这种各向异性特征如上述Fe -α的弹性模量不论方向如何其弹性模量E 均在GPa 210左右
这是因为,一般固态金属均是由很多结晶颗粒所组成,这些结晶颗粒称为晶粒。
由于多晶体中的晶粒位向是任意的,晶粒的各向异性被互相抵消,因此在一般情况下整个晶体不显示各向异性,称之为伪等向性
一般固态金属均是由很多结晶颗粒所组成这些结晶颗粒称为晶粒
图1-27为纯铁的显微组织图1-28为纯铜的显微组织
图中的每一颗晶粒由大量的位向相同的晶胞组成
晶粒与晶粒之间存在着位向上的差别如图1.29所示
凡由两颗以上晶粒所组成的晶体称为多晶体
一般金属都是多晶体
只有用特殊的方法才能获得单个的晶体即单晶体
特殊的加工工艺获得各向异性已在工业生产中得到了应用:
如果用特殊的加工处理工艺,使组成多晶体的每个晶粒的位向大致相同,那么就将表现出各向异性,这点已在工业生产中得到了应用
用特殊的工艺可以制备单个的晶体即单晶体
少数金属以单晶体形式使用
单晶铜:
伸长率高电阻率低和极高的信号传输性能,可作为生产集成电路微型电子器件及高保真音响设备所需的高性能材料
六,多晶型性
多晶型性和同素异构转变:
● 大部分金属只有一种晶体结构,但也有少数金属如Sn Be Ti Mn Fe ,,,,等具有两
种或几种晶体结构,即具有多晶型。
● 当外部条件(如温度和压强)改变时,金属内部由一种晶体结构向另一种晶
体结构的转变称为多晶型转变或同素异构转变。
● 如Fe 在912度以下为体心立方晶格称为Fe -α,在912~1394时具有面心立方
晶格称为Fe -γ,而从1394至熔点,又转变为体心立方晶格称为Fe -δ。
同素异构转变或多晶型转变时的体积变化:
由于不同的晶体结构具有不同的致密度,因而当发生多晶型转变时,将伴有比容或体积的突变。
图1-30为纯铁加热时膨胀曲线
Fe -α的致密度小,Fe -γ的致密度大,Fe -δ的致密度又小,所以在912度由Fe -α转变为Fe -γ时体积突然减小,而Fe -γ在1394度转变为Fe -δ时体积又突然增大,在曲线上出现了明显的转折点。
其他:
除体积变化外,多晶型转变还会引起其它性能的变化。