酸碱盐基本知识复习
- 格式:doc
- 大小:53.50 KB
- 文档页数:4
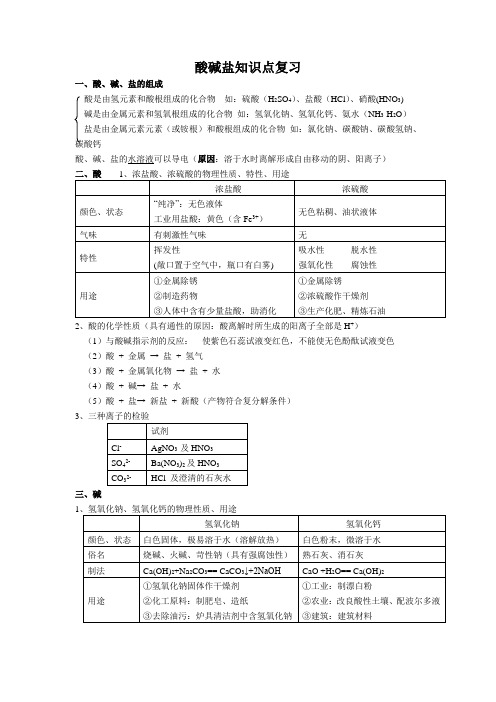
酸碱盐知识点复习一、酸、碱、盐的组成酸是由氢元素和酸根组成的化合物如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)碱是由金属元素和氢氧根组成的化合物如:氢氧化钠、氢氧化钙、氨水(NH3·H2O)盐是由金属元素元素(或铵根)和酸根组成的化合物如:氯化钠、碳酸钠、碳酸氢钠、碳酸钙酸、碱、盐的水溶液可以导电(原因:溶于水时离解形成自由移动的阴、阳离子)2、酸的化学性质(具有通性的原因:酸离解时所生成的阳离子全部是H+)(1)与酸碱指示剂的反应:使紫色石蕊试液变红色,不能使无色酚酞试液变色(2)酸+ 金属→ 盐+ 氢气(3)酸+ 金属氧化物→ 盐+ 水(4)酸+ 碱→ 盐+ 水(5)酸+ 盐→ 新盐+ 新酸(产物符合复分解条件)3三、碱12、碱的化学性质(具有通性的原因:离解时所生成的阴离子全部是OH-)(1)与酸碱指示剂的反应:使紫色石蕊试液变蓝色,使无色酚酞试液变红色(2)碱+ 非金属氧化物→ 盐+水(CO例外)(3)碱+ 酸→ 盐+水(4)碱+ 盐→ 新盐+新碱(反应物均可溶,产物符合复分解条件)四、盐1、氯化钠、碳酸钠、碳酸氢钠、碳酸钙2、盐的化学性质(1)盐+ 金属→ 新盐+ 新金属(2)盐+ 酸→ 新盐+ 新酸(3)盐+ 碱→ 新盐+ 新碱(4)盐+ 盐→ 新盐+ 新盐注意:①酸碱盐之间的反应都属于复分解反应,要发生反应的活,就必须满足生成物中有沉淀或有气体或有水生成时,②常见溶液的颜色:含Cu2+的溶液呈蓝色;含Fe3+的溶液呈黄色;含Fe2+的溶液呈浅绿色③常见沉淀的颜色:Cu(OH)2是蓝色沉淀;Fe(OH)3是红褐色沉淀;常见7种白色沉淀(如CaCO3、BaCO3、Mg(OH)2、Ag2CO3、Al(OH)3。
AgCl、BaSO4等)。
在上述沉淀中只有AgCl和BaSO4不溶于稀硝酸,其余沉淀都可以溶于酸。
四、中和反应溶液酸碱度的表示法——pH1、定义:酸与碱作用生成盐和水的反应2、应用:(1)改变土壤的酸碱性(2)处理工厂的废水(3)用于医药3、溶液酸碱度的表示法——pH(1酸性增强中性碱性增强(2)pH的测定:最简单的方法是使用pH试纸用玻璃棒(或滴管)蘸取待测试液少许,滴在pH试纸上,显色后与标准比色卡对照,读出溶液的pH(读数为整数)(3)酸雨:正常雨水的pH约为5.6(因为溶有CO2)pH<5.6的雨水为酸雨。

化学酸碱盐知识点总结一、酸碱盐的概念1. 酸的概念酸是指具有酸性的化合物,通常包括氢离子(H+),它们能与碱反应产生盐和水。
常见的酸包括盐酸、硫酸、硝酸等。
2. 碱的概念碱是指具有碱性的化合物,通常包括氢氧根离子(OH-),它们能与酸反应产生盐和水。
常见的碱包括氢氧化钠、氢氧化钙、氨水等。
3. 盐的概念盐是指由酸和碱中和生成的化合物,通常包括阳离子和阴离子。
常见的盐包括氯化钠、硫酸铜、硝酸银等。
二、酸碱盐的性质1. 酸的性质(1)蓝石酚红试纸在酸性溶液中变色;(2)酸与金属反应产生氢气;(3)酸与碱反应产生盐和水。
2. 碱的性质(1)红石鹼试纸在碱性溶液中变色;(2)碱与金属反应产生氢气;(3)碱与酸反应产生盐和水。
3. 盐的性质(1)一般盐在水中可以溶解;(2)熔化的盐可以导电;(3)盐的溶液可以与银离子反应生成沉淀。
三、酸碱中和反应酸碱中和反应是指酸和碱反应生成盐和水的化学反应。
反应式通常写作:酸 + 碱→ 盐 + 水酸碱中和反应是生活中常见的化学反应,例如胃酸与碳酸氢钠反应产生氯化钠和二氧化碳:HCl + NaHCO3 → N aCl + H2O + CO2四、酸碱指示剂酸碱指示剂是一种可以根据颜色变化来判断溶液是酸性、中性还是碱性的化学物质。
常见的酸碱指示剂有蓝石酚红、溴甲酚绿、酚酞等。
它们可以根据酸碱中和反应的溶液的PH值变化而改变颜色。
五、酸、碱、盐的应用1. 酸的应用酸可以用于金属表面的腐蚀、食品加工、制药等方面。
例如,醋酸可用于食品的调味,硫酸可以用于废水的处理等。
2. 碱的应用碱可以用于肥皂和洗涤剂的制备、中和酸性土壤等方面。
例如,氢氧化钠可以用于纺织品的脱色和漂白。
3. 盐的应用盐可以用于食品加工、化工工业、农业生产等方面。
例如,氯化钠可以用于食品的腌制和保存,硝酸银可以用于摄影和医学消毒等。
通过上述酸碱盐的知识点总结,我们可以更加深入地了解酸碱盐的概念、性质、反应和应用。
酸碱盐是化学中的重要内容,它们在生活中有着广泛的应用,对人们的生产生活有重要的影响。

化学高考化学酸碱盐的重点整理酸碱盐是高考化学的重要考点之一,对于学生来说,熟练掌握酸碱盐的性质、性质变化及相关计算是必不可少的。
本文将对高考化学酸碱盐的相关知识进行重点整理,帮助学生系统地学习并提升化学成绩。
一、酸碱盐的基本概念和性质1. 酸的定义根据布朗酸碱理论,酸可以定义为能够接受电子对的物质。
2. 碱的定义根据布朗酸碱理论,碱可以定义为能够提供电子对的物质。
3. 盐的定义盐是在酸碱反应中,酸和碱中的氢离子和氢氧根离子相互结合形成的化合物。
4. 酸碱指示剂酸碱指示剂是一种能够根据溶液的酸碱程度改变颜色的物质,常用的酸碱指示剂有酚酞、甲基橙等。
二、常见酸碱盐的性质变化1. 酸的性质变化酸与金属的反应产生相应的盐和氢气,例如硫酸与锌反应生成硫酸锌和氢气:H2SO4 + Zn → ZnSO4 + H2酸与碱的反应产生相应的盐和水,例如盐酸与氢氧化钠反应生成氯化钠和水:HCl + NaOH → NaCl + H2O2. 碱的性质变化碱与酸的反应产生相应的盐和水,例如氢氧化钠与盐酸反应生成氯化钠和水:NaOH + HCl → NaCl + H2O碱与非金属氧化物的反应产生相应的盐和水,例如氢氧化钠与二氧化碳反应生成碳酸钠和水:2NaOH + CO2 → Na2CO3 + H2O3. 盐的性质变化盐可以分解产生酸和碱,例如氯化铵在加热时分解产生盐酸和氨气:NH4Cl → HCl + NH3盐的水溶液可以导电,但在固态下通常不导电。
三、酸碱盐的计算1. 酸碱中的质量计算根据酸碱反应的化学方程式和反应物的质量关系,可以计算出反应中所需的物质的质量。
2. 酸碱中的浓度计算根据溶液的浓度定义和溶液的体积关系,可以计算出溶液的浓度。
3. 盐的溶解度计算根据盐的溶解度定义和溶液的溶度关系,可以计算出盐在溶液中的溶解度。
四、酸碱盐的应用1. 酸碱中和反应酸碱中和反应是酸和碱完全反应产生相应的盐和水的反应。
常见的应用有化学药剂的酸碱中和、钠水玻璃的制备等。

酸碱盐最全知识点总结一、酸的定义和性质1. 酸的定义酸是指在水溶液中产生氢离子(H+)的化合物。
常见的酸包括盐酸、硫酸、硝酸等。
2. 酸的性质(1)酸味:酸的水溶液具有酸味,通常是酸、酸涩的味道。
(2)蓝石蕾试纸:酸能使蓝石蕾试纸变红。
(3)与碱中和:酸与碱发生中和反应,生成盐和水。
(4)与金属反应:酸能与金属反应产生氢气。
(5)酸的导电性:酸的水溶液能够导电。
3. 酸的分类(1)按溶液中氢离子的浓度分为强酸和弱酸,溶液的pH值越小,酸性越强。
(2)按酸的性质分为无机酸和有机酸,无机酸包括盐酸、硫酸等,有机酸包括乙酸、柠檬酸等。
4. 酸的化学反应(1)酸与碱反应:酸与碱中和生成盐和水的反应称为酸碱中和反应。
(2)酸与金属反应:酸与金属反应产生氢气。
(3)酸与碳酸盐反应:酸与碳酸盐反应生成盐、水和二氧化碳。
二、碱的定义和性质1. 碱的定义碱是指在水溶液中产生氢氧离子(OH-)的化合物。
常见的碱包括氢氧化钠、氢氧化钾等。
2. 碱的性质(1)苦碱味:碱的水溶液有苦碱味。
(2)红石蕾试纸:碱能使红石蕾试纸变蓝。
(3)与酸中和:碱与酸发生中和反应,生成盐和水。
(4)碱的导电性:碱的水溶液能够导电。
3. 碱的分类(1)按溶液中氢氧离子浓度分类为强碱和弱碱,溶液的pH值越大,碱性越强。
(2)按碱的性质分为无机碱和有机碱,无机碱包括氢氧化钠、氢氧化钾等,有机碱包括胺类物质。
4. 碱的化学反应(1)碱与酸反应:碱与酸中和生成盐和水的反应称为酸碱中和反应。
(2)碱与氯化氢反应:碱与氯化氢反应生成盐和水。
(3)碱与沉淀酸:碱与含有二价铁离子的酸反应生成沉淀。
三、盐的定义和性质1. 盐的定义盐是由金属离子和非金属离子组成的化合物,通常包括金属离子和酸根离子。
常见的盐包括氯化钠、硫酸钠等。
2. 盐的性质(1)盐味:盐具有咸味。
(2)熔融性:盐在高温下能够熔化成液体状态。
(3)溶解性:大多数盐在水中能够溶解。
(4)晶体性:盐能够形成结晶。
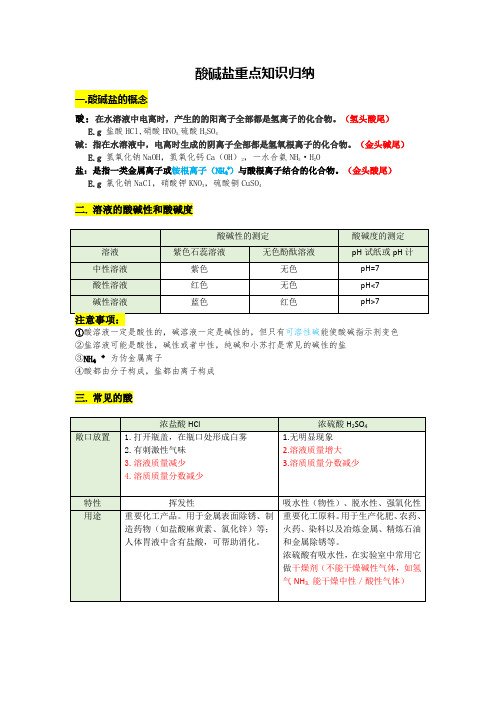
酸碱盐重点知识归纳一.酸碱盐的概念酸:在水溶液中电离时,产生的的阳离子全部都是氢离子的化合物。
(氢头酸尾)E.g 盐酸HCl,硝酸HNO3,硫酸H2SO4碱: 指在水溶液中,电离时生成的阴离子全部都是氢氧根离子的化合物。
(金头碱尾) E.g 氢氧化钠NaOH,氢氧化钙Ca(OH)2,一水合氨NH3·H2O盐:是指一类金属离子或铵根离子(NH₄⁺)与酸根离子结合的化合物。
(金头酸尾)E.g 氯化钠NaCl,硝酸钾KNO3,硫酸铜CuSO4二. 溶液的酸碱性和酸碱度①酸溶液一定是酸性的,碱溶液一定是碱性的,但只有可溶性碱能使酸碱指示剂变色②盐溶液可能是酸性,碱性或者中性,纯碱和小苏打是常见的碱性的盐③NH₄⁺为伪金属离子④酸都由分子构成,盐都由离子构成三. 常见的酸四.常见的碱五.常见的盐六. 常见的化肥★区分方法:七.四大基本反应类型复分解反应是四大基本反应类型之一,中和反应属于复分解反应,但不是基本反应类型。
八.中和反应定义:酸和碱反应生成盐和水的反应。
中和反应为微弱的放热反应。
本质:H++OH -=H2O注意:中和反应一定是复分解反应;复分解反应不一定是中和反应;九.复分解反应定义:两种化合物相互交换成分,生成另外两种化合物的反应。
口诀:碱盐,盐盐均可溶,沉淀气体水生成(产物均为水气沉)有酸需酸溶;无酸需都溶(反应物必须可溶,有酸参与除外)十.酸的化学性质酸的化学性质相似,因为酸溶液中都含有H+①与酸碱指示剂反应:使紫色石蕊变红②酸+活泼金属→盐+H2↑(置换反应)E.g Mg+2HCl=MgCl2+H2↑Mg+H2SO4=MgSO4+H2↑Zn+2HCl=ZnCl2+H2↑Zn+H2SO4=ZnSO4+H2↑Fe+2HCI=FeCl2+H2↑Fe+H2SO4=FeSO4+H2↑③酸+金属氧化物→盐+H2OE.g Fe2O3+6HCl=2FeCl3+H2OFe2O3+3H2SO4=Fe2(SO4)3+3H2O 铁绣逐渐消失,溶液由无色变黄CuO+H2SO4=CuSO4+H2O →黑色固体溶解,无色溶液变蓝④酸+碱→盐+H2O (中和反应)E.g NaOH+HCI=NaCl+H2O⑤酸+盐→新酸+新盐E.g Na2CO3+2HCl=2NaCl+CO2↑+H2O十一.碱的化学性质碱的化学性质相似,因为碱溶液中都含有OH-①与酸碱指示剂反应:使紫色石蕊变蓝,使酚酞变红。

酸碱盐知识点总结一、酸及酸的通性酸的定义,电离时生成的阳离子全部都是H+。
酸是由氢离子和酸根离子构成。
1、浓盐酸、浓硫酸的物理性质、特性、用途2.酸的通性:盐酸 HCl 硫酸 H2SO4酸使紫色石蕊试液变红,使无色酚酞试液不变色。
金属+酸→盐+氢气 Zn+2HCl=ZnCl2+H2↑ Zn+ H2SO4 =ZnSO4+H2↑碱性氧化物+酸→盐+水 Fe2O3+6HCl=2FeCl3+3H2O Fe2O3+3H2SO4=Fe2(SO4)3+3H2O碱+酸→盐+水 NaOH+HCl=NaCl+ H2O Cu(OH)2+H2SO4= CuSO4+2H2O盐+酸→另一种盐+另一种酸 AgNO3+HCl=AgCl↓+HNO3 BaCl2+H2SO4=BaSO4↓ +2HCl注意:(1)在‘金属+酸→盐+氢气’中,酸通常指的是稀硫酸和稀盐酸,不能是浓硫酸或硝酸。
因为浓硫酸或硝酸都有强氧化性,与金属反应时不能生成氢气而生成了水;指在金属活动顺序表中排在‘氢’前面的活泼金属排在‘氢’后不能置换酸中的氢。
(2)通过金属跟酸的反应情况导出金属活动顺序表:K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au金属活动性由强逐渐减弱金属活动性顺序中,金属位置越靠前,活动性越强,反应越剧烈,所需时间越短。
(3)浓硫酸具有吸水性,通常用它作为干燥剂。
硫酸还具有脱水性,它对皮肤或衣服有很强的腐蚀性。
稀释浓硫酸时一定要把浓硫酸沿着器壁慢慢地注入水里,并不断搅动,切不可把水倒进浓硫酸里,如果把水注入浓硫酸里,水的密度较小,会浮在硫酸上面,溶解时放出的热会使水立刻沸腾,使硫酸液向四处飞溅,容易发生事故。
二、碱及碱的通性定义:电离时生成的阴离子全部是OH-离子。
碱是由金属离子(或铵根离子)和氢氧根离子构成。
1、氢氧化钠、氢氧化钙的物理性质、用途2.碱的通性碱使紫色石蕊试液变蓝,使无色酚酞试液变红。
氢氧化钠使紫色石蕊试液变蓝,无色酚酞试液变红。
最全面高中酸碱盐知识点总结
酸碱盐是化学中重要的基础概念之一,下面是一份最全面的高中酸碱盐知识点总结。
1. 酸碱的定义
- 酸是能够产生氢离子(H+)的物质,如HCl。
- 碱是能够产生氢氧离子(OH-)的物质,如NaOH。
2. 酸碱的性质
- 酸呈酸性,能够与碱反应生成盐和水。
- 碱呈碱性,能够与酸反应生成盐和水。
3. pH值
- pH值是衡量酸碱性强弱的指标,范围从0到14。
- pH值小于7表示酸性,大于7表示碱性,等于7表示中性。
4. 盐的性质
- 盐是酸和碱反应生成的产物。
- 盐在水中溶解时会产生离子。
5. 盐的命名规则
- 一般盐的名称由阴离子的名称和阳离子的名称组成,如NaCl。
- 阴离子通常以元素或化合物末端加上“-ide”来命名,如氯化物(chloride)。
- 阳离子通常使用原子符号或名称,如钠(sodium)。
6. 盐的应用和例子
- 氯化钠(NaCl)用作调味品和食盐。
- 碳酸氢钠(NaHCO3)用作发酵剂和抗酸剂。
- 硝酸银(AgNO3)用作消毒剂和药品。
7. 酸碱中和反应
- 酸和碱反应生成盐和水的过程称为中和反应。
- 中和反应是氢离子和氢氧离子结合产生水的过程。
以上是酸碱盐的最全面高中知识点总结,希望对您的学习有所
帮助!。
酸碱盐知识点归纳总结酸碱盐是化学中的重要基础知识,以下是一份关于酸碱盐的知识点归纳总结,供您参考:1. 酸的定义:由氢离子 (H+) 组成的化合物称为酸。
例如,硫酸 (H2SO4)、盐酸 (HCl) 和硝酸 (HNO3) 等。
2. 碱的定义:由氢氧根离子 (OH-) 组成的化合物称为碱。
例如,氢氧化钠(NaOH)、氢氧化钙 (Ca(OH)2) 和氨水 (NH3·H2O) 等。
3. 盐的定义:由金属离子 (或铵根离子) 和酸根离子组成的化合物称为盐。
例如,氯化钠 (NaCl)、碳酸钠 (Na2CO3) 和硫酸钙 (CaSO4) 等。
4. 酸碱盐的通性:酸碱盐在水中溶解度较好,可以导电。
酸碱盐在水溶液中能够反应,并且生成的产物可以是盐、酸或碱。
5. 酸的性质:酸具有酸味,可以与金属离子反应产生氢气,也可以与碱反应生成盐和水。
例如,硫酸与锌反应产生氢气,盐酸与铜反应产生氢气。
6. 碱的性质:碱具有碱性,可以中和酸性物质,也可以与酸反应产生盐和水。
例如,氢氧化钠与硫酸反应产生硫酸钠和水,氢氧化钙与盐酸反应产生氯化钙和水。
7. 盐的性质:盐具有中性,可以中和酸性物质,也可以与碱反应产生盐和水。
例如,氯化钠与硫酸铜反应产生硫酸钠和水。
8. 酸碱盐的相互关系:酸碱盐之间可以相互转化,例如硫酸可以转化为硫酸盐,盐酸可以转化为盐酸盐。
此外,酸碱盐也可以在水中溶解度不同而相互转化。
9. 常见的酸碱盐:常见的酸碱盐包括硫酸、盐酸、硝酸、氢氧化钠、氢氧化钙、氯化钠、碳酸钠、硫酸钙等。
以上是关于酸碱盐的知识点归纳总结,希望对您有所帮助。
如果您有任何其他问题,欢迎随时提问。
初三化学酸碱盐单元复习
一、酸碱盐的定义及组成:
提示:酸、碱、盐的水溶液可以导电(原因:溶于水时离解形成自由移动的)
酸:电离出的阳离子为的化合物(或可理解为:由氢元素和酸根组成的化合物)如:硫酸(H2SO4)、盐酸(HCl)、硝酸(HNO3)
碱:电离出的阴离子为的化合物(或可理解为:由金属元素和氢氧根组成的化合物)如:氢氧化钠、氢氧化钙、氨水(NH3·H2O)
盐:由(或铵根)和组成的化合物如:氯化钠、碳酸钠
联系:电离方程式的书写:
HCl=H++Cl- NaOH=Na++OH- FeSO
4= + NaHSO
4
= + +
二、酸
1、酸的再分类:
1)按照每个酸分子所能电离出的H+个数(初学阶段可简单理解为酸分子中含有的H原子个数)分为:一元酸:每个酸分子能电离出个H+,如HCl、HNO3、HAc(醋酸:CH3COOH)
二元酸:每个酸分子能电离出个H+,如H2SO4、H2SO3、H2CO3、H2S(氢硫酸)
三元酸:每个酸分子能电离出个H+,如H3PO4
2)按照酸分子中是否含有氧元素可分为:
含氧酸:如HNO3、H2SO4、H2SO3、H2CO3、H3PO4
无氧酸:如HCl、H2S
2、酸的通性(即酸的共性!):
(具有通性的原因:酸离解时所生成的阳离子全部是)
(1)与酸碱指示剂的反应:使紫色石蕊试液变色,不能使无色酚酞试液变色
(2)金属 + 酸→H2↑+ 。
举例:
(思考:Cu、Hg能否和酸反应生成H2?
结论:这类反应能够发生的条件是该金属在“金属活动性顺序”中得位置应处于的前面!)(3)碱性氧化物+ 酸→水+ 。
举例:
(提示:某金属氧化物Mn2O7并不能和酸反应生成盐和水。
可见:并非所有的金属氧化物均能和酸反应生成盐和水!
思考:为什么要用“碱性氧化物”而不用“金属氧化物”?)
(4)碱+酸→ + 。
举例:
(联系:课本上是如何证明NaOH和HCl混合时发生了化学反应?)
(5)盐 + 酸→ + 。
举例:
(思考:NaCl +H2SO4→?是不是任何一种酸和盐都能发生反应?盐和酸反应的条件是什么?)
3、“三酸”的比较:
4、如何鉴别浓硫酸和稀硫酸:
1)分析二者性质的差异:
物理性质:
化学性质:
2)思考如何将上述差异通过一定的操作,使之出现明显不同的现象
三、碱
1、碱的再分类:
1)按照每分子碱所能电离出的OH-个数(初学阶段可简单理解为碱化学式中含有的OH原子团个数)分为:一元碱:每个碱“分子”能电离出个OH-,如KOH、NaOH、NH3·H2O
二元碱:每个碱“分子”能电离出个OH-,如Ca(OH)2、Mg(OH)2、Cu(OH)2、Fe(OH)2、Ba(OH)2
三元碱:每个碱“分子”能电离出个OH-,如Al(OH)3、Fe OH)3、
2)按照碱的水溶性可分为:
易溶碱:KOH、Ca(OH)2、NaOH、Ba(OH)2、NH3·H2O
难溶碱:Mg(OH)2、Al(OH)3、 Fe(OH)2、Fe OH)3、Cu(OH)2
2、碱的通性(即碱的共性!):
(具有通性的原因:离解时所生成的阴离子全部是)
(1)碱溶液与酸碱指示剂的反应:使紫色石蕊试液变色,使无色酚酞试液变色
(2)酸性氧化物+碱→ +水。
举例:
(提示:非金属氧化物CO并不能和碱反应生成盐和水。
可见:并非所有的非金属氧化物均能和碱反应生成盐和水!
思考:为什么要用“酸性氧化物”而不用“非金属氧化物”?)
(3)酸+碱→ + 。
举例:
(4)盐+碱→ + 。
举例:
(思考:BaCl2 + NaOH→?是不是任何一种碱和盐都能发生反应?盐和碱反应的条件是什么?)
3、NaOH与Ca(OH)2的比较:
1、盐的再分类:
1)按照所含金属阳离子的不同可分为: 2)按照所含酸根离子的不同可分为:钾盐:如盐酸盐钙盐:如硫酸盐钠盐:如硝酸盐
钡盐:如碳酸盐
……
2)特殊的盐:
酸式盐:
碱式盐:
2、盐的性质:
(1)酸+盐→ + 。
(2)碱+盐→ + 。
(3)盐+盐→ + 。
举例:
(思考:KCl+NaNO3→?是不是任何一种盐和盐都能发生反应?盐和盐反应的条件是什么?)
(4)金属+盐→ + 。
举例:
(思考:Cu能否和FeSO4溶液反应,置换出其中的Fe?
结论:这类反应能够发生的条件是在“金属活动性顺序”中位置靠的金属可以把靠的金属从它的盐溶液中置换出来!)
五、复分解反应与中和反应
碱+酸→盐 + 水。
(反应!)
酸+盐→ + 。
碱+盐→ + 。
盐+盐→ + 。
1、纵观上述四种反应,均符合下列通式:AB+CD=AC+BD,将这类反应称作。
其中,酸和碱反应生成盐和水的反应叫做反应。
2、回顾前面对上述后三种反应的复习,均提到了反应条件的问题。
通过学习,我们知道:
复分解反应发生的条件是:。
3、联系:初中化学中常见的难溶物(沉淀):
碱:Mg(OH)2、Al(OH)3、 Fe(OH)2、Fe OH)3( 色)、Cu(OH)2( 色)
盐:AgCl、BaSO4、Ag2SO4、CaCO3、BaCO3、
4
六、酸性氧化物与碱性氧化物
课本上我们学习了“1酸可以和金属氧化物反应生成盐和水”以及“2碱可以和非金属氧化物反应生成盐和水”。
然而通过上述复习,我们知道:“1并非所有的金属氧化物均能和酸反应生成盐和水!2并非所有的非金属氧化物均能和碱反应生成盐和水!”
因此,我们将“能与酸反应生成盐和水的氧化物”叫做——碱性氧化物;把“能与碱反应生成盐和水的氧化物”叫做酸性氧化物。
另附图示如下:
七、溶液酸碱性及其表示(pH)
1、对溶液酸碱性的初步认识:
注意:(1)酸的溶液肯定显性,碱的溶液肯定显性。
(2)显酸性的溶液,其溶质是酸,如NaHSO4;显碱性的溶液,其溶质是碱,如Na2CO3 2、溶液酸碱度的表示法——pH
(1)0 7 14
酸性增强中性碱性增强
(2)溶液酸碱性与溶液浓度的关系:
(3)pH的测定:最简单的方法是使用pH试纸
用玻璃棒(或滴管)蘸取待测试液少许,滴在pH试纸上,
显色后与标准比色卡对照,读出溶液的pH(读数为整数)
(4)酸雨:正常雨水的pH约为5.6(因为溶有CO2)pH<5.6的雨水为酸雨。