2019年高考化学 考点70 沉淀溶解平衡曲线必刷题
- 格式:doc
- 大小:1023.00 KB
- 文档页数:17

考点七十沉淀溶解平衡曲线1.t℃时,AgX(X=C1、Br)的溶度积与c(Ag+)和c(X-)的相互关系如下图所示,其中A线表示AgC1,B线表示AgBr,已知p(Ag+)=-lgc(Ag+),p(X-)=-lgc(X-)。
下列说法正确的是A. c点可表示AgC1的不饱和溶液B. b点的AgC1溶液加入AgNO3晶体可以变成a点C.t℃时,AgC1(s)+Br-(aq)AgBr(s)+C1-(aq)平衡常数K=10-4D.t℃时,取a点的AgC1溶液和b点AgBr溶液等体积混合,会析出AgBr沉淀【答案】D2.一定温度下,三种碳酸盐MCO3(M: Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。
下列说法正确的是已知pM=-lgc(M),p(CO32-)=-lgc(CO32-)。
A. MgCO3、CaCO3、MnCO3的Ksp依次增大B. a点可表示MnCO3的饱和溶液,且c(Mn2+)= c(CO32-)C. b点可表示CaCO3的饱和溶液,且c(Ca2+)< c(CO32-)D. c点可表示MgCO3的过饱和溶液,且c(Mg2+)< c(CO32-)【答案】B3.某温度时,AgCl的溶解平衡曲线如图所示。
已知pAg=-lg c(Ag+)、pCl=-lg c(Cl-),利用pCl、pAg的坐标系可表示出AgCl的溶度积与溶液中c(Ag+)和c(Cl-)的相互关系。
下列说法错误的是A. A线、B线、C线对应的温度关系:A>B>CB. A线对应温度下,AgCl的K sp=1×10-10C. B线对应温度下,p点形成的溶液是AgCl的不饱和溶液D. C线对应温度下,n点表示KCl与过量的AgNO3反应产生AgCl沉淀【答案】C4.一定温度下,金属硫化物的沉淀溶解平衡曲线如图所示。
纵坐标p(M n+)表示-lg c(M n+),横坐标p(S2-)表示-lg c(S2-),下列说法不正确的是( )A.该温度下,Ag2S的K sp=1.6×10-49B.该温度下,溶解度的大小顺序为NiS>SnSC. SnS和NiS的饱和溶液中=104D.向含有等物质的量浓度的Ag+、Ni2+、Sn2+溶液中加入饱和Na2S溶液,析出沉淀的先后顺序为Ag2S、SnS、NiS 【答案】C【解析】A.由a(30,10-lg 4)可知,当c(S2-)=10-30mol·L-1时,c(Ag+)=10-(10-lg 4)mol·L-1,K sp(Ag2S)=c2(Ag+)·c(S2-)=[10-(10-lg 4)]2×10-30= 1.6×10-49,A项正确;B.观察SnS、NiS的沉淀溶解平衡曲线可以看出,当两条曲线中c(S2-)相同时,c(Ni2+)>c(Sn2+),由于SnS和NiS沉淀类型相同,所以溶解度的大小顺序为NiS>SnS ,B项正确;C.SnS和NiS的饱和溶液中===10-4,C项错误;D.假设Ag+、Ni2+、Sn2+均为0.1 mol·L-1,分别生成Agc(S2-)分别为1.6×10-47、10-20、10-24,因此生成2S、NiS、SnS沉淀时,需要沉淀的先后顺序为Ag2S、SnS、NiS,D项正确。

专题22《沉淀溶解平衡》专练一、高考真题再现1、(2018年全国卷III-12)用0.100 mol·L -1AgNO 3滴定50.0 mL 0.050 0 mol·L -1Cl-溶液的滴定曲线如图所示。
下列有关描述错误的是( )A .根据曲线数据计算可知K sp (AgCl)的数量级为10-10B .曲线上各点的溶液满足关系式c (Ag +)·c (Cl -)=K sp (AgCl) C .相同实验条件下,若改为0.040 0 mol·L -1Cl -,反应终点c 移到a D .相同实验条件下,若改为0.050 0 mol·L -1Br -,反应终点c 向b 方向移动 2、(2018年江苏卷-7)下列指定反应的离子方程式正确的是( ) A .饱和Na 2CO 3溶液与CaSO 4固体反应:CO 2-3+CaSO 43+SO 2-4B .酸化NaIO 3和NaI 的混合溶液:I -+IO -3+6H +===I 2+3H 2OC .KClO 碱性溶液与Fe(OH)3反应:3ClO -+2Fe(OH)3===2FeO 2-4+3Cl -+4H ++H 2OD .电解饱和食盐水:2Cl -+2H +=====通电Cl 2↑+H 2↑3、(2018年天津卷-4)由下列实验及现象推出的相应结论正确的是( )4、(2017年全国卷-13)由下列实验及现象不能推出相应结论的是( )5、(2017年全国卷III -13.在湿法炼锌的电解循环溶液中,较高浓度的Cl -会腐蚀阳极板而增大电解能耗。
可向溶液中同时加入Cu 和CuSO 4,生成CuCl 沉淀从而除去Cl -。
根据溶液中平衡时相关离子浓度的关系图,下列说法错误的是( )A .K sp (CuCl)的数量级为10-7B .除Cl -反应为Cu +Cu 2++2Cl -===2CuCl C .加入Cu 越多,Cu +浓度越高,除Cl -效果越好 D .2Cu +===Cu 2++Cu 平衡常数很大,反应趋于完全6、(2016年全国卷II -27-(3))元素铬(Cr)在溶液中主要以Cr 3+(蓝紫色)、Cr(OH)-4(绿色)、Cr 2O 2-7(橙红色)、CrO 2-4(黄色)等形式存在,Cr(OH)3为难溶于水的灰蓝色固体,回答下列问题:在化学分析中采用K 2CrO 4为指示剂,以AgNO 3标准溶液滴定溶液中Cl -,利用Ag +与CrO 2-4生成砖红色沉淀,指示到达滴定终点。
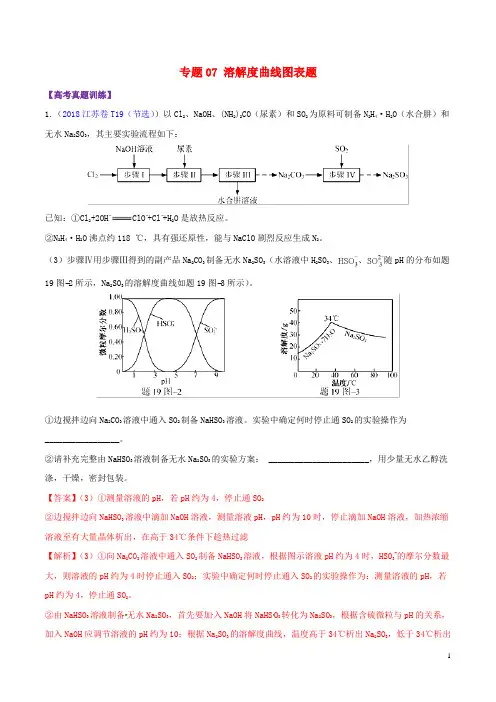
专题07 溶解度曲线图表题【高考真题训练】1.(2018江苏卷T19(节选))以Cl2、NaOH、(NH2)2CO(尿素)和SO2为原料可制备N2H4·H2O(水合肼)和无水Na2SO3,其主要实验流程如下:已知:①Cl 2+2OH−ClO−+Cl−+H2O是放热反应。
②N2H4·H2O沸点约118 ℃,具有强还原性,能与NaClO剧烈反应生成N2。
(3)步骤Ⅳ用步骤Ⅲ得到的副产品Na2CO3制备无水Na2SO3(水溶液中H2SO3、、随pH的分布如题19图−2所示,Na2SO3的溶解度曲线如题19图−3所示)。
①边搅拌边向Na2CO3溶液中通入SO2制备NaHSO3溶液。
实验中确定何时停止通SO2的实验操作为_________________。
②请补充完整由NaHSO3溶液制备无水Na2SO3的实验方案: _______________________,用少量无水乙醇洗涤,干燥,密封包装。
【答案】(3)①测量溶液的pH,若pH约为4,停止通SO2②边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于34℃条件下趁热过滤【解析】(3)①向Na2CO3溶液中通入SO2制备NaHSO3溶液,根据图示溶液pH约为4时,HSO3-的摩尔分数最大,则溶液的pH约为4时停止通入SO2;实验中确定何时停止通入SO2的实验操作为:测量溶液的pH,若pH约为4,停止通SO2。
②由NaHSO3溶液制备无水Na2SO3,首先要加入NaOH将NaHS O3转化为Na2SO3,根据含硫微粒与pH的关系,加入NaOH应调节溶液的pH约为10;根据Na2SO3的溶解度曲线,温度高于34℃析出Na2SO3,低于34℃析出Na2SO3·7H2O,所以从Na2SO3溶液中获得无水Na2SO3应控制温度高于34℃。
由NaHSO3溶液制备无水Na2SO3的实验方案为:边搅拌边向NaHSO3溶液中滴加NaOH溶液,测量溶液pH,pH约为10时,停止滴加NaOH溶液,加热浓缩溶液至有大量晶体析出,在高于34℃条件下趁热过滤,用少量无水乙醇洗涤,干燥,密封包装。

2019年秋高三化学复习强化练习题——沉淀溶解平衡的曲线分析1 / 182019年年年年年年年年年年年年——年年年年年年年年年年年1. 下列图示与对应的叙述相符的是( )A. 如图表示H 2与O 2发生反应过程中的能量变化,则H 2的燃烧热为241.8kJ ⋅mol −1B. 如图表示压强对可逆反应2A(g)+2 B(g)⇌3C(g)+D(s)的影响,乙的压强比甲的压强大C. 根据如图,若除去CuSO 4溶液中的Fe 3+,可向溶液中加入适量CuO ,调节pH =4,过滤D. 如图表示常温下,稀释HA 、HB 两种酸的稀溶液时,溶液pH 随加水量的变化,则相同条件下NaA 溶液的pH 大于同浓度的NaB 溶液的pH2. 已知:图甲是由某温度下Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液pH ,金属阳离子浓度的变化图.图乙是常温下向100mL 0.1mol ⋅L −1HA 溶液中逐滴加入0.2mol ⋅L −1KOH 溶液,混合溶液的pH 变化图.如图所示与推测的结论相符的是( )A. 由图甲知:K sp [Fe(OH)3]<K sp [Cu(OH)2]B. 由图甲知:a 、b 点溶液中K w ,b 点的大C.由图乙知:HA 为强酸D. 由图乙知:Y 点对应的溶液中c(K +)>c(A −)>c(OH −)3.某温度下,向10mL0.1mol/LCuCl 2溶液中滴加0.1mol/L的Na2S溶液,滴加过程中溶液中−lgc(Cu2+)与Na2S溶液体积(V)的关系如图所示,已知:lg2=0.3,Ksp(ZnS)=3×10−25mol2/L2。
下列有关说法正确的是()A. a、b、c三点中,水的电离程度最大的为b点B. Na2S溶液中:c(S2−)+c(HS−)+c(H2S)=2c(Na+)C. 向100mL Zn2+、Cu2+浓度均为10−5mol⋅L−1的混合溶液中逐滴加入10−4mol⋅L−1的Na2S溶液,Zn2+先沉淀D. 该温度下Ksp(CuS)=4×10−36mol2/L24.下列图示与对应的叙述相符的是()A. 图甲表示H2与O2发生反应过程中的能量变化,则H2的燃烧热为483.6kJ⋅mol−1B. 图乙表示在饱和Na2CO3溶液中逐步加BaSO4固体后,溶液中c(CO32−)的浓度变化C. 图丙表示Zn、Cu和稀硫酸构成的原电池在工作过程中电流强度的变化,T时加入了H2O2D. 图丁表示恒温恒容条件下发生的可逆反应2NO2⇌N202(g)中,各物质的浓度与其消耗速率之间的关系,其中交点A对应的状态为化学平衡状态5.下列说法中不正确的是()A. 浓度均为0.1mol⋅L−1的小苏打溶液与烧碱溶液等体积混合:c(Na+)+c(H+)=2c(CO32−)+c(OH−)+c(HCO3−)B. pH相同的盐酸和硫酸,分别用蒸馏水稀释至原体积的m倍和n倍,稀释后两溶液pH相等,则m>nC. 常温下,0.1mol⋅L−1某一元酸HA在水中有0.1%发生电离,则该温度下HA的电离常数约为10−7D. 某温度下,Fe(OH)3,Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液的pH,金属阳离子浓度的变化如图.由图可知:Ksp[Fe(OH)3]< K[Cu(OH)2]6.向MgCl2和AlCl3的混合溶液中加入氢氧化钠溶液,所得沉淀的物质的量(n)与加入氢氧化钠溶液的体积(V)关系如图所示.则下列说法正确的是()2019年秋高三化学复习强化练习题——沉淀溶解平衡的曲线分析3 / 18A. ab 之间、c 两点沉淀物成分相同,d 、e 两点沉淀物成分相同B. 在反应过程中,各状态点溶液的pH 大小顺序是:e >d >c >a >bC. b −c 段与c −d 段溶液中阴离子的物质的量相等D. 在d 点,向溶液中逐滴加入盐酸,沉淀量将减少7. 如图所示与对应叙述相符的是( )A. 用硝酸银溶液滴定等浓度的A −、B −、C −的混合溶液(均可以与Ag +反应生成沉淀),由图可确定首先沉淀的是C −B. 图表示反应中某反应物的正、逆反应速率随温度变化情况,由图可知该反应的正反应是吸热反应C. 一定条件下,X 和Y 反应生成Z ,由图1推出该反应的方程式可表示为:X +3Y ⇌ZD. 图表示溶液中反应:I 2+I −⇌I 3− 平衡c(I 3−)随温度变化,反应速度V(正)M <V(逆)N8.Hg是水体污染的重金属元素之一。

高中化学沉淀溶解平衡的测试题和答案【导语】在学完知识点后学生需要多做题来复习和检验自己是否掌握知识点,下面xx将为大家带来关于沉淀溶解平衡的测试题的介绍,希望能够帮助到大家。
高中化学沉淀溶解平衡的测试题1.在100mL0.10mol L-1的AgNO3溶液中加入100mL溶有2.08gBaCl2的溶液,再加入100mL溶有0.010molCuSO4 5H2O的溶液,充分反应。
下列说法中正确的是()A.最终得到白色沉淀和无色溶液B.最终得到的白色沉淀是等物质的量的两种化合物的混合物C.最终得到的溶液中,Cl-的物质的量为0.02molD.在最终得到的溶液中,Cu2+的物质的量浓度为0.01mol L-1解析:此题为一计算推断题。
经计算AgNO3、BaCl2、CuSO4 5H2O三种物质的物质的量都为0.01mol,反应生成的AgCl和BaSO4各为0.01mol,溶液中剩余的是0.01mol、0.01molCl-和0.01molCu2+,所以溶液应呈蓝色,故A、C是错误的,三种溶液混合后溶液的体积增大两倍,Cu2+的物质的量浓度为0.033mol L-1。
答案:B2.一定温度下,在氢氧化钡的悬浊液中,存在氢氧化钡固体与其电离的离子间的溶解平衡关系:Ba(OH)2(固体)Ba2++2OH-。
向此种悬浊液中加入少量的氢氧化钡粉末,下列叙述正确的是()A.溶液中钡离子数目减小B.溶液中钡离子浓度减小C.溶液中氢氧根离子浓度增大D.pH减小解析:氢氧化钡悬浊液中存在氢氧化钡的固体和氢氧化钡饱和溶液的溶解平衡,即氢氧化钡的固体溶解到溶液中电离生成钡离子和氢氧根离子,溶液中的钡离子和氢氧根离子结合,沉淀出氢氧化钡的固体,再加入少量的氢氧化钡粉末,由于溶液中固体不存在浓度问题,平衡没有发生移动。
可是选项中所描述的量都发生变化,与结论相矛盾。
是否从该体系的另一方面分析,水的量发生变化考虑?由于加入的氢氧化钡粉末在水中转化为结晶水合物,消耗了一定量的水,平衡发生移动。

专题08 沉淀溶解平衡图表题【19年高考命题前瞻】难溶电解质的溶解平衡试题是这几年高考化学中的重点知识,如2018课标全国Ⅲ12、2018江苏卷13、2017课标全国Ⅰ27;2017课标全国Ⅱ12、13;2017课标全国Ⅲ13;2016课标全国Ⅲ13;2015课标全国Ⅰ10、28;2015课标全国Ⅱ26,主要考查外界因素对沉淀溶解平衡的影响、沉淀转化、结合图像进行有关溶度积K sp的计算,注意K sp只与温度有关,完全沉淀一般隐含了离子浓度为1×10-5mol/L。
考查方式不只局限在计算上,还会结合难溶电解质溶解平衡曲线图考查温度对物质溶解速率的影响以及K sp、重结晶等知识,同时还倒结合溶解度曲线进行考查,可以以选择题形式考查,也可以结合非选择题原理题或工艺流程题考查,虽然考查形式发生变化,但难度适中,K sp与离子浓度的关系及其对应计算已经成为高考热点,预计2019年高考仍然会以这种考查方式出现。
【名师精讲】1、难溶电解质的溶解平衡试题的考查特点:近几年的高考对难溶电解质的溶解平衡的考查一直较热,主要考查要点有三个:一是考查溶解平衡的移动;二是结合图象,考查溶度积的应用及其影响因素;三是沉淀反应在生产、科研、环保中的应用。
2.溶解平衡图象中信息的提取:(1)溶解平衡曲线类似于溶解度曲线,曲线上任一点都表示饱和溶液,曲线上方的任一点均表示过饱和,此时有沉淀析出,曲线下方的任一点,均表示不饱和。
(2)从图像中找到数据,根据Ksp 公式计算得出Ksp(3)比较溶液的Q与Ksp 的大小,判断溶液中有无沉淀析出。
(4)涉及Q 的计算时,所代入的离子浓度一定是混合溶液中的离子浓度,因此计算离子浓度时,所代入的溶液体积也必须是混合液的体积。
3.难溶电解质的溶解平衡类图像题解题思路是:首先要认识图像横坐标、纵坐标表示什么,如表示离子浓度、pM等;曲线上的点表示达到平衡状态,曲线上方的点代表“过饱和溶液”,曲线下方的点代表“不饱和溶液”。


解密13 沉淀溶解平衡考点1 影响沉淀溶解平衡的因素 1.沉淀溶解平衡的外界影响因素以AgCl(s)垐?噲?Ag +(aq)+Cl -(aq) ΔH >0为例:2.运用沉淀溶解平衡解决的实际问题(1)沉淀生成的方法在涉及无机制备、提纯工艺的生产、科研、废水处理等领域中,常利用生成沉淀来达到分离或除去某些离子的目的。
①调节pH:如工业原料氯化铵中含杂质氯化铁,使其溶于水,再加入氨水调节pH至7~8,可使Fe3+转化为Fe(OH)3沉淀而除去。
②加沉淀剂法:如以Na2S、H2S等作沉淀剂,使某些金属离子如Cu2+、Hg2+等生成极难溶的硫化物CuS、HgS 除去,是分离、除杂常用的方法。
(2)沉淀的溶解①转化生成弱电解质S(g),其实质是H+消耗S2-生成了H2S。
实验室用CaCO3和HCl生成弱酸:FeS(s)+2H+(aq)Fe2+(aq)+H反应制备CO2也是此原理。
生成水:Mg(OH)2(s)+2H+(aq)Mg2+(aq)+2H2O(l)。
②发生氧化还原反应如CuS不溶于HCl但却溶于硝酸,这是因为:3CuS+8HNO3===3Cu(NO3)2+3S+2NO↑+4H2O③生成难离解的配合物离子AgCl+2NH 3[Ag(NH3)2]++Cl-S O [Ag(S2O3)2]3-+Br-(用于照相技术)AgBr+22(3)沉淀的转化①由难溶的沉淀转化为较难溶的沉淀是比较容易实现的一种转化。
如在PbI 2悬浊液中,加入AgNO3溶液后,PbI2(s)+2Ag+(aq)2AgI(s)+Pb2+(aq),K转=>>1,所以只要较低物质的量浓度的Ag+即可消耗I-,从而使PbI 2不断溶解,最终完全转化为更难溶的沉淀AgI 。
②由难溶的沉淀转化为较易溶的沉淀是比较难以实现的一种转化,前提是“两种沉淀的溶解度相差不是很大”。
如虽然Ksp (BaSO 4)<K sp (BaCO 3),但两者差异不大,BaSO 4(s)+23CO -(aq)BaCO 3(s)+ 24SO -(aq),K 转=<1,只要加入足量的饱和Na 2CO 3溶液,BaSO 4就可能转化为BaCO 3,而BaCO 3是可用酸溶解的。

考点六十九难溶电解质的溶解平衡1.已知25℃时,电离常数K a(HF)=3.6×10-4,溶度积常数K sp(CaF2)=1.46×10-10。
现向1L 0.2mol·L -1 HF溶液中加入1L 0.2mol·L-1 CaCl2溶液,则下列说法正确的是A.25℃时,0.1mol·L-1 HF溶液的pH=1B. K sp(CaF2)随温度和浓度的变化而变化C.该体系中没有沉淀产生D.该体系中HF与CaCl2反应产生沉淀【答案】D2.已知悬浊液中存在平衡:Ca(OH)2(s)⇌Ca2+(aq)+2OH-(aq)△H<0,下列有关该平衡体系的说法正确的是①升高温度,平衡逆向移动②温度一定时,溶液中c(Ca2+)•c2(OH-)为定值③向溶液中加入少量碳酸钠粉末能增大c(Ca2+)④恒温下,向饱和溶液中加入CaO,溶液的pH升高⑤给溶液加热,溶液的pH升高⑥向溶液中加入少量NaOH固体,Ca(OH)2固体质量不变。
⑦向溶液中加入Na2CO3溶液,其中固体质量增加.A.①②⑦ B.①②⑦⑧ C.③④⑤⑦ D.①③⑦⑧【答案】A【解析】①已知反应的△H<0,所以该反应为放热反应,升高温度,平衡逆向移动,故①正确;②溶度积Ksp只跟温度有关,温度一定时,溶液中c(Ca2+)•c2(OH-)为定值,故②正确;③加入碳酸钠粉末会生成CaCO3,使Ca2+浓度减小,故③错误;④恒温下Ksp不变,加入CaO后,溶液仍为Ca(OH)2的饱和溶液,pH不变,故④错误;⑤加热,Ca(OH)2的溶解度减小,溶液的pH降低,故⑤错误;⑥加入NaOH固体平衡向左移动,Ca(OH)2固体质量增加,故⑥错误;⑦加入Na2CO3溶液,沉淀溶解平衡向右移动,Ca(OH)2固体转化为CaCO3固体,固体质量增加,故⑦正确。
所以正确的只有①②⑦,故选A。
3.某温度下,Fe(OH)3(s)、Cu(OH)2(s)分别在溶液中达到沉淀溶解平衡后,改变溶液 pH,金属阳离子浓度的变化如图所示.据图分析,则下列判断错误的是A. Ksp〔Fe(OH)3〕<Ksp〔Cu(OH)2〕B.加适量浓NH3·H2O可使溶液由a 点变到b点C. c、d两点代表的溶液中c(H+)与c(OH-)乘积不相等D. Fe(OH)3在d点代表的溶液过饱和【答案】C4.25℃时,已知AgCl的K sp=1.8×10-10,Ag2CO3在水中的沉淀溶解平衡曲线如图所示,下列说法错误的是A. Ag2CO3的K sp为8.1×10-12B. Ag2CO3(s)+2Cl-(aq)⇌2AgCl(s)+CO32-(aq)的平衡常数K=2.5×108C.在Ag2CO3的饱和溶液中加入K2CO3(s)可使c(CO32-)增大(由Y点到Z点)D.在0.001mol•L-1AgNO3溶液中滴入同浓度的KCl和K2CO3的混合溶液,CO32-先沉淀【答案】D5.下表是五种银盐的溶度积常数(25°C),下列说法错误的是A.用硝酸银溶液测定Cl-含量时,可以用硫化钠做指示剂B.将氯化银溶解于水后,向其中加入Na2S固体,则可以生成黑色沉淀C.氯化银、溴化银和碘化银三种物质在常温下的溶解度随着氯、溴、碘的顺序减小D.沉淀溶解平衡的建立是有条件的,外界条件改变时,平衡可能会发生移动【答案】A【解析】A. 由于硫化银的溶度积比氯化银小,所以用硝酸银溶液测定Cl-含量时,不能用硫化钠做指示剂,应该用铬酸钾作指示剂,所以A选项是错误的;B.Ag2S溶度积远小于AgCl,Ag2S难溶于水,在AgCl的饱和溶液中加入Na2S,则可以生成黑色的Ag2S沉淀,所以B选项是正确的;C.结构相似的难溶性盐,溶度积越小,溶解度越小,由表格中的数据可以知道AgCl、AgBr、AgI的溶解度依次减小,所以对于氯化银、溴化银和碘化银三种物质在常温下的溶解度随着氯、溴、碘的顺序减小,所以C选项是正确的;D.难溶电解质的溶解平衡是一定条件下的动态平衡,当条件改变,平衡要发生移动,所以D选项是正确的。

积淀溶解均衡练习一一、选择题1. 以下说法中正确的选项是()A 、物质的溶解性犯难溶,则该物质不溶于水B 、不溶于水的物质溶解度为C 、绝对不溶解的物质是不存在的D 、某粒子被积淀完整部是指该粒子在溶液中的浓度为零2. 以下对积淀溶解均衡的描绘正确的选项是()A 、溶解开始时,溶液中各离子浓度相等。
B 、积淀溶解均衡达到均衡时,积淀的速率和溶解的速率相等C 、积淀溶解均衡达到均衡时,溶液中溶质的离子浓度相等,且保持不变。
D 、积淀溶解均衡达到均衡时,假如再加入难溶性的该积淀物,将促使溶解。
3.(双选 )有关 AgCl 积淀的溶解均衡,正确的说法是()A. 当 AgC 积淀溶解达到均衡时,往溶液中投入AgCl 固体,溶液中 Ag +和 Cl -的浓度增大B. 当溶液中有 AgCl 积淀时,增添水的量 ,溶液中 Ag + 和 Cl- 的数量都增大但浓度都减少C.高升温度 ,AgCl 积淀的溶解度增大D.向 AgCl 积淀中加入 NaCl 固体 ,其溶解度不变 4.(双选 )Mg(OH) 2 固体在水中达到溶解均衡:Mg(OH) 2(s)Mg 2+(aq) + 2OH -(aq) 时,为使 Mg(OH) 2 固体的量减少,需加入少许的( )A.NH 4NO 3C.MgSO 4D.NaHSO 45.石灰乳中存在以下均衡: Ca(OH) 2(s)Ca 2+(aq)+2OH ― (aq), 加入以下溶液,可使 Ca(OH) 2 固体增加的是( )A. Na CO 3 溶液B. AlCl 3溶液C. 水D. CaCl 2溶液24.必定温度下,在氢氧化钡的悬浊液中,存在氢氧化钡固体与其余电离的离子间的溶解均衡关系:Ba(OH) 2(s)Ba 2++ 2OH -。
向此种悬浊液中加入少许的氢氧化钡粉末,以下表达正确的选项是A .溶液中钡离子数量减小B .溶液中钡离子浓度减少C .溶液中氢氧根离子浓度增大D .PH 减小6.为除掉 MgCl 2 酸性溶液中的 Fe 3+,可在加热搅拌的条件下, 加入一种试剂后过滤, 这试剂不能够是: ( )A . NH 3· H 2OB . MgOC .Mg(OH) 2D . MgCO 37.试验室中,要使 AlCl 3 溶液中的 Al 3+所有积淀出来,最适合采纳的试剂是 ( )A. Ba(OH) 2 溶液 B . NaOH 溶液 C. 盐酸 D. 氨水9.写出难溶电解质 2 3 4 2 2 的溶解均衡表达式或溶度积表达式错误的选项是()PbCl 、 AgBr 、 Ba (PO ) 、 Ag S2Pb 2++2Cl —;Ksp==c(Pb 2+2—)A . PbCl (s)) ·c(ClB . AgBr(s)Ag + +Br —;Ksp==c(Ag +) ·c(Br —)C . Ba 3(PO 4) 2(s)3Ba 2+3—3 (Ba 2+ 2 3— )+2PO 4 ; Ksp==c ) ·c(PO 4D . Ag 2S(s)2Ag ++S 2—;Ksp==c(Ag +) ·c(S 2—)10、以下表达中,正确的选项是()A. 溶度积大的化合物溶解度必定大B. 向含有 AgCl 固体的 溶液中加入适当的水使AgCl 溶解又达到均衡时, AgCl 的溶度积不变,其溶解度也不变C.将难溶电解质放入纯水中,溶解达到均衡时,电解质离子的浓度的乘积就是该物质的溶度积D.AgCl 水溶液的导电性很弱,因此 AgCl 为弱电解质11.已知常温下 BaSO 4 的溶解度为2.33 ×10 -4 g ,近似于水的离子积,难溶盐 m n也有离子积 KspA B且 Ksp =〔 C ( A n+ )〕 m ·〔 C ( B m- )〕 n ,则其 Ksp 为()-B . 1×10 -C . 1×10 - -A . 2.33 ×10 4510D . 1×10 1212、已知 K sp (AgCl)=1.56 10×-10,K sp10×-13,K sp (Ag 2 CrO 4)=9.0 10×-12。

1
11月16日 沉淀溶解平衡曲线及应用
高考频度:★★★★☆ 难易程度:★★★☆☆
在t ℃时,AgBr 在水中的沉淀溶解平衡曲线如图所示。
又知t ℃时AgCl 的K sp =4×10
-10,下列说法不正
确的是
A .在t ℃时,AgBr 的K sp 为4.9×l0-13
B .在AgBr 饱和溶液中加入NaBr 固体,可使溶液由c 点到b 点
C .图中a 点对应的是t ℃ AgBr 的不饱和溶液
D .在t ℃时,AgCl(s)+Br -(aq)AgBr(s)+Cl - (aq)的平衡常数K ≈816
【参考答案】
B
沉淀溶解平衡图像题的解题模板
沉淀溶解平衡图像与化学平衡图像一样,都是利用化学平衡移动原理来解决问题。
但沉淀溶解平衡图像更为复杂,也是学习中的难点和易错点,现将解题方法解析如下。
第一步:观察纵、横坐标表示的是何变量。
第二步:观察坐标中点、线段的变化及含义。
第三步:利用K sp 进行相应换算、推断,根据沉淀溶解平衡原理分析曲线变化。
学科&网。
第四节沉淀溶解平衡A级必备知识基础练1.对“AgCl(s)Ag+(aq)+Cl-(aq)”的理解正确的是()A.说明AgCl没有完全电离,AgCl是弱电解质B.说明溶解的AgCl已完全电离,是强电解质C.说明Ag+与Cl-反应不能完全进行到底D.说明Ag+与Cl-反应可以完全进行到底2.在一定温度下,当Mg(OH)2固体在水溶液中达到下列平衡时:Mg(OH)2(s)Mg2+(aq)+2OH-(aq),要使Mg(OH)2固体减少而c(Mg2+)不变,可采取的措施是()A.加MgSO4固体B.加HCl溶液C.加NaOH固体D.加少量水3.一定温度下,将足量的AgCl分别放入下列物质中,AgCl的溶解度由大到小的顺序是()①20mL0.01mol·L-1KCl溶液②30mL0.02mol·L-1CaCl2溶液③40mL0.03mol·L-1HCl溶液④10mL蒸馏水⑤50mL0.05mol·L-1AgNO3溶液A.①>②>③>④>⑤B.④>①>③>②>⑤C.⑤>④>②>①>③D.④>③>⑤>②>①4.下列说法正确的是()A.含有AgCl和AgI固体的悬浊液中c(Ag+)>c(Cl-)=c(I-)B.25℃时,Cu(OH)2在水中的溶解度大于在Cu(NO3)2溶液中的溶解度C.在含有BaSO4沉淀的溶液中加入Na2SO4固体,c(Ba2+)增大D.25℃时,AgCl在同浓度的CaCl2和NaCl溶液中的溶解度相同5.已知在某温度时一些难溶物质的溶度积常数如下:根据上表数据,判断该温度时下列化学方程式不正确的是()A.2AgCl+Na2S2NaCl+Ag2SB.MgCO3+H2O Mg(OH)2+CO2↑C.ZnS+2H2O Zn(OH)2↓+H2S↑D.Mg(HCO3)2+2Ca(OH)2Mg(OH)2↓+2CaCO3↓+2H2O6.要使工业废水中的重金属Pb2+沉淀,可用硫酸盐、碳酸盐、硫化物等作沉淀剂,已知Pb2+与这些离子形成的化合物的溶解度如下:由上述数据可知,选用的沉淀剂最好为()A.硫化物B.硫酸盐C.碳酸盐D.以上沉淀剂均可7.已知:25℃时,K sp(BaSO4)=1.1×10-10,K sp(BaCO3)=2.6×10-9。
畅享淘宝天猫京东拼多多百万张大额内部优惠券,先领券后购物!手机应用市场/应用宝下载花生日记APP 邀请码NJBHKZO ,高佣联盟官方正版APP 邀请码2548643主题23:沉淀溶解平衡命题一 沉淀溶解平衡图像1.(2017年全国Ⅲ卷,13)在湿法炼锌的电解循环溶液中,较高浓度的Cl -会腐蚀阳极板而增大电解能耗。
可向溶液中同时加入Cu 和CuSO 4,生成CuCl 沉淀从而除去Cl -。
根据溶液中平衡时相关离子浓度的关系图,下列说法错误..的是( )。
A.K sp (CuCl )的数量级为10-7B.除Cl -反应为Cu+Cu 2++2Cl -2CuClC.加入Cu 越多,Cu +浓度越高,除Cl -效果越好D.2Cu +Cu 2++Cu 平衡常数很大,反应趋于完全【解析】当-lgc(Cl -)mol ·L-1=0时,lgc(Cu +)mol ·L-1约为-7,即c (Cl -)=1 mol ·L -1,c (Cu +)=10-7mol ·L -1,因此K sp (CuCl )的数量级为10-7,A 项正确;分析生成物CuCl 的化合价可知,Cl 元素的化合价没有发生变化,Cu 元素由0价和+2价均变为+1价,因此参加该反应的微粒为Cu 、Cu 2+和Cl -,生成物为CuCl ,则该反应的离子方程式为Cu+Cu 2++2Cl-2CuCl ,B 项正确;铜为固体,只要满足反应用量,Cu 的量对除Cl -效果无影响,C 项错误;反应2Cu+Cu 2++Cu的平衡常数K = c(Cu 2+)c 2(Cu +),可取图像中的c (Cu +)=c (Cu 2+)=1×10-6 mol ·L -1代入平衡常数的表达式中计算,即K =1×10-6(1×10-6)2=1×106,因此平衡常数很大,反应趋于完全,D 项正确。
考点七十沉淀溶解平衡曲线1.t℃时,AgX(X=C1、Br)的溶度积与c(Ag+)和c(X-)的相互关系如下图所示,其中A线表示AgC1,B线表示AgBr,已知p(Ag+)=-lgc(Ag+),p(X-)=-lgc(X-)。
下列说法正确的是A. c点可表示AgC1的不饱和溶液B. b点的AgC1溶液加入AgNO3晶体可以变成a点C.t℃时,AgC1(s)+Br-(aq)AgBr(s)+C1-(aq)平衡常数K=10-4D.t℃时,取a点的AgC1溶液和b点AgBr溶液等体积混合,会析出AgBr沉淀【答案】D2.一定温度下,三种碳酸盐MCO3(M: Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如下图所示。
下列说法正确的是已知pM=-lgc(M),p(CO32-)=-lgc(CO32-)。
A. MgCO3、CaCO3、MnCO3的Ksp依次增大B. a点可表示MnCO3的饱和溶液,且c(Mn2+)= c(CO32-)C. b点可表示CaCO3的饱和溶液,且c(Ca2+)< c(CO32-)D. c点可表示MgCO3的过饱和溶液,且c(Mg2+)< c(CO32-)【答案】B3.某温度时,AgCl的溶解平衡曲线如图所示。
已知pAg=-lg c(Ag+)、pCl=-lg c(Cl-),利用pCl、pAg的坐标系可表示出AgCl的溶度积与溶液中c(Ag+)和c(Cl-)的相互关系。
下列说法错误的是A. A线、B线、C线对应的温度关系:A>B>CB. A线对应温度下,AgCl的K sp=1×10-10C. B线对应温度下,p点形成的溶液是AgCl的不饱和溶液D. C线对应温度下,n点表示KCl与过量的AgNO3反应产生AgCl沉淀【答案】C4.一定温度下,金属硫化物的沉淀溶解平衡曲线如图所示。
纵坐标p(M n+)表示-lg c(M n+),横坐标p(S2-)表示-lg c(S2-),下列说法不正确的是( )A.该温度下,Ag2S的K sp=1.6×10-49B.该温度下,溶解度的大小顺序为NiS>SnSC. SnS和NiS的饱和溶液中=104D.向含有等物质的量浓度的Ag+、Ni2+、Sn2+溶液中加入饱和Na2S溶液,析出沉淀的先后顺序为Ag2S、SnS、NiS 【答案】C【解析】A.由a(30,10-lg 4)可知,当c(S2-)=10-30mol·L-1时,c(Ag+)=10-(10-lg 4)mol·L-1,K sp(Ag2S)=c2(Ag+)·c(S2-)=[10-(10-lg 4)]2×10-30= 1.6×10-49,A项正确;B.观察SnS、NiS的沉淀溶解平衡曲线可以看出,当两条曲线中c(S2-)相同时,c(Ni2+)>c(Sn2+),由于SnS和NiS沉淀类型相同,所以溶解度的大小顺序为NiS>SnS ,B项正确;C.SnS和NiS的饱和溶液中===10-4,C项错误;D.假设Ag+、Ni2+、Sn2+均为0.1 mol·L-1,分别生成Agc(S2-)分别为1.6×10-47、10-20、10-24,因此生成2S、NiS、SnS沉淀时,需要沉淀的先后顺序为Ag2S、SnS、NiS,D项正确。
5.在t ℃时,AgBr在水中的沉淀溶解平衡曲线如图所示。
已知t ℃时AgCl的K sp=4×10-10,下列说法正确的是( )A.加入NaBr固体,AgBr的溶解度减小,K sp也减小B.在AgBr饱和溶液中加入固体NaBr,可使溶液中c点变到b点C.图中a点对应的是有AgBr沉淀生成D.在t ℃时,AgCl(s)+Br-(aq) ⇌AgBr(s)+Cl-(aq)的平衡常数K≈816【答案】D6.已知:pNi=-lgc(Ni2+);常温下,K(NiCO3)=1.4×10-7,H2S的电离平衡常数:K a1=1.3×10-7,K a2=7.1×10-15。
常温下,向10mL0.mol·L-1Ni(NO3)2溶液中滴加0.1mol·L-1Na2S溶液,滴加加程中pNi与Na2S溶液体积的关系如图所示。
下列说法不正确的是A. E、F、G三点中,F点对应溶液中水电离程度最小B.常温下,K sp(N iS)=1×10-21C.在NiS和NiCO3的浊液中=1.4×1014D. Na2S溶液中,S2-第一步水解常数K h1=【答案】D【解析】A.硝酸镍是强酸弱碱盐,硫化钠是强碱弱酸盐,它们都能促进水的电离。
F点表示硝酸镍和硫化钠恰好完全反应,溶液中溶质是硝酸钠,水的电离程度最小,故A正确;B.NiS(s) Ni2+(aq)+S2-(aq),K sp(NiS)=c(Ni2+)c(S2-)=1×10-21,故B正确;C.NiCO 3(s)+S2-(aq) NiS(s)+CO32-(aq) K===1.4×1014,故C正确;D.S2-+H2O HS-+OH-,K h1==,故D错误。
7.某温度时,BaSO4在水中的沉淀溶解平衡曲线如图所示。
下列说法不正确...的是A.加水稀释可以使溶液由c点变到d点B.此温度时,Ksp(BaSO4)=1.1×10-10C. b点有BaSO4沉淀析出D. a点对应的Ks p等于c点对应的Ksp【答案】A8.用0.100 mol·L-1 AgNO3滴定50.0 mL 0.0500 mol·L-1 Cl-溶液的滴定曲线如图所示。
下列有关描述错误的是()A.根据曲线数据计算可知K sp(AgCl)的数量级为10-10B.曲线上各点的溶液满足关系式c(Ag+)·c(Cl-)=K sp(AgCl)C.相同实验条件下,若改为0.0400 mol·L-1 Cl-,反应终点c移到aD.相同实验条件下,若改为0.0500 mol·L-1 Br-,反应终点c向b方向移动【答案】C9.向湿法炼锌的电解液中同时加入Cu和CuSO4,可生成CuCl沉淀除去Cl—,降低对电解的影响,反应原理如下:Cu(s)+Cu2+(aq)2Cu+(aq) ΔH 1=a kJ·mol-1Cl—(aq)+Cu+(aq)CuCl(s) ΔH 2=b kJ·mol-1实验测得电解液pH对溶液中残留c(Cl—)的影响如图所示。
下列说法正确的是A.向电解液中加入稀硫酸,有利于Cl-的去除B.溶液pH越大,K sp(CuCl)增大C.反应达到平衡增大c(Cu2+),c(Cl—)减小D.Cu(s)+ Cu2+(aq)+Cl—(aq)CuCl(s)的ΔH=(a+2b)kJ·mol-1【答案】C10.常温下,K SP(CaSO4)=9 ×10-6,常温下,CaSO4在水中的沉淀溶解平衡曲线如图所示。
下列判断错误的是()A. a点对应的K SP等于c点对应的K spB. a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液C. b点将有沉淀生成,平衡后溶液中c(SO42-)一定不等于3×10-3 mol•L-1D.向d点溶液中加入适量CaCl2固体可以变到c点【答案】B11.硫酸锶(SrSO4)常用于烟火和陶瓷工业,可在Na2SO4溶液中加入锶盐溶液沉淀而得。
下图表示不同温度下,SrSO4溶液中lg[c( Sr2+)]与lg[c( SO42-)]之间的关系。
下列有关说法正确的是()A.图像中a 、c两点的溶度积Ksp ( a ) < Ksp ( c )B. 363K时Ksp (SrSO4) = 1.0×10ˉ3.2C. SrSO4的溶解度随温度升高而增大D. 313K时,b点对应的溶液为饱和溶液,d点对应的溶液为不饱和溶液【答案】B【解析】A、a、c两点温度均为283 K,故a、c两点的溶度积相同,故A错误;B、363 K时,K sp(SrSO4)=c(Sr2+)·c()=10-1.60×10-1.60=1.0×10-3.20,故B正确;C、从题给图像中的三条直线可知,溶度积K sp(313 K)>K sp(283 K)>K sp(363 K),溶解度随温度的升高先增大后减小,故C错误;D、313 K时,b点对应的溶液为不饱和溶液,d点对应的溶液为饱和溶液,故D错误。
12.查阅资料可知:t ℃时,可用Na2S沉淀X2+、Y2+、Z2+(用M2+表示),所需S2-最低浓度的对数值lg c(S2-)与lg c(M2+)的关系如图所示。
下列说法正确的是A.三种离子对应的硫化物中K sp(XS)最小,约为1×10-20B.将ZS固体加入水中,部分溶解,继续加入少量水,固体量减小,溶液中c(S2-)增大C. YS、XS的饱和溶液中:=1×1020D.在c(X2+)=c(Z2+)=c(Y2+)=1×10-5mol·L-1的混合溶液中逐滴加入1×10-4mol·L-1的Na2S溶液,最先沉淀的是YS【答案】C13.溴酸银溶解度随温度变化曲线如图所示,下列说法错误的是A.溴酸银的溶解是放热过程B.温度升高时溴酸银溶解速度加快C.时溴酸银的约等于D.若硝酸钾中含有少量溴酸银,可用重结晶方法提纯【答案】A14.在t℃时,Ag2CrO4(橘红色)在水溶液中的沉淀溶解平衡曲线如图所示。
又知AgCl的K sp=1.8×10-10。
下列说法正确的是( )A.t℃时,Ag2CrO4的K sp为1×10-8;B.t℃时,将0.01 mol·L-1AgNO3溶液滴入20 mL0.01 mol·L-1 KCl和0.01 mol·L-1 K2CrO4的混合溶液中,CrO42-先沉淀;C.t℃时,Y点和Z点时Ag2CrO4的K sp相等;D.饱和Ag2CrO4溶液中加入K2CrO4不能使溶液由Y点变为Z点;【答案】C【解析】A.t℃时,Ag2CrO4的K sp=c2(Ag+)·c(CrO42-)=(1×10-3)2×(1×10-5)=1×10-11,A错误;B.c(Cl-)=1.8×10−10/0.01 mol/L=1.8×10-8 mol/L,c(CrO42-)=1×10−11/(0.01)2mol/L=1×10-7 mol/L,Cl-先沉淀,B错误;C.K sp只与温度有关,则t℃时,Y点和Z点时Ag2CrO4的K sp相等,C正确;D.饱和Ag2CrO4溶液中加入K2CrO4,c(CrO42-)增大,平衡逆向移动,c(Ag+)减小,则饱和Ag2CrO4溶液中加入K2CrO4能使溶液由Y点变为Z点,D 错误。