重组质粒pGEX
- 格式:doc
- 大小:42.50 KB
- 文档页数:9

pGEX-4T-3- pMD19-T-S11原核表达载体的构建、表达与纯化及多克隆抗体的制备水生呼肠孤病毒是水域生态环境中广泛存在的一类病毒,其中草鱼呼肠孤病毒(Grass carp reovirus, GCRV)是在1991年被国际病毒分类委员会(ICTV)分到水生呼肠孤病毒属,是由中国分离鉴定的第一株鱼类病毒[1]。
GCRV是具有双层衣壳、无囊膜、立体对称的20面体球形颗粒,主要由蛋白质和核酸组成,还含有少量以糖蛋白的形式存在的糖类,不含脂类[2]。
草鱼自古以来就是中国池塘养殖的当家品种,而GCRV被认为是水生病毒中对草鱼毒力最强、致病死亡率最高的病毒之一,该病毒引起的出血病不仅直接危害鱼体,而且会激发细菌性“三病”的发生,使草鱼的成活率降低到40~50[3],甚至只有10%左右[4],给中国的草鱼养殖业造成了很大的危害和困扰。
草鱼病毒性出血病,主要侵染于草鱼心脏、肝脏、肾脏、肌肉、脾、鳃、肠道等组织,且化学药物很难达到治疗效果,为了给草鱼养殖增产和减小不必要的经济损失,找到有效防治GCRV 的方法显得尤为重要。
GCRV基因组含有11条双链RNA(dsRNA),其分段基因组RNA的3' 端不含poly(A)尾巴, 在5’和3’末端各含有特异的重复保守序列,为5’-GUUAUU和3’-UCAUC。
11个片段根据凝胶电泳迁移率可分为3组,即大片段(L1,L2,L3)、中等片断(M4,M5,M6)、较小片段(S7,S8,S9,S10,S11)。
GCRV共编码5 种非结构蛋白, 分别是NS16、NS26、NS31、NS38、NS80[5]。
病毒的非结构蛋白在病毒的复制过程中发挥重要作用。
其中NS26是由S11编码的,含有244个氨基酸残基,分子量为26.4KD, 是水生呼肠孤病毒特有的蛋白质, 没有同源蛋白,含ATP-依赖性的RNA解螺旋酶功能性位点[6]。
国际上对GCRV编码蛋白的功能(尤其是非结构蛋白的功能)方面的研究还不够系统和全面;但根据呼肠孤病毒家族中同源蛋白功能相似的原则,除非结构蛋白NS26外,GCRV各蛋白在病毒复制周期中的地位和作用已经初步明确[7]。

pGEX-1λT (27-4805-01)pGEX-6P-1 (27-4597-01)EcoR I Sma I Sal I Xho I Not IBamH I PreScission ™ ProteaseLeu Glu Val Leu Phe Gln Gly Pro Leu Gly Ser Pro Glu Phe Pro Gly Arg Leu Glu Arg Pro HisCTG GAA GTT CTG TTC CAG GGG CCC CTG GGA TCC CCG GAA TTC CCG GGT CGA CTC GAG CGG CCG CAT↓pGEX-6P-2 (27-4598-01)BamH I PreScission ™ ProteaseLeu Glu Val Leu Phe Gln Gly Pro Leu Gly Ser Pro Gly Ile Pro Gly Ser Thr Arg Ala Ala Ala SerCTG GAA GTT CTG TTC CAG GGG CCC CTG GGA TCC CCA GGA ATT CCC GGG TCG ACT CGA GCG GCC GCA TCG↓EcoR I Sal I Xho INot I pGEX-6P-3 (27-4599-01)BamH IPreScission ™ ProteaseLeu Glu Val Leu Phe Gln Gly Pro Leu Gly Ser Pro Asn Ser Arg Val Asp Ser Ser Gly ArgCTG GAA GTT CTG TTC CAG GGG CCC CTG GGA TCC CCG AAT TCC CGG GTC GAC TCG AGC GGC CGC↓EcoR I Sma I Sal I Xho I Not I BamH IEcoR I Sma I Sal I Xho I Not I BamH I EcoR I Sma I Sal I Xho I Not IBamH I EcoR I Sma I Sal I Xho I Not IBamH I EcoR I Sma I Sal I Xho I Not IBamH I EcoR I Sma I Sal I Xho INot I BamH I EcoR I Sma I Sal I Not IEcoR I CTG GTT CCG CGT GGA TCC CCG GAA TTC ATC GTG ACT GAC TGA CGABamH ILeu Val Pro Arg Gly Ser Pro Glu Phe Ile Val Thr AspThrombinStop codons ↓pGEX~4900 bppBR322oriBal I BspM IPtac g lu ta thi on e S -t r a n s f e r as eA mp ra c Iq Nar I EcoR VBssH IIBstE IIMlu IApa ITth111 IAat IIPst Ip4.5AlwN IpSj10 Bam7Stop7∆pGEX-4T-2 (27-4581-01)pGEX-5X-1 (27-4584-01)pGEX-5X-2 (27-4585-01)pGEX-5X-3 (27-4586-01)pGEX-4T-1 (27-4580-01)pGEX-4T-3 (27-4583-01)pGEX-3X (27-4803-01)pGEX-2TK (27-4587-01)Leu Val Pr o Ar g Gly Ser Pr o Gly Ile Pr o Gly Ser Thr Ar g Ala Ala Ala SerCTG GTT CCG CGT GGA TCC CCA GGA ATT CCC GGG TCG ACT CGA GCG GCC GCA TCG TGAStop codon Ile Glu Gly Arg Gly Ile Pro Glu Phe Pro Gly Arg Leu Glu Arg Pro His Arg AspATC GAA GGT CGT GGG ATC CCC GAA TTC CCG GGT CGA CTC GAG CGG CCG CAT CGT GAC TGAStop codons Ile Glu Gly Arg Gly Ile Pro Gly Ile Pro Gly Ser Thr Arg Ala Ala Ala SerATC GAA GGT CGT GGG ATC CCC GGA ATT CCC GGG TCG ACT CGA GCG GCC GCA TCG TGAStop codon Ile Glu Gly Arg Gly Ile Pro Arg Asn Ser Arg Val Asp Ser Ser Gly Arg Ile Val Thr AspATC GAA GGT CGT GGG ATC CCC AGG AAT TCC CGG GTC GAC TCG AGC GGC CGC ATC GTG ACT GAC TGAStop codons Leu Val Pro Arg Gly Ser Pro Glu Phe Pro Gly Arg Leu Glu Arg Pro His Arg AspCTG GTT CCG CGT GGA TCC CCG GAA TTC CCG GGT CGA CTC GAG CGG CCG CAT CGT GAC TGAStop codons Leu Val Pro Arg Gly Ser Pro Asn Ser Arg Val Asp Ser Ser Gly Arg Ile Val Thr AspCTG GTT CCG CGT GGA TCC CCG AAT TCC CGG GTC GAC TCG AGC GGC CGC ATC GTG ACT GAC TGAStop codons ATC GAA GGT CGT GGG ATC CCC GGG AAT TCA TCG TGA CTG ACT GACIle Glu Gly Arg Gly Ile Pro Gly Asn Ser SerStop codons Leu Val Pro Arg Gly Ser Arg Arg Ala Ser ValKinaseCTG GTT CCG CGT GGA TCT CGT CGT GCA TCT GTT GGA TCC CCG GGA ATT CAT CGT GAC TGAStop codons Thrombin↓Thrombin↓Thrombin↓Thrombin↓Factor Xa↓Factor Xa↓Factor Xa↓Factor Xa↓EcoR IBamH I Sma I EcoR IBamH I Sma I pGEX-2T (27-4801-01)CTG GTT CCG CGT GGA TCC CCG GGA ATT CAT CGT GAC TGA CTG ACGLeu Val Pro Arg Gly Ser Pro Gly Ile His Arg AspStop codons EcoR IThrombin↓BamH I Sma I。

PCR扩增实验1、PCR扩增试验原理:利用特异的引物,以重组质粒pGEX-4T-1〔His〕6-C-X为模板扩增X基因。
n扩增反应1〕扩增引物2〕模板:重组质粒pGEX-4T-1〔His〕6-C-X3〕PCR反应试剂盒〔购置〕4〕50×TAE 缓冲液:242gTris碱57.1ml冰醋酸100ml0.5MEDTAH2O补充至1000ml5〕6×凝胶加样缓冲液:0.25%溴酚兰,0.25%二甲苯青FF,40%蔗糖,4℃保存6〕溴化乙锭保存液:10mg/ml,避光保存7〕0.8%琼脂糖凝胶:0.8克琼脂糖加热溶于100ml1×TAE。
1.材料2、n1)按以下次序,将各成分在0.5ml灭菌离心管内混合:(100ul)ddH2O79ul10×扩增缓冲液10ul4种dNTP混合物,2ul(终浓度为0.2mmol/L)MgCl26ul(终浓度为1.5mmol/L)引物11ul(终浓度为50pmmol/L)引物21ul(终浓度为50pmmol/L)模板DNA1ul2)100℃加热反应混合液10分钟,冰浴5′,使DNA完全变性。
3)将1ulTaqDNA 聚合酶(5单位/ul),加入反应混合液中。
4)用100ul石蜡油覆盖于反应混合液之上,防止样品在反复加热-冷却的过程中蒸发3、。
2.操作步骤n5〕按以下方法进行PCR反应:常用循环参数:①变性:94℃1分钟、②退火:55℃1分钟、③延长:72℃1分30个循环。
6)制备1.5%琼脂糖凝胶板:将1.5%琼脂糖凝胶置微波炉中溶化,稍等冷却,倒入制胶槽中,充分凝固后拔出样品梳;7)将凝胶板放人电泳槽,加入1×TAE缓冲液,使液面略高于凝胶。
8)从反应混合液中取出DNA扩增产物2ul并加1ul6×凝胶加样缓冲液,混匀后全部加入凝胶板的样品孔中进行电泳。
9)电泳100V约1小时;10)在500ml水中加入溴化乙锭保存液,(EB终浓度0.5-1ug/ml)4、,混匀;11)将疑胶轻轻滑入染色液,染色20-30分钟;12)取出凝胶,用水稍漂洗;13)紫外灯下确定DNA区带。

pGEX—4T—1—Neurexin 1β原核表达载体构建及表达条件的优化作者:徐岩王梦林侯筱宇来源:《中国科技纵横》2015年第24期【摘要】目的:构建Neurexin 1β(Nrx 1β)原核表达重组体。
方法:以pcDNA3.1-Myc-Nrx 1β真核表达载体为模板,经PCR扩增Nrx 1β目的基因,然后将其亚克隆入pGEX-4T-1载体,构建其原核表达载体,转化入宿主菌BL21,选用IPTG进行诱导表达,优化表达条件,SDS-PAGE检测Nrx 1β的蛋白表达。
结果:N rx 1β目的基因扩增成功,经克隆后成功连接至pGEX-4T-1,重组体酶切结果及测序结果与预期结果一致。
转化入BL21后在IPTG的作用下成功表达,且在24°C时, IPTG浓度为0.2 mmol/L诱导12 h后Nrx 1β的蛋白表达量最高。
结论:该研究成功构建了pGEX-4T-1-Nrx 1β原核表达载体,并优化了Nrx 1β的蛋白表达条件,为下一步研究该蛋白质的功能奠定基础。
【关键词】Neurexin 1β 原核表达载体表达条件【Abstract】Objective: To construct the prokaryotic expressing plasmid recombinant for Neurexin 1β (Nrx 1β). Method:Nrx 1β cDNA was obtained by PCR from pcDNA3.1-Myc-Nrx 1β eukaryotic expression vector, and cloned into the pGEX-4T-1 vector. The positive prokaryotic expressi on vector was transformed into Escherichia coli BL21. The expression of Nrx 1β was induced by IPTG with optical condition and was detected by SDS-PAGE. Result:Gene of Nrx 1β was successfully amplified, and the PCR product was ligated into pGEX-4T-1. Results of restriction enzyme digestion and sequencing were consistent with expectations. After transforming into BL21,the protein expression was successfully induced by IPTG. Conclusion:The study constructed Nrx 1β prokaryotic expressing plasmid recombinant successfully, and optimized the protein expression of Nrx 1β,which provide the foundation for studying the role of Nrx 1β in nervous system.【Key words】Neurexin 1β; prokaryotic expressing vector; expression condition1 引言Neurexin(Nrx)是一种突触前膜蛋白,他们大多定位于突触前膜并含有一个跨膜结构域。

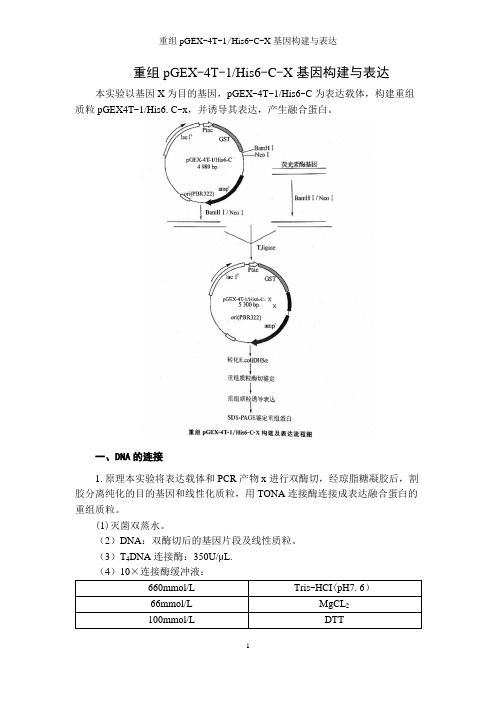
重组pGEX-4T-1/His6-C-X基因构建与表达本实验以基因X为目的基因,pGEX-4T-1/His6-C为表达载体,构建重组质粒pGEX4T-1/His6.C-x,并诱导其表达,产生融合蛋白。
一、DNA的连接1.原理本实验将表达载体和PCR产物x进行双酶切,经琼脂糖凝胶后,割胶分离纯化的目的基因和线性化质粒,用TONA连接酶连接成表达融合蛋白的重组质粒。
(1)灭菌双蒸水。
(2)DNA:双酶切后的基因片段及线性质粒。
(3)T4DNA连接酶:350U/μL.(4)10×连接酶缓冲液:2.方法(1)5mL离心管中加人以下成分:(2)14~16℃水浴中过夜。
(3)65℃水浴10min,灭活连接酶。
二、大肠杆菌感受态细胞的制备及转化1、原理经氯化钙处理的大肠杆菌,受短暂的热刺激后,可形成易于接受环状质粒DNA的感受态(competent)细胞。
山于不同的质粒可带有不同的抗生素抗性基因(本实验质粒带有氨青霉素抗性基因),应根据转化菌的耐药特性进行筛选。
2、材料(1)LB培养基:10胰蛋白胨,5g酵母粉,5gNaCl加水至950mL,用1moI/LNaOH调节pH至7.0,定容至1000,高压灭菌。
(2)LA培养基:在LB培养基中加人终浓度80μg/mL的氨苄青霉素。
(3)LA平皿:1.5g琼脂,100mLLB培养基,高压灭菌,待其降温至55℃时,加氨苄青霉素至80μg/ml.,倾倒平皿,置室温1天,使水分吸收,4℃保存。
(4)100mmoI/LCaCl2,用双蒸水配制,高压灭菌,4℃保存。
3.小量制备大肠杆菌感受态细胞(1)接种E.coliDH5α单菌落于I.5mlLB培养基,37℃振荡培养过夜。
(2)转种0.5mL过夜培养菌液于20LB培养基中(3)37℃培养至细菌密度OD600为0.4(约2.5h).(4)取1mL菌液至1.5离心管,4000rpm,2min,弃上清液。
(5)加500μL100mmol/LCaC12,混匀,冰浴30min(6)离心(4℃,4000rpm,2min),弃上清液。
基因工程实验详细步骤一、目的基因LK的扩增——PCR(含电泳)(一)目的基因LK的扩增——NE201(1)实验准备材料:rLK重组质粒(模板)试剂:PCR试剂盒用具:移液枪(2.5μl、10μl、50μl)以及相应枪头(盒)、EP管(100μl)、EP板(大、小);冰袋两只、手套、废液桶仪器:离心机(14000rpm)、PCR扩增仪(2)反应体系(50μl)试剂(按照加样顺序)用量dH2O23μL重组质粒1μL上游引物F 0.5μL下游引物R 0.5μLTaq酶25μL(3)反应条件预变性95℃,10min变性95℃,30s退火56.6℃,35s延伸72℃,40s最终延伸72℃,10minTIP:*吸取或加入液体时,枪头尽量少伸入,可避免气泡产生;若有气泡,需10000rcf离心1min 再进行下一步实验*勤换枪头,避免污染试剂或产物*任何移液枪用完后及时调回最大量程*仪器用完后及时关闭(二)LK PCR产物的电泳——NE217(1)实验准备材料:LK PCR产物试剂:去离子水、50×TAE缓冲液、电泳用琼脂糖、6×Loading Buffer、DL1000marker(D526A)、Ultrapower DNA Stain染液用具:钥匙、称量纸、橡皮筋、100ml锥形瓶、50ml量筒;制胶槽、制胶卡、制胶梳(18teeth);移液枪(10μl、1000μl)及相应枪头(盒),100μl EP管,EP板(大、小);冰袋两只、手套(包括塑料和麻布)、废液桶仪器:电子天平、微波炉、电泳仪(含电泳槽)(2)制胶(3%)1. 称取电泳用琼脂糖0.6g(即总体积20ml 的3%),小心倒入100ml锥形瓶中2. 取TAE缓冲液400μl于50ml量筒中,去离子水定容至20ml(实为电泳缓冲液)3. 将量筒中液体转入锥形瓶中,盖上吸量纸,用橡皮筋封好,再用步骤2中用剩的枪头扎一个小孔4. 将制胶梳(18 teeth)、制胶卡、制胶槽洗净并用吸水纸擦干,组装好5. 至于微波炉中,注意观察,煮沸后立即拿出(戴上麻布手套),轻轻晃匀,重复2-4次,至胶完全澄清均一为止6. 及时将胶转入准备好的制胶槽,凝固30min后,连着横条纹塑料板一起放入电泳槽中(胶孔靠近负极)(3)加样和电泳1. 在EP管内分别加入A. DL1000marker 5μl,染液1μl;B. PCR产物5μl,6×loading buffer1.2μl,染液1μl2. 将样品全部转入胶孔中。
目 录一、摘 要中文论著摘要 (1)英文论著摘要 (3)二、英文缩略语 (6)三、论文前言 (7)实验材料与方法 (8)实验结果 (19)讨论 (27)结论 (30)四、本研究创新性的自我评价 (31)五、参考文献 (32)六、附录综述 (37)在学期间科研成绩 (48)致谢 (49)个人简介 (50)·中文论著摘要·新布尼亚病毒非结构蛋白(NSs)纯化及其多克隆抗体制备目的制备新布尼亚病毒(severe fever thrombocytopenia syndrome virus,SFTSV)非结构蛋白(NSs)多克隆抗体,进一步发现NSs基因的结构和功能,为深入探究SFTSV的致病机理奠定基础。
方法1.PGEX-6P- SFTSV NSs重组蛋白的表达与纯化:以提取的RNA反转录合成的cDNA为模板,扩增SFTSV-NSs片段,分别连接到PGEX-6P-1载体和PFLAG-CMV-3载体上构建重组质粒。
构建成功的重组质粒PGEX-6P- SFTSV NSs转化到大肠杆菌DH5α中进行克隆,将鉴定正确的重组质粒转到大肠杆菌BL21中,表达重组蛋白。
经过诱导条件优化,选择最适条件,大量诱导重组蛋白,经GST亲和柱层析过滤以获得高纯度的PGEX-6P- SFTSV NSs重组蛋白。
2.PGEX-6P- SFTSV NSs多克隆抗体的制备:将纯化后的PGEX-6P- SFTSV NSs重组蛋白与完全佐剂混合,制备抗原,免疫新西兰大白兔,改用不完全佐剂后再免疫四次,得到的抗体经Western Blotting及ELISA检测抗体的特异性及效价。
3.多克隆抗体的应用:对感染SFTSV病毒的VERO细胞及转染SFTSV NSs-Flag质粒的293细胞分别进行Western Blotting及间接免疫荧光(IFA)检测,验证SFTSV在细胞中的表达及其表达部位;SFTSV病毒感染VERO细胞利用制备的抗体检测SFTSV病毒滴度。
pgex特点就是带有GST标签,可以增加目的蛋白的溶解度,别的没什么特点,属于大众型载体,目前也较常使用。
你说的没有表达有没有做全菌的sds-page啊,不管是不是形成包涵体全菌电泳都应该有条带,至于形不形成包涵体就取决于你的iptg浓度和诱导温度了,iptg 越低,温度越低可溶性越好,我们曾做过0.1的iptg,4度诱导过夜的。
因为pgex载体是不能变性复性的,因为GST标签的活性会发生改变。
如果是全菌都没有表达,首先检查是不是你插入序列的问题,排出后看看是不是稀有密码子的问题,真核基因在原核细胞中表达会受到大肠杆菌稀有密码子的影响,网上有分析软件。
如果稀有密码子比较多可以使用rosetta 菌株来表达,应该能出来的,只要不是你序列的问题,没有出不来的蛋白,只是溶不溶,有没有活性的问题。
PGEX系列质粒用什么菌株表达:普通的表达采用最常规的DH5a就可以!如果想高效率表达,可采用BL21菌株进行表达!聚丙烯酰氨凝胶电泳目录简介作用补充信息过程常见问题及分析编辑本段简介聚丙烯酰胺凝胶电泳作用:用于分离蛋白质和寡糖核苷酸。
作用原理聚丙烯酰胺凝胶为网状结构,具有分子筛效应。
它有两种形式:非变性聚丙烯酰胺凝胶及SDS-聚丙烯酰胺凝胶(SDS-PAGE);非变性聚丙烯酰胺凝胶,在电泳的过程中,蛋白质能够保持完整状态,并依据蛋白质的分子量大小、蛋白质的形状及其所附带的电荷量而逐渐呈梯度分开。
而SDS-PAGE仅根据蛋白质亚基分子量的不同就可以分开蛋白质。
该技术最初由shapiro于1967年建立,他们发现在样品介质和丙烯酰胺凝胶中加入离子去污剂和强还原剂后,蛋白质亚基的电泳迁移率主要取决于亚基分子量的大小(可以忽略电荷因素)。
作用SDS是阴离子去污剂,作为变性剂和助溶试剂,它能断裂分子内和分子间的氢键,使分子去折叠,破坏蛋白分子的二、三级结构。
而强还原剂如巯基乙醇,二硫苏糖醇能使半胱氨酸残基间的二硫键断裂。
pGEX-4T-2-TK原核表达质粒的构建及其表达钟俐强;杨斯皓;贾钰铭;吴敬波【摘要】目的构建含胸苷激酶基因(TK自杀基因)的pGEX-4T-2-TK原核表达质粒,观察其在大肠杆菌中表达情况,为肿瘤基因治疗奠定基础.方法聚合酶链式反应(PCR)扩增TK基因片段,利用限制性内切酶BamHⅠ和SalⅠ将其连接至原核表达载体pGEX-4T-2内,再将连接产物转化入大肠杆菌,挑取单菌落,提取质粒,经PCR 和双酶切鉴定后测序.将转化正确的大肠杆菌培养过夜,异丙基-β-D-硫代半乳糖苷(IPTG)诱导后观察蛋白表达情况.结果 TK基因片段成功连接至载体pGEX-4T-2中,在大肠杆菌BL21中可得到稳定表达的目的蛋白.结论 pGEX-4T-2-TK原核表达质粒构建成功,为后续肿瘤基因治疗研究奠定了基础.【期刊名称】《重庆医学》【年(卷),期】2010(039)009【总页数】3页(P1036-1038)【关键词】自杀基因;质粒构建;聚合酶链式反应【作者】钟俐强;杨斯皓;贾钰铭;吴敬波【作者单位】四川省宜宾市第二人民医院肿瘤科,644000;四川省宜宾市第二人民医院肿瘤科,644000;四川省宜宾市第二人民医院肿瘤科,644000;四川省宜宾市第二人民医院肿瘤科,644000【正文语种】中文【中图分类】R730.54;R446.61目前放疗与化疗为恶性肿瘤的主要治疗手段,但肿瘤中乏氧细胞的存在是导致放、化疗失败的重要原因。
基因治疗的出现给恶性肿瘤的治疗提供了新的思路[1]。
TK 基因是近年来研究最多的自杀基因,全称为人类单纯疱疹病毒胸苷激酶基因(HSV-tk),可与更昔洛韦(ganciclovir,GCV)一起组成HSV-tk/GCV自杀基因系统[2]。
为此,本实验将TK基因插入到原核表达载体pGEX-4T-2内,并观察其在大肠杆菌BL21中的蛋白表达情况,为进一步研究将构建好的重组质粒转染厌氧菌(如双歧杆菌)后能否解决肿瘤乏氧区放、化疗抗拒,以为提高治疗效果打下基础。