00 粒子结构示意图(09.1.6)
- 格式:doc
- 大小:787.50 KB
- 文档页数:6

粒子结构示意图、元素周期表一、单选题(共8道,每道8分)1.如图为某粒子的结构示意图,下列说法错误的是( )A.该图表示的微粒是原子B.在化学反应中易得到电子C.原子核内有12个质子D.该粒子属于金属元素答案:B解题思路:A.由该粒子的结构示意图可知,质子数=核外电子数,故该图表示的微粒是原子,A正确;B.该原子最外层电子数是2,少于4个,易失去电子,B错误;C.圆圈内的数字表示原子核内质子数,该原子原子核内有12个质子,C正确;D.该元素的核内有12个质子,根据原子序数=质子数可知该元素为12号镁元素,属于金属元素,D正确。
故选B。
试题难度:三颗星知识点:微粒结构示意图2.课堂上,老师给出了四种微粒的结构示意图(如图所示),同学们畅所欲言,纷纷发表自己的看法,下面列举了四位同学的观点,其中错误的是( )A.甲同学:③的质子数与核电荷数都是16B.乙同学:①④属于同种元素C.丙同学:四种微粒都是原子D.丁同学:②③的化学性质相似答案:C解题思路:A.③中质子数为16,则核电荷数=质子数=16,A正确。
B.元素种类由质子数决定,①④质子数相同,属于同元素,B正确。
C.质子数=核外电子数,为原子;质子数≠核外电子数,为离子;可知①②③表示原子,D.化学性质由最外层电子数决定,②③最外层电子数均为6,化学性质相似,D正确。
故选C。
试题难度:三颗星知识点:微粒结构示意图3.如图为硫离子(S2-)的结构示意图。
与硫原子相比,二者( )A.质量差别较大B.核外电子数相同C.化学性质相似D.核内质子数相同答案:D解题思路:由硫离子(S2-)的结构示意图可知,与硫原子相比,硫离子(S2-)是硫原子得到2个电子形成的。
A.原子的质量主要集中在原子核上,核外电子的质量可忽略不计,根据分析,形成离子后原子核没有变,故二者质量几乎相等,A错误。
B.根据分析,二者的核外电子数不同,B错误。
C.决定元素化学性质的是最外层电子数,根据分析,硫离子与硫原子最外层电子数不同,二者的化学性质不同,C错误。
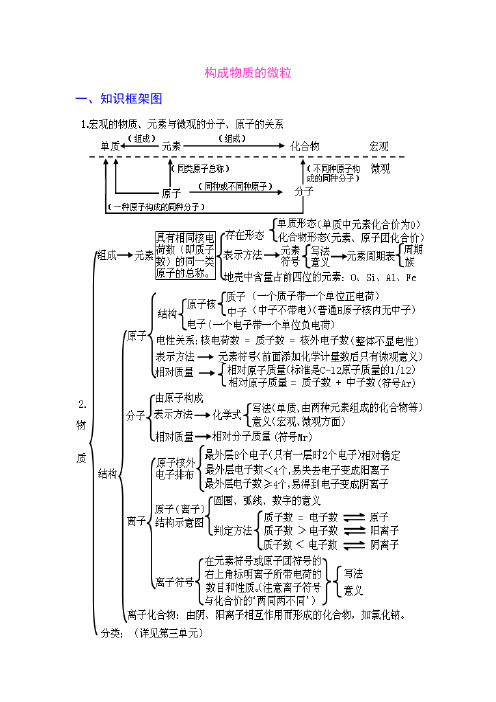
构成物质的微粒一、知识框架图二、学生应该掌握的核心知识构成物质的微粒(一)、概述微观的粒子有:原子、离子、分子、电子、质子等,它们都是微观概念,既表示种类又可表示个数。
分子、原子、离子都是构成物质的粒子。
A 、金属单质和稀有气体由原子直接构成;B 、非金属单质、非金属与非金属形成的化合物由分子构成。
C 、化合物中既有金属元素又有非金属元素的离子化合物是由离子构成。
(二)、分子:分子是保持物质化学性质的最小粒子。
分子由原子构成。
例:1个水分子由2个氢原子和1个氧原子构成A 、分子是构成物质的一种微粒,常见由分子构成的物质:水、氢气、氧气、氮气、二氧化硫、二氧化碳等。
【由分子构成的物质,在物理变化中,分子本身不发生改变;在化学变化中,分子本身发生改变,生成新的分子。
】B 、分子的微观特性:分子总是在不断地运动着;分子之间存在间隔;分子的质量很小。
(三)、原子:1、原子是构成物质的另一种微粒。
原子构成分子,原子也可直接构成物质,如金属汞、稀有气体等。
2、在化学变化中,分子本身发生变化,而原子本身没有变化,只是重新组合成新的分子,构成新的物质,所以,原子是化学变化中的最小粒子。
(注意:原子不是构成物质的最小粒子。
)化学反应的实质:在化学反应中分子分裂为原子,原子重新组合成新的分子。
(四)、相对原子质量:以一种碳原子(碳-12)质量的1/12作为标准,其他原子的质量跟它相比较所得的数值,是该种原子的相对原子质量。
相对原子质量=一个碳原子的质量一个某原子的质量×12 (相对原子质量是个比,单位为1)相对原子质量≈质子数 +中子数 (五)、原子的构成原子的的构成:原子由核外带负电的电子和带正电的原子核构成,原子核由带正电的质子 和不带电的中子构成。
在不显电性的粒子里: 核电荷数=质子数=核外电子数注意:原子不是构成物质的最小粒子。
原子只是化学变化中的最小粒子; 普通氢原子核中只有质子无中子,氢原子的原子核就是一个质子。




原子结构示意图第一页:原子结构的基本组成原子是由原子核和核外电子组成的。
原子核位于原子的中心,由质子和中子组成。
质子带正电荷,中子不带电荷。
核外电子围绕原子核运动,带有负电荷。
第二页:原子结构的电子排布原子中的电子按照一定的规律排布在各个能级上。
能级是电子在原子中运动的能量状态。
电子填充离原子核最近的能级,然后依次填充更远的能级。
每个能级上最多可以容纳的电子数是固定的。
第三页:原子结构的同位素同位素是指具有相同质子数但中子数不同的原子。
同位素在化学性质上基本相同,但在物理性质上可能有所不同。
例如,氢原子有三种同位素:氕、氘和氚。
第四页:原子结构的化学键原子之间的相互作用可以通过化学键来描述。
化学键是原子之间通过共享或转移电子而形成的连接。
常见的化学键有共价键、离子键和金属键等。
所有原子结构示意图第一页:原子结构的基本组成原子是构成物质的基本单位,由原子核和核外电子组成。
原子核位于原子的中心,由带正电荷的质子和不带电荷的中子组成。
质子和中子共同决定了原子的质量和稳定性。
核外电子带有负电荷,围绕原子核运动,形成电子云。
第二页:原子结构的电子排布原子中的电子按照能级分布,每个能级上最多容纳的电子数是固定的。
电子填充离原子核最近的能级,然后依次填充更远的能级。
不同原子的电子排布不同,决定了它们的化学性质和反应活性。
第三页:原子结构的同位素同位素是指具有相同质子数但中子数不同的原子。
同位素在化学性质上基本相同,但在物理性质上可能有所不同。
例如,氢原子有三种同位素:氕、氘和氚。
同位素的存在对原子的稳定性和核反应具有重要意义。
第四页:原子结构的化学键原子之间的相互作用可以通过化学键来描述。
化学键是原子之间通过共享或转移电子而形成的连接。
常见的化学键有共价键、离子键和金属键等。
化学键的形成和断裂是化学反应的基础,决定了物质的性质和反应特性。
所有原子结构示意图第一页:原子核的组成原子核是原子的中心部分,它由质子和中子组成。
1、
(得或失)电子。
2
3
4
5、R元素的原子结构示意图为:
于
6、下面是四种微粒的结构示意图。
A、B、C、D、
用序号填空:
(1)电子层结构相同的是;(2)属于同种元素的是;(3)表示阳离子的是;(4)属于金属元素原子的是。
7、根据下列微粒示意图用序号回答下列问题。
(1)属于同种元素的是_____
(2)属于稀有气体元素的是
(3)属于非金属元素的是____
9、下图为四种粒子的结构示意图,请用对应的序号填空:
(1)属于同种元素的粒子是____________。
(2)具有相对稳定结构的粒子是__________。
10、已知碘元素符号为I ,它的原子结构示意图为:请结合所学知识,填写下列
A 、
B 、
C 、
D 、
14、与元素化学性质关系最密切的是
A、质子数
B、电子层数
C、中子数
D、最外层电子数
15、下列粒子的结构示意图中,表示同种元素的微粒的是
A、①②③
B、③④
C、①②
D、①④
16、下列微粒在人体中起着重要作用,其中属于阴离子的是
A、B、C、D、
17、某微粒的结构示意图是,下列说法错误的是
A、该微粒原子核内有9个质子
B、原子核外有2个电子层
C、原子最外层电子数为7
D、属于金属元素
18、下列各组粒子的结构示意图中,前者表示阴离子,后者表示阳离子的是
A、B、
C、D、
19、下列微粒结构示意图表示阳离子的是
20、根据下列原子结构示意图判断,属于金属元素的是
21、下列微粒结构示意图表示阳离子的是
22、某元素的原子结构示意图为,下列关于该元素的说法错误的是
A、它的阳离子带3个单位正电荷
B、它的阳离子有10个质子
C、它是一种金属元素
D、它的原子核外有13个电子
23、根据粒子结构示意图给出的信息,下列说法正确的是
①②③
A:①②③表示的是3个原子B:③表示的元素是非金属元素
C:①③表示的是阳离子D:①②表示的元素化学性质相似
24、从①质子数,②中子数,③最外层电子数,④原子核等选项中选择用序号填空。
(1)原子的核电荷数决定于原子结构中的;
(2)原子序数主要决定于原子结构中的;
(3)原子的相对原子质量决定于原子结构中的;
(4)原子的质量主要集中在原子结构中的;
(5)元素的种类决定于原子结构中的;
(6)元素的化学性质主要决定于原子结构中的;
(7)元素的分类主要决定于原子结构中的;
(8)元素的化合价主要决定于原子结构中的;
粒子结构示意图参考答案:
6、AB;BD;B;D;
7、BD;A;C;
8、31;B;
9、BD;AD;
10、53;C;
11-20 CCADD (AD)DCDB
21-23 DBD
24、①;①;①②;④;①;③;③;
5、某粒子的结构示意图为,当x=12时,则该元素属于___________(填“金属”或“非金属”),该元素的原子核外有___________个电子层。
4、已知某原子的相对原子质量是27,该原子核中含有14个中子,则该原子的核电荷数是_____________,质子数是_____________,该元素的元素符号是_____________。
19、蔗糖(C 12H 22O 11)是生活中常见的食品之一,它由 种元素组成,各元素的原子个数比是 ,它的一个分子中共有 个原子,蔗糖中碳元素的质量分数为 。
4.A 元素的原子结构示意图为: A 元素在化学反应中容易
电子变成________离子,属_________元素(填金属或非金属);B 元素的离子结构示意图为:
,该离子带______个单位正电荷,该元素的原子核外总共有_______个电子。