化学|微粒结构示意图其实不难
- 格式:doc
- 大小:12.70 KB
- 文档页数:2

粒子结构示意图、元素周期表一、单选题(共8道,每道8分)1.如图为某粒子的结构示意图,下列说法错误的是( )A.该图表示的微粒是原子B.在化学反应中易得到电子C.原子核内有12个质子D.该粒子属于金属元素答案:B解题思路:A.由该粒子的结构示意图可知,质子数=核外电子数,故该图表示的微粒是原子,A正确;B.该原子最外层电子数是2,少于4个,易失去电子,B错误;C.圆圈内的数字表示原子核内质子数,该原子原子核内有12个质子,C正确;D.该元素的核内有12个质子,根据原子序数=质子数可知该元素为12号镁元素,属于金属元素,D正确。
故选B。
试题难度:三颗星知识点:微粒结构示意图2.课堂上,老师给出了四种微粒的结构示意图(如图所示),同学们畅所欲言,纷纷发表自己的看法,下面列举了四位同学的观点,其中错误的是( )A.甲同学:③的质子数与核电荷数都是16B.乙同学:①④属于同种元素C.丙同学:四种微粒都是原子D.丁同学:②③的化学性质相似答案:C解题思路:A.③中质子数为16,则核电荷数=质子数=16,A正确。
B.元素种类由质子数决定,①④质子数相同,属于同元素,B正确。
C.质子数=核外电子数,为原子;质子数≠核外电子数,为离子;可知①②③表示原子,D.化学性质由最外层电子数决定,②③最外层电子数均为6,化学性质相似,D正确。
故选C。
试题难度:三颗星知识点:微粒结构示意图3.如图为硫离子(S2-)的结构示意图。
与硫原子相比,二者( )A.质量差别较大B.核外电子数相同C.化学性质相似D.核内质子数相同答案:D解题思路:由硫离子(S2-)的结构示意图可知,与硫原子相比,硫离子(S2-)是硫原子得到2个电子形成的。
A.原子的质量主要集中在原子核上,核外电子的质量可忽略不计,根据分析,形成离子后原子核没有变,故二者质量几乎相等,A错误。
B.根据分析,二者的核外电子数不同,B错误。
C.决定元素化学性质的是最外层电子数,根据分析,硫离子与硫原子最外层电子数不同,二者的化学性质不同,C错误。

2019年化学中考试题分类汇编微粒的结构示意图一.选择题1.(2018•毕节市)某微粒的结构示意图如图所示,下列有关该微粒的说法错误的是()二.解答题1.(2018•益阳)人教版九年级化学上册教材图3﹣12部分原子的结构示意图如下:请回答:(1)氧元素与硫元素化学性质相似的原因是两种原子的最外层电子数相同;(2)写出11号和17号元素组成化合物的化学式NaCl ;(3)同一周期(横行)的原子结构示意图具有共同的特点是电子层数相同(任写一点).2.(2018•株洲)如图中A、B、C、D是四种粒子的结构示意图.请回答下列问题:(1)A中x= 2 ;A粒子的化学式是S2﹣.(2)由B粒子的结构示意图可知,B粒子的名称是铝原子.(3)以上四种结构示意图所表示的粒子中,表示离子的是AD (填字母代号).3.(2018•荆州)某粒子的结构示意图为(其中n≠0),请回答下列问题.(1)n的最大值为 8 .(2)若该粒子带两个单位的负电荷,则其对应的化学符号为 S 2﹣;由+6价的该元素形成的常见酸的化学式为 H 2SO 4 .(3)若m ﹣n=10,则该粒子对应的常见金属元素有 Na 、Mg 、Al (写元素符号).4.(2018•乌鲁木齐)如图为六种常见元素的原子结构示意图,依据图中信息回答下列问题:(1)上述六种元素中属于金属元素的是钠、铝(填元素名称),己元素的化学性质与丙(填元素符号)元素相似.(2)在化学反应中,戊元素的原子容易失去(填“失去”或得到)电子形成阳离子,该元素的离子符号是Al3+.该元素单质与氧气反应的化学方程式是4Al+3O2═2Al2O3.(3)甲、乙元素和碳元素、氧元素组成的一种常见氮肥的化学式为:NH4HCO3[CO(NH2)2] .5.(2018•威海)21世纪的能源金属﹣锂(Li)金属锂,被誉“21世纪的能源金属”,当前手机中广泛使用的电池,主要是高能锂电池.请回答下列问题:(1)锂原子的原子结构示意图如图所示;锂原子在化学反应中容易(填“得到”或“失去”)失去电子变成离子,其离子符号为Li+.(2)研究表明,锂的金属活动性比较活泼.写出金属锂与稀硫酸反应的化学方程式2Li+H2SO4=Li2SO4+H2↑.(3)金属锂除了制造锂电池外,还可以用于储存氢气,其原理是金属锂与氢气化合生成白色粉末状的氢化锂(LiH),氢化锂与水反应生成氢氧化锂和氢气.写出上述过程中发生反应的化学方程式2Li+2H2O=2LiOH+H2↑.6.(2018•宿迁)如图A是某金属元素形成微粒的结构示意图:该金属在空气中燃烧时放出大量的热并发出耀眼的白光,图B是该反应的微观示意图.请根据以上信息回答下列问题:(1)该金属元素原子核外电子数= 12 ,图A所示微粒的符号为Mg2+;写出一种与图A所示具有相同电子层结构的阴离子的符号O2﹣.(2)图B所示的化学方程式:2Mg+O22MgO .227.(2018•武汉)如图1为某元素的原子结构示意图,利用该元素组成的单质可测定空气中氧气的含量,实验装置如图2所示.(1)该元素原子的核电荷数为15 ,在化学反应中该原子易得到电子;(2)图2所示装置中发生反应的化学方程式为4P+5O22P2O5.2P22P8.(2018•菏泽)有A、B、C、D四种元素,其原子结构示意图如图:(1)D元素的名称为硫,D元素与图中 B (填写字母序号)元素的化学性质相似,D元素的离子符号为S2﹣.(2)A、B、C三种元素能形成一种化合物,其水溶液的pH >7(填>、<、=)(3)A、B两种元素的原子以1:1的比例形成的化合物为(写化学式)H2O2,其中B元素化合价为﹣1 .9.(2018•重庆)学习化学后,我们学会了从微观角度认识物质.(1)已知碳原子和氧原子的结构示意图分别为:和,两种原子中相等的是 C (填序号).A.质子数 B.电子数 C.第一层电子数 D.第二层电子数(2)保持一氧化碳化学性质的粒子名称是一氧化碳分子.(3)如图是一氧化碳与氧气反应的微观模型图,请在如图框中以图示的方式完成该化学反应的微观过程(图中●表示氧原子,○表示碳原子).)10.(2018•娄底)据《自然》杂志报道,科学家最近研究出一种以锶(Sr )做钟摆的钟,它是世界上最精确的钟,锶的原子结构示意图如右图所示,请回答: (1)锶原子的核电荷数为38 . (2)锶原子核外电子层数为 5 .(3)锶原子最外层容易 失 电子.(填“得”或“失”)11.(2018•日照)钙元素是构成人体的重要组分,它使得骨髓和牙齿具有坚硬的结构支架.如图①是钙原子的结构示意图请回答下列问题: (1)①中x= 8(2)图中A 、B 、C 、D 四种粒子属于 3 种元素 (3)C 元素与D 元素组成化合物的化学式是 MgF 2(4)A 、B 、C 、D 四种粒子中与图①所示的钙元素化学性质相似的是 D (填“A”、“B”、“C”或“D”)12.(2018•重庆)氧化铝是红宝石、蓝宝石的主要成份,它由铝离子和氧离子构成. (1)氧化铝的化学式为 Al 2O 3 . (2)3个铝离子的化学符号是 3Al 3+.(3)氧离子的结构示意图为,一个氧离子中有 8 个质子.13.(2018•攀枝花)如图为六种原子的结构示意图.请回答下列问题:(1)图中六种元素之间的最本质区别是质子数不同;(2)镁原子在化学反应中容易失去2个电子形成镁离子,镁离子的化学式为Mg2+;氧化钠由钠离子和氧离子构成,氧化钠的化学式为Na2O .(3)从原子结构上分析,图中哪两组元素具有相似的化学性质(填元素符号)Cl 、I .(4)在上述碘的原子结构示意图中,x= 18 .14.(2018•十堰)M 元素的一种粒子结构示意图是.(1)若M 元素组成的单质是空气的成分之一,约占空气总体积的,则该单质是 氧气 .(2)元素的化学性质与其原子的最外层电子数年有关.若x=9,M 元素与下列 ② (填序号)的元素化学性质相似.(3)若x=7,M 元素的这种粒子可与上图中的一种粒子相互作用形成化合物,该化合物由离子构成.写出该化合物的化学式 Mg 3N 2 .15.(2018•邵阳)根据下列粒子结构示意图,回答问题.(1)图A、B、C、D四种粒子共表示三种元素.(2)D原子在化学反应中易得(填“得”或“失”)电子.(3)由C元素和D元素组成化合物的化学式为MgCl2.。

构成物质的微粒1.微粒的基本性质2.离子(1)定义:带电的原子(或原子团)叫离子。
(2)分类:①阳离子:带正电的原子或原子团,如Na+、Mg2+、NH+4 。
②阴离子:带负电的原子或原子团,如Cl-、O2-、CO2-3 、SO2-4 。
3.原子结构(1)由于质子与核外电子的电量相等、电性相反,故原子呈电中性;(2)原子序数=质子数=核电荷数=核外电子数。
4.原子结构示意图数子电的上层子电层子子原)核质子数相同的原子属于同种元素;原子的最外层电子数决定元素的化学性质,一般来说最外层电子数相同的化学性质相似,但不是一定相似。
注意:氦和镁原子的最外层电子数均为2,但化学性质不相同。
5.相对原子质量(1)定义:以碳-12原子质量的1/12为标准,其他原子的质量跟它相比所得的比值,就是这种原子的相对原子质量,符号为Ar 。
(2)表达式:相对原子质量(Ar )=一个原子的实际质量一个碳-12原子质量的1/12(3)相对原子质量≈质子数+中子数注意:相对原子质量的单位为“1”,省略不写,不是“g ”。
原子原子核核外电子(每个电子带1个单位负电荷)质子(每个质子带1个单位正电荷)中子(不带电)7.化学符号周围数字的意义个子粒数个团子原或子数荷电带所化(1)a :表示有a 个R 粒子(原子、分子、离子)例:2H 表示两个氢原子;2H 2表示两个氢分子;2H +表示两个氢离子。
(2)b :表示一个粒子中含有b 个原子例:CO 2中的“2”表示一个二氧化碳分子中含有2个氧原子。
(3)c :表示一个R 离子带c 个正(或负)电荷例:Mg 2+中的“2”表示一个镁离子带2个单位的正电荷。
(4)d :表示(某化合物中)R 元素的化合价为±d 价例:FeO +2中的“2”表示氧化亚铁中,铁元素的化合价为+2价。
【解题技巧】1. 理解和熟记微粒的基本性质及相关的知识,需要根据所给的问题情景或图表信息等结合所学的知识及自己的生活经验细致地分析推理后,按照题目要求进行解答。
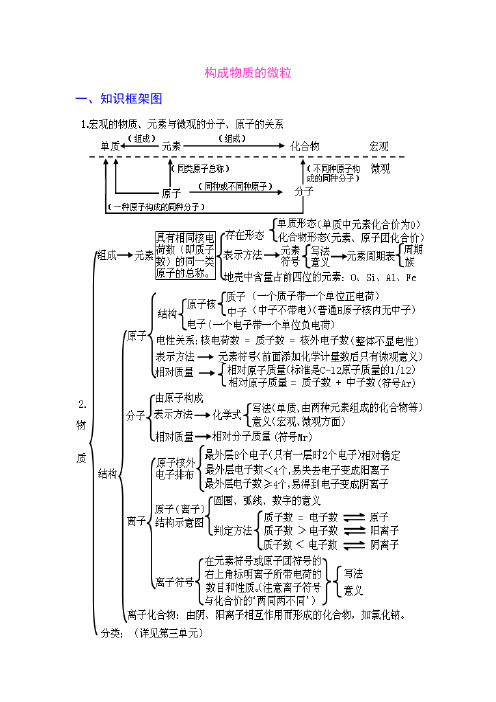
构成物质的微粒一、知识框架图二、学生应该掌握的核心知识构成物质的微粒(一)、概述微观的粒子有:原子、离子、分子、电子、质子等,它们都是微观概念,既表示种类又可表示个数。
分子、原子、离子都是构成物质的粒子。
A 、金属单质和稀有气体由原子直接构成;B 、非金属单质、非金属与非金属形成的化合物由分子构成。
C 、化合物中既有金属元素又有非金属元素的离子化合物是由离子构成。
(二)、分子:分子是保持物质化学性质的最小粒子。
分子由原子构成。
例:1个水分子由2个氢原子和1个氧原子构成A 、分子是构成物质的一种微粒,常见由分子构成的物质:水、氢气、氧气、氮气、二氧化硫、二氧化碳等。
【由分子构成的物质,在物理变化中,分子本身不发生改变;在化学变化中,分子本身发生改变,生成新的分子。
】B 、分子的微观特性:分子总是在不断地运动着;分子之间存在间隔;分子的质量很小。
(三)、原子:1、原子是构成物质的另一种微粒。
原子构成分子,原子也可直接构成物质,如金属汞、稀有气体等。
2、在化学变化中,分子本身发生变化,而原子本身没有变化,只是重新组合成新的分子,构成新的物质,所以,原子是化学变化中的最小粒子。
(注意:原子不是构成物质的最小粒子。
)化学反应的实质:在化学反应中分子分裂为原子,原子重新组合成新的分子。
(四)、相对原子质量:以一种碳原子(碳-12)质量的1/12作为标准,其他原子的质量跟它相比较所得的数值,是该种原子的相对原子质量。
相对原子质量=一个碳原子的质量一个某原子的质量×12 (相对原子质量是个比,单位为1)相对原子质量≈质子数 +中子数 (五)、原子的构成原子的的构成:原子由核外带负电的电子和带正电的原子核构成,原子核由带正电的质子 和不带电的中子构成。
在不显电性的粒子里: 核电荷数=质子数=核外电子数注意:原子不是构成物质的最小粒子。
原子只是化学变化中的最小粒子; 普通氢原子核中只有质子无中子,氢原子的原子核就是一个质子。

原子的构成、微粒结构示意图(人教版)一、单选题(共10道,每道10分)1.下列粒子不显电性的是( )A.质子B.电子C.原子核D.中子答案:D解题思路:A.每个质子带1个单位的正电荷,所以质子显正电性,A错误;B.每个电子带1个单位的负电荷,所以电子显负电性,B错误;C.原子核是由质子和中子构成的,质子带正电,中子不带电,所以原子核带正电,显正电性,C错误;D.中子不带电,不显电性,D正确。
故选D。
试题难度:三颗星知识点:原子的构成2.下列有关原子的说法正确的是( )A.原子是最小的粒子,不可再分B.原子质量主要集中在原子核上C.原子中的质子数与中子数一定相等D.原子中一定含有质子、中子、电子三种粒子答案:B解题思路:A.原子只是在化学变化中不可再分,但原子是有内部结构的,原子分为原子核和核外电子,A错误;B.与质子、中子相比,电子的质量很小,可以忽略不计,故原子质量主要集中在原子核上,B正确;C.原子的质子数等于电子数,质子数与中子数没有关系,C错误;D.构成原子的基本微粒是质子、中子和电子,但有的原子没有中子,如氢原子,D错误。
故选B。
试题难度:三颗星知识点:原子的构成3.核电站常用的某种核原料的原子中含一个质子、二个中子。
对于该原子,下列说法正确的是( )A.该原子核电荷数为2B.该原子核外有2个电子C.该原子是一种氢原子D.该原子核带3个单位正电荷答案:C解题思路:在原子中,核电荷数=质子数=核外电子数。
该原子中含一个质子,核电荷数和核外电子数均为1,原子核带的电荷数即核电荷数,所以A、B、D错误;氢原子的质子数为1,该原子是一种氢原子,故选C。
试题难度:三颗星知识点:原子的构成4.已知碘-131的原子核内质子数为53,质子数与中子数之和为131,则下列关于该原子的说法正确的是( )A.中子数为88B.核外电子数为53C.核电荷数为131D.1个该原子的质量为131g答案:B解题思路:在原子中,核电荷数=质子数=核外电子数,相对分子质量≈质子数+中子数。

中考化学专项复习之微粒结构示意图练习汇总(十一)1.如图所示,①②③④⑤分别是五种微观粒子的结构示意图,下列说法不正确的是()A.①中x=8B.五种粒子共表示4种元素C.五种微观粒子中属于阳离子的是③D.①、②、⑤的化学性质相似2.2020年6月23日我国的北斗导航“收官之星”在西昌发射成功,北斗导航卫星系统采用铷原子钟提供精确时间,铷元素在元素周期表中的相关信息与铷原子的原子结构示意图如图所示。
下列说法正确的是()A.铷属于非金属元素B.m的值是37,n的值是1C.铷的相对原子质量为85.47gD.氯化物的化学式为RbCl23.如图是某粒子的结构示意图,下列关于该粒子的叙述中,不合理的是()A.该粒子属于非金属元素B.该粒子的一个原子核外有17个电子C.该粒子的一个阴离子含有18个质子D.该粒子在发生化学变化时易得到电子4.如图所示为几种粒子的结构示意图,下列相关说法中,正确的是()A.微粒甲在化学反应中易失电子B.微粒乙易获得电子变成阳离子C.微粒丙是非金属元素的原子D.微粒丁化学性质比较活泼5.镓(Ga)是灰蓝色或银白色的金属,主要用于电子工业和通讯领域,是制取各种镓化合物半导体的原料。
如图是元素周期表中提供的镓元素的部分信息及镓原子的结构示意图。
下列说法错误的是()A.镓原子在化学反应中易失电子B.镓元素质子数为31C.镓的相对原子质量为69.72D.镓元素的氧化物的化学式GaO6.根据下列四种微粒的结构示意图,判断正确的是()A.①③表示的是原子B.③④化学性质相同C.②③具有相对稳定的结构D.它们表示四种元素7.铷可用于制造特种玻璃,它在元素周期表中的相关信息和原子结构示意图如图所示,下列说法正确的是()A.铷元素属于非金属元素B.铷元素的相对原子质量为85.468gC.铷元素的原子序数为37D.铷元素在化学变化中容易得到电子8.如图是元素周期表中提供的碳元素的部分信息及碘原子的结构示意图。
2015年化学中考试题分类汇编微粒的结构示意图一.选择题1.(2015•毕节市)某微粒的结构示意图如图所示,下列有关该微粒的说法错误的是()该微粒的原子核内有11个质子A.该微粒在化学反应中易失去1个电子B.该微粒的原子核外有3个电子层C.该图表示的微粒是一种离子D.考点:原子结构示意图与离子结构示意图;原子和离子的相互转化.专题:微观粒子模拟图型.分析:由题目中“某微粒的结构示意图”可知,根据“原子序数=核内质子数=核外电子数=核电荷数”,可判断:该微粒的原子核内质子数;得失电子难易程度;该微粒的原子核外有3个电子层等.解答:解:A、由微粒的结构示意图可知,该微粒的原子核内质子数为11个,故A正确;B、该微粒最外层电子数为1,在化学反应中易失去1个电子,故B正确;C、该微粒的原子核外有3个电子层,说法正确,故C正确;D、根据原子“核内质子数=核外电子数”,可知该图表示的微粒是一种原子,而非离子,故D说法错误.故选D.点评:了解原子和离子的相互转化;了解原子结构示意图与离子结构示意图的特点.二.解答题1.(2015•益阳)人教版九年级化学上册教材图3﹣12部分原子的结构示意图如下:请回答:(1)氧元素与硫元素化学性质相似的原因是两种原子的最外层电子数相同;(2)写出11号和17号元素组成化合物的化学式NaCl;(3)同一周期(横行)的原子结构示意图具有共同的特点是电子层数相同(任写一点).考点:原子结构示意图与离子结构示意图;核外电子在化学反应中的作用.专题:化学用语和质量守恒定律.分析:(1)根据元素的性质与最外层电子数的关系分析;(2)根据两种元素的化合价可以写出其组成化合物的化学式;(3)根据原子结构示意图的特点分析.解答:解:(1)由于元素的性质主要由最外层的电子数决定的,氧元素与硫元素化学性质相似的原因是:两种原子的最外层电子数相同;(2)原子序数为11元素为钠元素,原子序数为17的元素为氯元素,钠为+1价,氯为﹣1价,故组成化合物的化学式为NaCl.(3)由原子结构示意图的特点可以看出,同一周期(横行)的原子结构示意图具有共同的特点是电子层数相同等.故答为:(1)两种原子的最外层电子数相同;(2)NaCl;(3)电子层数相同;点评:本题难度不大,考查学生对原子结构示意图及其意义的理解,了解原子结构示意图的意义是正确解题的关键.2.(2015•株洲)如图中A、B、C、D是四种粒子的结构示意图.请回答下列问题:(1)A中x=2;A粒子的化学式是S2﹣.(2)由B粒子的结构示意图可知,B粒子的名称是铝原子.(3)以上四种结构示意图所表示的粒子中,表示离子的是AD(填字母代号).考点:原子结构示意图与离子结构示意图.专题:化学用语和质量守恒定律.分析:(1)根据粒子核外第一层上有2个电子,据此进行分析解答.(2)由B粒子的结构示意图可知,质子数=核外电子数=13,为铝原子,据此进行分析解答.(3)根据当质子数=核外电子数,为原子;当质子数>核外电子数,为阳离子;当质子数<核外电子数,为阴离子;据此进行分析解答.解答:解:(1)粒子核外第一层上有2个电子,则x=2;A粒子质子数=16,核外电子数=18,质子数<核外电子数,为带2个单位负电荷的硫离子,其离子符号为:S2﹣.(2)由B粒子的结构示意图可知,质子数=核外电子数=13,为铝原子.(3)图中四种结构示意图所表示的粒子中,A质子数=16,核外电子数=18,质子数<核外电子数,为阴离子;B质子数=核外电子数=13,为原子;C质子数=核外电子数=8,为原子;D质子数=9,核外电子数=10,质子数<核外电子数,为阴离子.故答案为:(1)2;S2﹣;(2)铝原子;(3)AD.点评:本题难度不大,考查学生对粒子结构示意图及其意义的理解,明确粒子中核内质子数和核外电子数之间的关系是解题的关键.3.(2015•荆州)某粒子的结构示意图为(其中n≠0),请回答下列问题.(1)n的最大值为8.(2)若该粒子带两个单位的负电荷,则其对应的化学符号为S2﹣;由+6价的该元素形成的常见酸的化学式为H2SO4.(3)若m﹣n=10,则该粒子对应的常见金属元素有Na、Mg、Al(写元素符号).考点:原子结构示意图与离子结构示意图.专题:化学用语和质量守恒定律.分析:根据已有的原子结构示意图的知识进行分析解答,原子的最外层电子最多是8个,原子可以得失电子形成阴阳离子,据此解答即可.解答:解:(1)原子的最外层电子最多是8个,故n的最大值是8,故填:8;(2)该粒子带两个单位的负电荷,则是得2个电子形成的,故原子核内的质子数是16,表示的是硫离子,由+6价的该元素形成的常见酸是硫酸,故填:S2﹣,H2SO4;(3)m﹣n=10,则m=10+n,表示的是原子,常见的金属元素是钠、镁、铝,故填:Na、Mg、Al.点评:本题考查的是原子结构示意图的知识,完成此题,可以依据已有的知识进行.4.(2015•乌鲁木齐)如图为六种常见元素的原子结构示意图,依据图中信息回答下列问题:(1)上述六种元素中属于金属元素的是钠、铝(填元素名称),己元素的化学性质与丙(填元素符号)元素相似.(2)在化学反应中,戊元素的原子容易失去(填“失去”或得到)电子形成阳离子,该元素的离子符号是Al3+.该元素单质与氧气反应的化学方程式是4Al+3O2═2Al2O3.(3)甲、乙元素和碳元素、氧元素组成的一种常见氮肥的化学式为:NH4HCO3[CO(NH2)2].考点:原子结构示意图与离子结构示意图.专题:化学用语和质量守恒定律.分(1)根据核内质子数判断元素及元素的类别;元素的化学性质与最外层电子数关析:系密切,所以找最外层电子数为“7”的元素;(2)根据戊元素的原子的最外层电子数目的特点分析,写出反应的化学方程式;(3)根据甲、乙元素和碳元素、氧元素组成的物质及常见的化肥的种类分析回答.解答:解:(1)由微粒的核内质子数可知,上述六种元素中丁、戊的质子数分别是11、13,分别是钠、铝,属于金属元素,由于己原子的最外层电子数与丙原子的元素的电子数相同都是7,化学性质相似.(2)戊元素的原子的最外层电子数是3,小于4,容易失去电子形成阳离子,质子数是13,该元素的离子是铝离子,符号是Al3+.该元素单质是铝与氧气反应生成了氧化铝,化学方程式是:4Al+3O2═2Al2O3.(3)甲、乙元素分别是氢元素、氮元素,和碳元素、氧元素组成的常见氮肥的为碳酸氢铵和尿素,化学式为:NH4HCO3、CO(NH2)2.故答为:(1)钠、铝,丙.(2)失去,Al3+.4Al+3O2═2Al2O3;(3)NH4HCO3[CO (NH2)2].点评:了解原子结构示意图与离子结构示意图的区别和联系;掌握核外电子在化学变化中的作用和得失电子的规律特点;5.(2015•威海)21世纪的能源金属﹣锂(Li)金属锂,被誉“21世纪的能源金属”,当前手机中广泛使用的电池,主要是高能锂电池.请回答下列问题:(1)锂原子的原子结构示意图如图所示;锂原子在化学反应中容易(填“得到”或“失去”)失去电子变成离子,其离子符号为Li+.(2)研究表明,锂的金属活动性比较活泼.写出金属锂与稀硫酸反应的化学方程式2Li+H2SO4=Li2SO4+H2↑.(3)金属锂除了制造锂电池外,还可以用于储存氢气,其原理是金属锂与氢气化合生成白色粉末状的氢化锂(LiH),氢化锂与水反应生成氢氧化锂和氢气.写出上述过程中发生反应的化学方程式2Li+2H2O=2LiOH+H2↑.考点:原子结构示意图与离子结构示意图;金属的化学性质;书写化学方程式、文字表达式、电离方程式.专题:化学用语和质量守恒定律.分析:(1)最外层电子数多于4个易的电子,少于4个易失去电子;再根据离子的写法和化学式的写法考虑.(2)锂是一种活动性比铁强的金属,锂与稀硫酸反应生成硫酸锂和氢气,写出反应的化学方程式即可.(3)根据“锂遇水会与水反应生成氢气和氢氧化锂[LiOH],”则可书写其化学方程式解答:解:(1)最外层电子数是1,所以失去一个电子,带一个单位正电荷,写在锂元素的右上角数字在前,正负号在后,由于数字是1要省略不写;(2)锂是一种活动性比铁强的金属,锂与稀硫酸反应生成硫酸锂和氢气,反应的化学方程式为:2Li+H2SO4=Li2SO4+H2↑;(3)根据“锂金属锂与氢气化合生成白色粉末状的氢化锂(LiH),氢化锂与水反应生成氢氧化锂和氢气”则可书写其化学方程式为2Li+2H2O=2LiOH+H2↑;故答案为:(1)失去、Li+;(2)2Li+H2SO4=Li2SO4+H2↑;(3)2Li+2H2O=2LiOH+H2↑点评:由题意,找出反应物和生成物、反应条件,根据质量守恒定律,正确书写化学方程式;了解化学性质与物理性质的差别及其应用.6.(2015•宿迁)如图A是某金属元素形成微粒的结构示意图:该金属在空气中燃烧时放出大量的热并发出耀眼的白光,图B是该反应的微观示意图.请根据以上信息回答下列问题:(1)该金属元素原子核外电子数=12,图A所示微粒的符号为Mg2+;写出一种与图A所示具有相同电子层结构的阴离子的符号O2﹣.(2)图B所示的化学方程式:2Mg+O22MgO.考原子结构示意图与离子结构示意图;微粒观点及模型图的应用;书写化学方程式、点:文字表达式、电离方程式.专题:化学用语和质量守恒定律.分析:(1)根据在原子中核内质子数等于核外电子数分析该金属元素原子核外电子数,根据微粒的结构示意图写出粒子的符号;(2)根据反应的微观示意图,分析反应物、生成物,写出反应的化学方程式解答:解:(1)由该微粒的结构示意图可知,该金属元素原子核内质子数是12,在原子中核内质子数等于核外电子数,所以.该金属元素原子核外电子数是12;图一所示微粒是镁离子,符号为:Mg2+.与图A所示具有相同电子层结构的阴离子如氧离子,符号为:O2﹣;(2)由反应的微观示意图可知.该反应是镁与氧气反应生成了氧化镁,反应的化学方程式是:2Mg+O 22MgO.故答案为:(1)12,Mg2+;O2﹣;(2)2Mg+O 22MgO.点评:本题主要考查了结构示意图、反应的微观示意图.理解图示的意义是解答本类题的基础.7.(2015•武汉)如图1为某元素的原子结构示意图,利用该元素组成的单质可测定空气中氧气的含量,实验装置如图2所示.(1)该元素原子的核电荷数为15,在化学反应中该原子易得到电子;(2)图2所示装置中发生反应的化学方程式为4P+5O22P2O5.考点:原子结构示意图与离子结构示意图;空气组成的测定;书写化学方程式、文字表达式、电离方程式.专化学用语和质量守恒定律;空气与水.题:分析:(1)原子结构示意图中,圆圈内数字表示核内质子数(即核电荷数),弧线表示电子层,弧线上的数字表示该层上的电子数,离圆圈最远的弧线表示最外层.若最外层电子数≥4,在化学反应中易得电子,若最外层电子数<4,在化学反应中易失去电子.(2)该元素的核电荷数为15,为磷元素,可形成单质红磷,可用于测定空气中氧气的含量,红磷燃烧生成五氧化二磷,写出反应的化学方程式即可.解答:解:(1)由某元素的原子结构示意图,圆圈内的数字是15,该元素原子的核电荷数为15;最外层电子数是5,在化学反应中易得到3个电子而形成阴离子.(2)该元素的核电荷数为15,为磷元素,可形成单质红磷,可用于测定空气中氧气的含量,红磷燃烧生成五氧化二磷,反应的化学方程式为:4P+5O 22P2O5.故答案为:(1)15;得到;(2)4P+5O 22P2O5.点评:本题难度不大,掌握原子结构示意图的含义、化学方程式的书写方法等是正确解答本题的关键.8.(2015•菏泽)有A、B、C、D四种元素,其原子结构示意图如图:(1)D元素的名称为硫,D元素与图中B(填写字母序号)元素的化学性质相似,D元素的离子符号为S2﹣.(2)A、B、C三种元素能形成一种化合物,其水溶液的pH>7(填>、<、=)(3)A、B两种元素的原子以1:1的比例形成的化合物为(写化学式)H2O2,其中B元素化合价为﹣1.考点:原子结构示意图与离子结构示意图;溶液的酸碱性与pH值的关系.专题:化学用语和质量守恒定律.分析:(1)D元素的原子核内质子数为16,元素的化学性质跟它的原子的最外层电子数目关系非常密切,最外层电子数相同的元素化学性质相似,据此进行分析解答.(2)A、B、C三种元素分别是氢元素、氧元素、钠元素,据形成的化合物为氢氧化钠,据此进行分析解答.(3)A、B元素分别是氢元素、氧元素,A、B两种元素的原子以1:1的比例形成的化合物为过氧化氢,据此结合在化合物中正负化合价代数和为零,进行分析解答.解答:解:(1)D元素的原子核内质子数为16,为硫元素;决定元素化学性质的是最外层电子数,原子的最外层电子数相同,具有相似的化学性质,D元素的原子最外层电子数为6,B元素最外层电子数也为6,故具有相似的化学性质.D原子的最外层电子数是6,大于4,在化学反应中易得到2个电子而形成带2个单位负电荷的硫离子,其离子符号为:S2﹣.(2)A、B、C三种元素分别是氢元素、氧元素、钠元素,据形成的化合物为氢氧化钠,显碱性,其水溶液的pH>7.(3)A、B元素分别是氢元素、氧元素,A、B两种元素的原子以1:1的比例形成的化合物为过氧化氢,其化学式为H2O2;氢元素显+1价,设氧元素的化合价是x,根据在化合物中正负化合价代数和为零,可得:(+1)×2+2x=0,则x=﹣1价.故答案为:(1)硫;B;S2﹣;(2)>;(3)H2O2;﹣1.点评:本题难度不大,考查学生对原子结构示意图及其意义的理解,明确原子结构示意图中最外层电子数与得失电子的关系是解题的关键.9.(2015•重庆)学习化学后,我们学会了从微观角度认识物质.(1)已知碳原子和氧原子的结构示意图分别为:和,两种原子中相等的是C(填序号).A.质子数B.电子数C.第一层电子数D.第二层电子数(2)保持一氧化碳化学性质的粒子名称是一氧化碳分子.(3)如图是一氧化碳与氧气反应的微观模型图,请在如图框中以图示的方式完成该化学反应的微观过程(图中●表示氧原子,○表示碳原子).考点:原子结构示意图与离子结构示意图;微粒观点及模型图的应用.专题:化学反应模拟图型;化学用语和质量守恒定律.分析:(1)根据碳原子和氧原子的结构示意图解答;(2)一氧化碳是由二氧化碳分子构成的,据此解答;(3)根据质量守恒定律反应前后原子种类和数目不变分析解答.解答:解:(1)观察原子结构示意图可以发现,第一层电子数相同,故选:C;(2)保持一氧化碳化学性质的粒子是一氧化碳分子;(3)根据反应前后原子种类和数目不变可知:反应后有两个碳原子,四个氧原子,反应前有二个氧原子,所以空白处有2个一氧化碳分子.故答案为:(1)C;(2)一氧化碳分子;(3).点评:解答本题要充分理解图中提供的信息,只有这样才能确定物质的构成及种类,也才能正确的判断物质的化学式、反应的方程式.10.(2015•娄底)据《自然》杂志报道,科学家最近研究出一种以锶(Sr)做钟摆的钟,它是世界上最精确的钟,锶的原子结构示意图如右图所示,请回答:(1)锶原子的核电荷数为38.(2)锶原子核外电子层数为5.(3)锶原子最外层容易失电子.(填“得”或“失”)考点:原子结构示意图与离子结构示意图.专题:化学用语和质量守恒定律.分析:根据原子结构示意图的意义分析,最外层电子数决定元素的化学性质,当最外层电子数小于4个时,在发生化学反应时易失去最外层电子数达到8个电子的稳定结构.解答:解:(1)由锶的原子结构示意图可知,锶原子的质子数是38,即核电荷数为38.(2)由锶的原子结构示意图可知,锶原子核外电子层数为5.(3)由锶的原子结构示意图可知,最外层为2个电子,小于4,在发生化学反应时,易失去2个电子形成带2个单位的带电荷的离子.故答案为:(1)38;(2)5;(3)失.点评:本题难度不大,考查学生对原子结构示意图及其意义的理解,了解原子结构示意图的意义是正确解题的关键.11.(2015•日照)钙元素是构成人体的重要组分,它使得骨髓和牙齿具有坚硬的结构支架.如图①是钙原子的结构示意图请回答下列问题:(1)①中x=8(2)图中A、B、C、D四种粒子属于3种元素(3)C元素与D元素组成化合物的化学式是MgF2(4)A、B、C、D四种粒子中与图①所示的钙元素化学性质相似的是D(填“A”、“B”、“C”或“D”)考点:原子结构示意图与离子结构示意图;核外电子在化学反应中的作用.专题:化学用语和质量守恒定律.分析:(1)由原子中质子数=核外电子数,进行分析解答.(2)元素是质子数(即核电荷数)相同的一类原子的总称,同种元素的粒子是质子数相同,据此进行分析解答.(3)C元素与D元素的核内质子数分别是9、12,分别为氟元素、镁元素,据此进行分析解答.(4)根据元素的化学性质跟它的原子的最外层电子数目关系非常密切,最外层电子数相同的元素化学性质相似,据此进行分析解答.解答:解:(1)原子中质子数=核外电子数,则20=2+8+x+2 x=8.(2)图中A、B、C、D四种粒子的核内质子数分别是2、12、9、12,B和D核内质子数相同,属于同一种元素,图中共表示3种元素.(3)C元素与D元素的核内质子数分别是9、12,分别为氟元素、镁元素;氟原子的最外层电子数为7,在化学反应中易得到1个电子而形成带1个单位负电荷的阴离子,化合价的数值等于离子所带电荷的数值,且符号一致,则该元素的化合价为﹣1价;镁原子的最外层电子数为2,在化学反应中易失去2个电子而形成带2个单位正电荷的阳离子,则该元素的化合价为+2价;写出化合物的化学式为MgF2.(4)决定元素化学性质的是最外层电子数,原子的最外层电子数相同,具有相似的化学性质;由图①可知,该粒子的最外层电子数为2,则与其化学性质相似的粒子结构示意图中最外层电子数也应为2.A中原子的最外层电子数为2,但其核外只有一个电子层,属于稀有气体元素的原子,化学性质稳定;D的最外层电子数为2,与图①所示的钙元素化学性质相似.故答案为:(1)8;(2)3;(3)MgF2;(4)D.点评:本题难度不大,考查学生对粒子结构示意图及其意义的理解,明确粒子中核内质子数和核外电子数之间的关系是解题的关键.12.(2015•重庆)氧化铝是红宝石、蓝宝石的主要成份,它由铝离子和氧离子构成.(1)氧化铝的化学式为Al2O3.(2)3个铝离子的化学符号是3Al3+.(3)氧离子的结构示意图为,一个氧离子中有8个质子.考点:原子结构示意图与离子结构示意图;化学式的书写及意义.专题:化学用语和质量守恒定律.分析:(1)氧化铝中铝元素显+3价,氧元素显﹣2价,写出其化学式即可.(2)离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字.(3)粒子结构示意图中,圆圈内数字表示核内质子数,据此进行分析解答.解答:解:(1)氧化铝中铝元素显+3价,氧元素显﹣2价,其化学式为:Al2O3.(2)由离子的表示方法,在表示该离子的元素符号右上角,标出该离子所带的正负电荷数,数字在前,正负符号在后,带1个电荷时,1要省略.若表示多个该离子,就在其离子符号前加上相应的数字.3个铝离子可表示为3Al3+.(3)粒子结构示意图中,圆圈内数字表示核内质子数,由氧离子的结构示意图,圆圈内的数字是8,则一个氧离子中有8个质子.故答案为:(1)Al2O3;(2)3Al3+;(3)8.点评:本题难度不大,掌握常见化学用语(化学式、粒子结构示意图、离子符号等)的书写方法、注意离子符号与化合价表示方法的区别等是正确解答此类题的关键.13.(2015•攀枝花)如图为六种原子的结构示意图.请回答下列问题:(1)图中六种元素之间的最本质区别是质子数不同;(2)镁原子在化学反应中容易失去2个电子形成镁离子,镁离子的化学式为Mg2+;氧化钠由钠离子和氧离子构成,氧化钠的化学式为Na2O.(3)从原子结构上分析,图中哪两组元素具有相似的化学性质(填元素符号)Cl、I.(4)在上述碘的原子结构示意图中,x=18.考点:原子结构示意图与离子结构示意图.专题:化学用语和质量守恒定律.分析:(1)根据元素的定义分析;(2)根据离子符号、化学式的写法书写;(3)根据元素的性质与原子的最外层的电子数的关系分析;(4)根据在原子中核内质子数等于核外电子数分析.解答:解:(1)元素之间的最本质区别是质子数不同;(2)镁原子在化学反应中容易失去2个电子形成镁离子,镁离子的化学式为Mg2+;氧化钠由钠离子和氧离子构成,氧显﹣2价,钠为+1价,所以氧化钠的化学式为:Na2O.(3)从原子结构上分析,氯与碘原子的最外层的电子数相同,元素具有相似的化学性质,元素符号分别为:Cl、I.(4)由于在原子中核内质子数等于核外电子数,在上述碘的原子结构示意图中,x=53﹣2﹣8﹣18﹣7=18.故答为:(1)质子数不同(2)Mg2+,Na2O.,(3)Cl、I.(4)18.点评:本题考查学生对原子结构示意图的特点的理解与掌握,并能在解题中灵活应用.14.(2015•十堰)M 元素的一种粒子结构示意图是.(1)若M 元素组成的单质是空气的成分之一,约占空气总体积的,则该单质是氧气.(2)元素的化学性质与其原子的最外层电子数年有关.若x=9,M元素与下列②(填序号)的元素化学性质相似.(3)若x=7,M元素的这种粒子可与上图中的一种粒子相互作用形成化合物,该化合物由离子构成.写出该化合物的化学式Mg3N2.考点:原子结构示意图与离子结构示意图;化学式的书写及意义.专题:化学用语和质量守恒定律.分析:(1)根据M元素的单质是空气的重要组成部分,约占空气总体积的1/5的是氧气;(2)元素原子的最外层电子数相同,具有相似的化学性质.x=9,M元素的原子最外层电子数为7,则可知答案.(3)根据离子化合物是由阴阳离子构成的来分析.解答:解:(1)M元素的单质是空气的重要组成部分,约占空气总体积的1/5的是氧气;(2)元素原子的最外层电子数相同,具有相似的化学性质.x=9,M元素的原子最外层电子数为7,则与它具有相似的化学性质的元素的原子最外层电子数也应为7,故选②.(3)若x=7,M元素的这种粒子为带3个单位负电荷的氮离子,可与上图中的③表示的带两个单位正电荷的镁离子形成离子化合物氮化镁;故答为:(1)氧气;(2)②;(3)Mg3N2.点评:本题难度不大,考查学生对原子结构示意图及其意义的理解,了解原子结构示意图的意义是正确解题的关键.15.(2015•邵阳)根据下列粒子结构示意图,回答问题.(1)图A、B、C、D四种粒子共表示三种元素.(2)D原子在化学反应中易得(填“得”或“失”)电子.(3)由C元素和D元素组成化合物的化学式为MgCl2.考点:原子结构示意图与离子结构示意图;化学式的书写及意义.专题:化学用语和质量守恒定律.分析:(1)根据元素的种类是由原子核内的质子数决定的分析;(2)根据元素的原子得失电子和最外层电子数的关系分析;(3)根据原子最外层电子数得失的特点判断元素的化合价,书写化学式.解答:解:(1)元素种类是由原子内的质子数决定的,质子数相同,就属于同种元素,因此AC是同种元素,因此四种粒子共表示三种元素;故填:三种;(2)最外层电子数≥4的易得到电子,D原子的最外层电子数是7,容易得到一个电子达到8个电子的稳定结构;故填:得;(3)由题目中的粒子结构示意图,C元素是镁元素,最外层电子数是2容易失去2个电子达到8个电子的稳定结构,形成的化合价是+2,D元素是氯元素,最外层电子数是7容易得1个电子达到8个电子的稳定结构,形成的化合价是﹣1,故形成的化合物是氯化镁,故填:MgCl2.点评:本题难度不大,考查学生对粒子结构示意图及其意义的理解,明确粒子中核内质子数和核外电子数之间的关系是解题的关键.。
化学|微粒结构示意图其实不难
你明白各部分的含义后,解题时就信手拈来!!【应用一】判断微粒的类别(微粒结构示意图可用来表示原子或离子,但怎样判断究竟是离子还是原子)解题钥匙:n=a+ b+ c 表示原子n>a+ b+ c 表示阳离子n<a+ b+ c 表示阴离子【应用二】判断微粒属于金属元素还是非金属元素解题钥匙:最外层电子数小于4,一般为金属元素,大于等于4,一般为非金属元素。
【应用三】判断其结构是否相对稳定解题钥匙:相对稳定结构是指最外层电子数为8(只有一个电子层时为2)的结构。
【应用四】判断其得失电子的能力解题钥匙:c<4,易失去电子;4<c<8,易得到电子。
【应用五】判断化学性质是否相似解题钥匙:最外层电子数相同的原子,其化学性质相似。
【应用六】判断是否属于同种元素解题钥匙:核内质子数相同的微粒属于同种元素。
小试牛刀1. 某微粒的结构示意图如图所示,下列有关微粒的说法错误的是()A. 该微粒的原子核内有11个质子B. 该微粒在化学反应中易失去1个电子C. 该微粒的原子核外有3个电子层D. 该图表示的微粒是一种离子2. 根据粒子结构示意图给出的信息,下列说法正确的是()A. ①②③表示的是同种原子B. ②表示阳离子C. ①②③都是原子失电子后形成的粒子D. ①②表示的粒子的性质一定相
同3. 如图中A、B、C、D是四种粒子的结构示意图。
请回答下列问题:(1)A中x=_____;A粒子的化学式是
___________。
(2)由B粒子的结构示意图可知,B粒子的名称是_____。
(3)以上四种结构示意图所表示的粒子中,结构相对稳定的是_____(填字母代号)。
【参考答案】1.D 2.B3.(1)2 S2- (2)铝(3)A、D。