有关元素化合物间反应先后顺序的图像题
- 格式:docx
- 大小:159.43 KB
- 文档页数:5

一、中考初中化学金属及酸碱盐反应的图像1.现有盐酸和氯化铜的混合溶液,向其中逐滴加入氢氧化钠溶液直至过量,根据实验事实绘制如图所示曲线。
其中说法正确的是( )A .a→b 段产生 Cu(OH)2的质量不断增大,故溶质质量增大B .c→d 段溶液的pH 不变C .整个过程中氯化钠的质量一直在不断增大D .a 点、d 点对应溶液中所含溶质均为两种【答案】D【解析】【分析】向盐酸和氯化铜的混合溶液滴加氢氧化钠溶液至过量时,发生的反应的选后顺序是2HCl+NaOH=NaCl+H O 、22CuCl +2NaOH=2NaCl+Cu(OH) 。
【详解】A 、a→b 段溶质质量增加,是因为盐酸与氢氧化钠反应生成氯化钠,生成的氯化钠的质量大于参加反应的氯化氢的质量,没有Cu(OH)2生成,A 不正确;B 、c 点代表氢氧化钠与氯化铜刚好完全反应,则c→d 段溶液中氢氧化钠不断增加,溶液碱性越来越强,溶液的pH 增大,B 不正确;C 、从反应方程式可知,盐酸和氯化铜分别与氢氧化钠反应生成氯化钠,溶液中的氯化钠的质量不断增加,当氢氧化钠过量时,溶液中氯化钠的质量不再增加,C 不正确;D 、a 点表示混合液还末参与反应,溶液中的溶质只有氯化氢和氯化铜两种,d 点表示混合液已经完全反应,氢氧化钠过量,溶液中的溶质有生成的氯化钠和过量的氢氧化钠两种,D 正确。
故选D 。
2.下列图象分别与选项中的操作项对应,其中合理的是( )A.向氢氧化钠溶液中不断加水,溶液的pH与加入水的质量关系B.某温度下,向一定质量的KNO3不饱和溶液中不断地加入KNO3固体C.向一定量FeCl3溶液和稀盐酸的混合溶液中滴加NaOH溶液D.持续不断地加热一定质量的碳酸钙固体【答案】C【解析】【分析】【详解】A、向氢氧化钠溶液中不断加水,溶液的碱性变弱,但溶液始终显碱性,溶液的pH不可能小于或等于7,不符合题意;B、某温度下,向一定质量的KNO3不饱和溶液中不断地加入KNO3固体,硝酸钾能继续溶解,当达到饱和状态后不再发生改变,但KNO3不饱和溶液溶质质量分数不可能为0,即起始值不为0,不符合题意;C、向一定量FeCl3溶液和稀盐酸的混合溶液中滴加NaOH溶液,NaOH先与盐酸反应,开始时不会生成沉淀,盐酸消耗完再与氯化铁反应会生成氢氧化铁沉淀,故沉淀的质量先是零,再不断上升,最后形成一条水平直线,符合题意;D、碳酸钙在高温下分解生成氧化钙和二氧化碳,加热到一定温度才能分解,随着反应的进行,剩余固体的质量逐渐减少,但不可能减少至0,不符合题意。

一、中考初中化学金属及酸碱盐反应的图像1.向甲物质中逐滴加入相应的乙溶液至过量.反应过程中产生的气体或沉淀的质量与加入的乙的质量关系,符合图曲线描述的是()A.甲:铜、锌的混合物乙:稀盐酸B.甲:硝酸和稀硫酸的混合溶液乙:氯化钡溶液C.甲:氢氧化钠和氯化钠的混合溶液乙:稀盐酸D.甲:盐酸和氯化铜的混合溶液乙:氢氧化钠溶液【答案】D【解析】【分析】【详解】A、由于锌和稀盐酸反应一开始就会生成大量的气体,故A错误;B、由于氯化钡和稀硫酸反应会生成难溶于水难溶于酸的沉淀硫酸钡,故B错误;C、向氯化钠和氢氧化钠的混合溶液加入稀盐酸,稀盐酸和氢氧化钠反应生成氯化钠和水,没有气体或沉淀产生,与曲线所示不一致,故C不正确;D、向盐酸和氯化铜的混合溶液加入氢氧化钠溶液,由于盐酸的存在,氢氧化钠不能与氯化铜反应生成了氢氧化铜沉淀。
氢氧化钠先与盐酸反应生成氯化钠和水,既无气体也无沉淀;待盐酸完全反应后,所加入的氢氧化钠开始与氯化铜反应产生氢氧化铜蓝色沉淀至氯化铜完全反应为止;与曲线所示一致,故D正确。
故选D。
2.下列四个图象分别对应四个变化过程的一种趋势,其说法错误的是A.用加热一定质量的氯酸钾和二氧化锰固体混合物的方法制取氧气B.向硝酸银和硝酸铜的混合溶液中加入过量的锌粉C.向氯化钙和盐酸的混合溶液中加入过量的碳酸钠溶液D.向一定量H2SO4和MgCl2的混合溶液中逐滴加入Ba(OH)2溶液至过量【答案】B【解析】【分析】【详解】A. 加热一定质量的氯酸钾和二氧化锰固体混合物制取氧气,当加热一段时间以后,生成氧气、氯化钾,二氧化锰在反应中作催化剂,质量不变。
随着反应的进行,固体质量逐渐减少,所以固体中二氧化锰的质量分数逐渐增大,当氯酸钾完全反应后,固体质量不再减少,所以固体中二氧化锰的质量分数不再增大,此选项正确;B. 金属活动性顺序中,排在前面的金属能将排在后面的金属从其化合物的水溶液中置换出来,且金属活动性差距越大,反应越易发生。
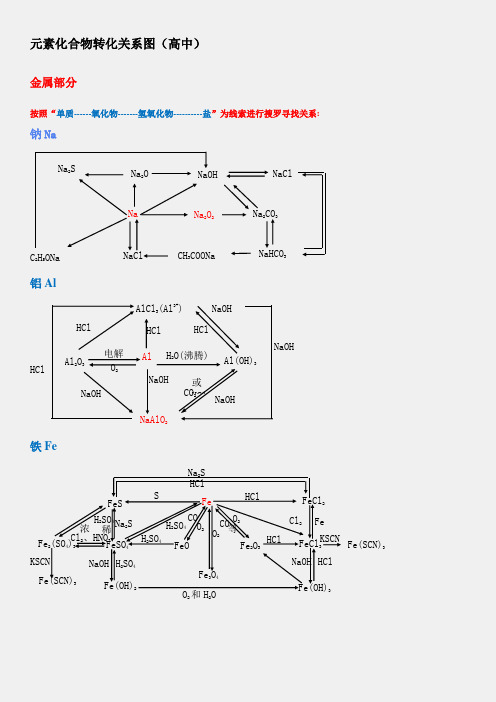
元素化合物转化关系图(高中)金属部分按照“单质------氧化物-------氢氧化物----------盐”为线索进行搜罗寻找关系:钠Na铝Al铁FeNa 2SNa 2ONaOHNaClNa 2CO 3Na 2O 2NaC 2H 5ONaNaCl CH 3COONaNaHCO 3Al 2O 3Al Al(OH)3NaAlO 2AlCl 3(Al 3+)H 2O(沸腾) 电解 O 2HCl NaOHNaOHCO 2或HCl NaOHNaOH HClHClHClNaOH稀 FeFeO FeCl 3 Fe(OH)2FeSFe 2O 3 Fe 3O 4FeCl 2Fe(OH)3 FeSO 4 Fe 2(SO 4)3 Fe(SCN)3 Fe(SCN)3SHClH 2SO 4 O 2 CO 等HCl Cl 2 Fe KSCN KSCN Na 2S H 2SO 4 Cl 2、HNO 3 浓 O 2和H 2ONaOH HClNaOH H 2SO 4H 2SO 4 CO O 2O 2 Na 2S HCl镁Mg铜Cu钙CaMg 3N 2MgOMg(OH)2MgX 2Cl 2CO 2H 2OX 2Mg MgO Mg(OH)2 MgCO 3△ MgCl 2 H 2OH 2ON 2HCl NaOH HCl 电解Mg(HCO 3)2 煅烧O 2HClH 2O CO 2 △或 OH -HCl CuCuO Cu(OH)2Cu 2+(NO 3-、SO42-)Cu 2SNH 3•H 2O[Cu(NH 3)4]2+CuSCu 2ONa 2S SH + HNO 3或H 2SO 4(浓)NaOH O 2 CO 、Al 、H△H +Ca(OH)2HClHCl H 2OHClNa 2CO 3CO 2+H 2OCaCaO CaHPO 4△CaCl 2CaCO 3 CaC 2 C(电炉)Ca(HCO 3)2O 2 H 2OH 3PO 4HClCO 2Ca(ClO)2H 2OCl 2或 CO 2非金属部分按照“化合价”寻找各类物质,主要有氢化物、单质、氧化物、含氧酸、及其盐:氯Cl硫SCl2HCl CH3ClCa(ClO)FeCl3CuCl2PCl3、PCl5NaClOHClOCH2ClCH2ClO 2FeCl2CO2NaClCuCl2H2CH2=CHClHBr NaBrAgBrHI NaIAgIBr2I2ClFeS2S H2S Na2SSO2Na2SO3FeSSO3 Na2SO4BaSO4PbSCuSBaSO3 H2SO3H2SO4氮N碳与硅 C 、SiMg 3N 2N 2NONO 2N 2O 4NH 4Cl NH 3 NaNO3 HNO 3 Cu(NO 3)2[Ag (NH 3)2]+NH 3·H 2O(C 6H 7O 2) NO 2NO 2NO 2 n或 NO 2 Si C SiO 2H 2SiO 3CaSiO3H 4SiO 4Na 2SiO 3 SiH 4 SiF 4 SiCl 4CO 2 CO H 2CO 3 Ca(HCO 3) 2CaCO 3CaC 2CaOCa(OH)2磷P\氢与氧 H 、OPP 2O 5PCl 3PCl 5HPO 3H 3PO 4Na 3PO 4Ca 3(PO 4)2Ca (H 2PO 4)2CaHPO 4 H 2 H 2OO 2CH 3COOHCH 3CH 2OHKMnO 4HgOKClO 3 Na 2O 2H 2SO 4 CH 4ZnNH 4ClNH 3Cu Ca(OH)2Fe 3O 4 SO 2 CO 2+H 2O。

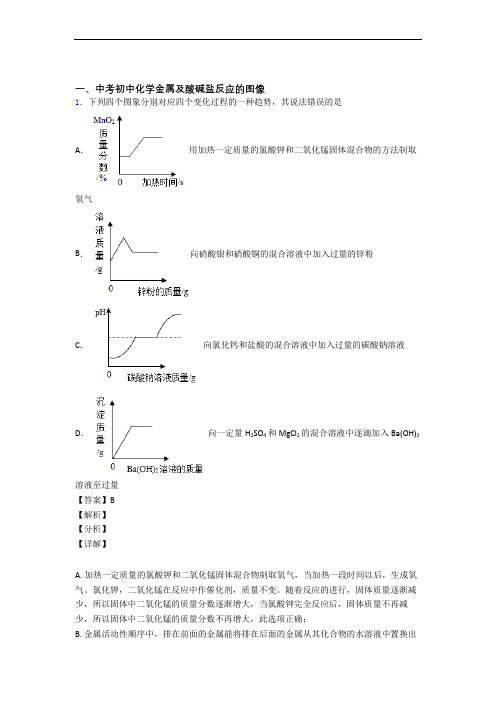
一、中考初中化学金属及酸碱盐反应的图像1.下列四个图象分别对应四个变化过程的一种趋势,其说法错误的是A.用加热一定质量的氯酸钾和二氧化锰固体混合物的方法制取氧气B.向硝酸银和硝酸铜的混合溶液中加入过量的锌粉C.向氯化钙和盐酸的混合溶液中加入过量的碳酸钠溶液D.向一定量H2SO4和MgCl2的混合溶液中逐滴加入Ba(OH)2溶液至过量【答案】B【解析】【分析】【详解】A. 加热一定质量的氯酸钾和二氧化锰固体混合物制取氧气,当加热一段时间以后,生成氧气、氯化钾,二氧化锰在反应中作催化剂,质量不变。
随着反应的进行,固体质量逐渐减少,所以固体中二氧化锰的质量分数逐渐增大,当氯酸钾完全反应后,固体质量不再减少,所以固体中二氧化锰的质量分数不再增大,此选项正确;B. 金属活动性顺序中,排在前面的金属能将排在后面的金属从其化合物的水溶液中置换出来,且金属活动性差距越大,反应越易发生。
向硝酸银和硝酸铜的混合溶液中加入过量的锌粉,锌粉先与硝酸银溶液反应,Zn+2AgNO3=2Ag+Zn(NO3)2,每65份质量的锌能生成216份质量的银,反应后溶液的质量减少,硝酸银完全反应后,锌再和硝酸铜溶液反应,Zn+Cu(NO3)2=Zn(NO3)2+Cu,每65份质量的锌能生成64份质量的铜,溶液质量变大,图像应先降后升,此选项错误;C. 向氯化钙和盐酸的混合溶液中加入过量的碳酸钠溶液,碳酸钠先与盐酸反应,使pH值逐渐变大,盐酸刚好完全反应时,pH=7,再继续滴加过量的碳酸钠溶液,因为碳酸钠溶液显碱性,所以溶液的pH>7,此选项正确;D. 向H2SO4和MgCl2的混合溶液中不断加入Ba(OH)2溶液,氢氧化钠溶液与硫酸、氯化镁都能发生反应生成沉淀,开始时就生成沉淀,当H2SO4和MgCl2完全反应后,再加入Ba(OH)2溶液也不再产生沉淀,故沉淀的质量先是零,再不断上升,最后形成一条水平直线,此选项正确。
故选B。
【点睛】图像问题主要是结合化学反应分析图的起点位置、变化趋势、转折点、终点位置是否正确。

一、中考初中化学金属及酸碱盐反应的图像1.下列图像不能正确反映其对应变化关系的是()A.铁加入硫酸铜溶液的反应B.取一定量打磨后的铝片于容器中,再逐渐加入稀盐酸C.常温下向一定量的稀硫酸滴加氢氧化钠溶液D.温度不变,向饱和的硝酸钾溶液中加入硝酸钾晶体【答案】C【解析】【分析】【详解】A、向一定量硫酸铜溶液中加入不断加入铁粉,铁与硫酸铜反应生成硫酸亚铁和铜,反应方程式为:Fe+CuSO4=Cu+FeSO4,根据化学方程式可知,每56份质量的铁能生成64份质量的铜。
溶液的质量减少,当反应停止时不再减少,该选项对应关系正确;B、随着稀盐酸的不断加入,铝片不断反应,质量不断减小,直至减小到0,该选项对应关系正确;C、常温下向一定量的稀硫酸滴加氢氧化钠溶液,随着氢氧化钠溶液的滴加,水的质量不断增大,该选项对应关系不正确;D、饱和的硝酸钾溶液中不能继续溶解硝酸钾晶体,向一定量饱和硝酸钾溶液中加入硝酸钾晶体时,硝酸钾不能继续溶解,溶质质量分数不变,该选项对应关系正确。
故选C。
2.若向NaOH和Na2CO3的混合溶液中逐滴加入过量稀盐酸,下列图象正确的是()A.B.C.D.【答案】C【解析】【分析】向一定量的氢氧化钠、碳酸钠混合溶液中逐滴滴入稀盐酸,氢氧化钠先和盐酸反应生成氯化钠和水,氢氧化钠反应完后,继续滴加盐酸,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳。
【详解】A、向氢氧化钠和碳酸钠的混合液中加入盐酸,溶液质量一开始就不断增加,故错误;B、向氢氧化钠和碳酸钠的混合液中加入盐酸,这两种物质都会和盐酸反应生成氯化钠,所以氯化钠反应一开始就有,故错误。
C、向氢氧化钠和碳酸钠的混合液中加入盐酸,这两种物质都会和盐酸反应生成氯化钠,开始pH大于7,稀盐酸最后过量,最终溶液的pH将会小于7,故正确;D、向氢氧化钠和碳酸钠的混合液中加入盐酸,盐酸先与氢氧化钠反应,氢氧化钠被消耗完,再与碳酸钠反应,产生二氧化碳,故错误。
故选:C。
一、中考初中化学金属及酸碱盐反应的图像1.向一定量氯化钙和稀盐酸的混合溶液中逐滴加入碳酸钠溶液,反应过程中生成气体或沉淀的质量与加入碳酸钠溶液的质量关系如图所示(氯化钙溶液呈中性)。
对该图像的分析如下:①OP 段发生反应的化学方程式为3322=Na CO +CaCl aCO +2l C NaC ↓②E 、F 点溶液的pH 相同③O 点溶液和G 点溶液的离子种类一样多④与盐酸反应的碳酸钠的质量和与氯化钙反应的碳酸钠的质量相等以上说法中正确的个数有( )A .1个B .2个C .3个D .4个 【答案】C【解析】【分析】碳酸钠与稀盐酸反应生成氯化钠、水和二氧化碳,碳酸钠与氯化钙反应生成碳酸钙和氯化钠。
【详解】①向一定量氯化钙和稀盐酸的混合溶液中逐滴加入碳酸钠溶液,先发生的是碳酸钠与稀盐酸的反应,稀盐酸反应完后,碳酸钠再与氯化钙反应,故OP 段发生反应的化学方程式为23222HCl+Na CO 2NaCl+H O+CO =↑,故①不正确;②E 点溶液中盐酸与加入的碳酸钠恰好完全反应,生成氯化钠,氯化钠和氯化钙溶液都呈中性,F 点溶液中加入的碳酸钠与氯化钙恰好完全反应,生成碳酸钙沉淀和氯化钠,溶液呈中性,故②正确;③O 点溶液中的离子有H +、Cl -、Ca 2+三种,G 点溶液中有Cl -、Na +和CO 32-三种离子,两点溶液中的离子种类一样多,故③正确;④碳酸钠与盐酸反应生成2.2 g 二氧化碳,根据化学方程式2322Na CO +2HCl=2NaCl+H O+CO ↑,生成2.2g 的二氧化碳,需要碳酸钠的质量为5.3 g ,碳酸钠与氯化钙反应生成5.0 g 碳酸钙,根据化学方程式2233=CaCl +Na CO CaCO +2NaCl ↓,生成5.0g 的碳酸钙,需要碳酸钠的质量为5.3g ,与盐酸反应的碳酸钠溶液中溶质的质量和与氯化钙反应的碳酸钠溶液中溶质的质量相等,故④正确。
故选C。
2.只含一种杂质的硫酸溶液M,加入足量的氢氧化钡溶液后,再加足量的稀盐酸,过程如图所示。
一、中考初中化学金属及酸碱盐反应的图像1.下列四个图象分别对应四个变化过程的一种趋势,其说法错误的是A.用加热一定质量的氯酸钾和二氧化锰固体混合物的方法制取氧气B.向硝酸银和硝酸铜的混合溶液中加入过量的锌粉C.向氯化钙和盐酸的混合溶液中加入过量的碳酸钠溶液D.向一定量H2SO4和MgCl2的混合溶液中逐滴加入Ba(OH)2溶液至过量【答案】B【解析】【分析】【详解】A. 加热一定质量的氯酸钾和二氧化锰固体混合物制取氧气,当加热一段时间以后,生成氧气、氯化钾,二氧化锰在反应中作催化剂,质量不变。
随着反应的进行,固体质量逐渐减少,所以固体中二氧化锰的质量分数逐渐增大,当氯酸钾完全反应后,固体质量不再减少,所以固体中二氧化锰的质量分数不再增大,此选项正确;B. 金属活动性顺序中,排在前面的金属能将排在后面的金属从其化合物的水溶液中置换出来,且金属活动性差距越大,反应越易发生。
向硝酸银和硝酸铜的混合溶液中加入过量的锌粉,锌粉先与硝酸银溶液反应,Zn+2AgNO3=2Ag+Zn(NO3)2,每65份质量的锌能生成216份质量的银,反应后溶液的质量减少,硝酸银完全反应后,锌再和硝酸铜溶液反应,Zn+Cu(NO3)2=Zn(NO3)2+Cu,每65份质量的锌能生成64份质量的铜,溶液质量变大,图像应先降后升,此选项错误;C. 向氯化钙和盐酸的混合溶液中加入过量的碳酸钠溶液,碳酸钠先与盐酸反应,使pH值逐渐变大,盐酸刚好完全反应时,pH=7,再继续滴加过量的碳酸钠溶液,因为碳酸钠溶液显碱性,所以溶液的pH>7,此选项正确;D. 向H2SO4和MgCl2的混合溶液中不断加入Ba(OH)2溶液,氢氧化钠溶液与硫酸、氯化镁都能发生反应生成沉淀,开始时就生成沉淀,当H2SO4和MgCl2完全反应后,再加入Ba(OH)2溶液也不再产生沉淀,故沉淀的质量先是零,再不断上升,最后形成一条水平直线,此选项正确。
故选B。
【点睛】图像问题主要是结合化学反应分析图的起点位置、变化趋势、转折点、终点位置是否正确。
一、中考初中化学金属及酸碱盐反应的图像1.下列图像不能正确反映其对应变化关系的是()A.铁加入硫酸铜溶液的反应B.取一定量打磨后的铝片于容器中,再逐渐加入稀盐酸C.常温下向一定量的稀硫酸滴加氢氧化钠溶液D.温度不变,向饱和的硝酸钾溶液中加入硝酸钾晶体【答案】C【解析】【分析】【详解】A、向一定量硫酸铜溶液中加入不断加入铁粉,铁与硫酸铜反应生成硫酸亚铁和铜,反应方程式为:Fe+CuSO4=Cu+FeSO4,根据化学方程式可知,每56份质量的铁能生成64份质量的铜。
溶液的质量减少,当反应停止时不再减少,该选项对应关系正确;B、随着稀盐酸的不断加入,铝片不断反应,质量不断减小,直至减小到0,该选项对应关系正确;C、常温下向一定量的稀硫酸滴加氢氧化钠溶液,随着氢氧化钠溶液的滴加,水的质量不断增大,该选项对应关系不正确;D、饱和的硝酸钾溶液中不能继续溶解硝酸钾晶体,向一定量饱和硝酸钾溶液中加入硝酸钾晶体时,硝酸钾不能继续溶解,溶质质量分数不变,该选项对应关系正确。
故选C。
2.若向NaOH和Na2CO3的混合溶液中逐滴加入过量稀盐酸,下列图象正确的是()A.B.C.D.【答案】C【解析】【分析】向一定量的氢氧化钠、碳酸钠混合溶液中逐滴滴入稀盐酸,氢氧化钠先和盐酸反应生成氯化钠和水,氢氧化钠反应完后,继续滴加盐酸,碳酸钠和盐酸反应生成氯化钠、水和二氧化碳。
【详解】A、向氢氧化钠和碳酸钠的混合液中加入盐酸,溶液质量一开始就不断增加,故错误;B、向氢氧化钠和碳酸钠的混合液中加入盐酸,这两种物质都会和盐酸反应生成氯化钠,所以氯化钠反应一开始就有,故错误。
C、向氢氧化钠和碳酸钠的混合液中加入盐酸,这两种物质都会和盐酸反应生成氯化钠,开始pH大于7,稀盐酸最后过量,最终溶液的pH将会小于7,故正确;D、向氢氧化钠和碳酸钠的混合液中加入盐酸,盐酸先与氢氧化钠反应,氢氧化钠被消耗完,再与碳酸钠反应,产生二氧化碳,故错误。
故选:C。
高中化学必修一元素转换关系图1、钠及其化合物的转化关系①Na 2O +2HCl=2NaCl +H 2O ②2Na +2HCl=2NaCl +H 2↑Na 2O +2H +=2Na ++H 2O 2Na +2H +=2Na ++H 2↑ ③2Na 2O 2+4HCl=4NaCl +O 2↑+2H 2O ④4Na +O 2=2Na 2O2Na 2O 2+4H +=4Na ++O 2↑+2H 2O ※⑥2Na +2H 2O=2NaOH +H 2↑ ※⑤2Na +O 2△Na 2O 2 2Na +2H 2O=2Na ++2OH -+H 2↑⑦Na 2O +H 2O=2NaOH ※⑧2Na 2O 2+2H 2O=4NaOH +O 2↑Na 2O +H 2O=2Na ++2OH - 2Na 2O 2+2H 2O=4Na ++4OH -+O 2↑ ⑨Na 2O +CO 2=Na 2CO 3 ※⑩2Na 2O 2+2CO 2=2Na 2CO 3+O 2⑾2NaOH +CO 2=Na 2CO 3+H 2O ⑿Na 2CO 3+Ca(OH)2=CaCO 3↓+2NaOH2OH -+CO 2=CO 32-+H 2O CO 32-+Ca 2+=CaCO 3↓⒀NaOH +CO 2=NaHCO 3 ※⒁Na 2CO 3+H 2O +CO 2=2NaHCO 3OH -+CO 2=HCO 3- CO 32-+H 2O +CO 2=2HCO 3-※⒂2NaHCO 3△Na 2CO 3+H 2O +CO 2↑ 或 ※NaHCO 3+NaOH=Na 2CO 3+H 2OHCO 3-+OH -=CO 32-+H 2O⒃Na 2CO 3+2HCl=2NaCl +H 2O +CO 2↑ ⒄NaHCO 3+HCl=NaCl +H 2O +CO 2↑CO 32-+2H +=H 2O +CO 2↑ HCO 3-+H +=H 2O +CO 2↑补充:①石灰水中加入少量NaHCO 3 : Ca(OH)2+NaHCO 3=CaCO 3↓+NaOH +H 2OCa 2++OH -+HCO 3-=CaCO 3↓+H 2O②石灰水中加入过量NaHCO 3 : Ca(OH)2+2NaHCO 3=CaCO 3↓+Na 2CO 3+2H 2OCa 2++2OH -+2HCO 3-=CaCO 3↓+CO 32-+2H 2O 2、铝及其化合物的转化关系NaCl Na NaOH Na 2CO 3 NaHCO 3 NaCl Na 2O Na 2O 2 ① ② ③ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑾ ⑿ ⒀ ⒁ ⒂⒃ ⒄ ④ Al Al 2O 3 A l (O H )3 KAl(SO 4)2 AlCl 3① ② ③ ④ ⑤ ⑥ ⑦ ⑧ ⑨ ⑩ ⑾⑿①2Al +6HCl=2AlCl 3+3H 2↑ ②4Al +3O 2△2Al 2O 32Al +6H +=2Al 3++3H 2↑※③2Al +2NaOH +2H 2O=2NaAlO 2+3H 2↑ ④Al 2O 3+6HCl=2AlCl 3+3H 2O2Al +2OH -+2H 2O=2AlO 2-+3H 2↑ Al 2O 3+6H +=2Al 3++3H 2O ※⑤Al 2O 3+2NaOH=2NaAlO 2+H 2O ⑥AlCl 3+3NH 3·H 2O=Al(OH)3↓+3NH 4ClAl 2O 3+2OH -=2AlO 2-+H 2O Al 3++3NH 3·H 2O = Al(OH)3↓+3NH 4+⑦Al(OH)3+3HCl=AlCl 3+3H 2O ⑧2Al(OH)3△Al 2O 3+3H 2OAl(OH)3+3H +=Al 3++3H 2O☆⑨NaAlO 2+HCl +H 2O =Al(OH)3↓+NaCl 或NaAlO 2+2H 2O +CO 2=Al(OH)3↓+NaHCO 3AlO 2-+H ++H 2O=Al(OH)3↓ AlO 2-+2H 2O +CO 2=Al(OH)3↓+HCO 3-※⑩Al(OH)3+NaOH = NaAlO 2+2H 2O ☆⑾Al 3++3H 2O Al(OH)3胶体+3H +Al(OH)3+OH -= AlO 2-+2H 2O 明矾净水⑿AlCl 3+4NaOH = NaAlO 2+3NaCl +2H 2O Al 3++4OH -= AlO 2-+2H 2O 3、铁及其化合物的转化关系①Fe 3O 4+4CO△3Fe +4CO 2 ※② 3Fe +4H 2O(g)高温Fe 3O 4+4H 2 ③ Fe +2HCl=FeCl 2+H 2↑ 或3Fe +2O 2点燃Fe 3O 4Fe +2H +=Fe 2++H 2↑ ④2Fe +3Cl 2点燃2FeCl 3※⑤2FeCl 2+Cl 2 = 2FeCl 3 ※⑥Fe +2FeCl 3 = 3FeCl 22Fe 2++Cl 2 = 2Fe 3++2Cl - Fe +2Fe 3+= 3Fe 2+⑦FeCl 2+2NaOH = Fe(OH)2↓+2NaCl ⑧Fe(OH)2+2HCl = FeCl 2+2H 2OFe 2++2OH -= Fe(OH)2↓ Fe(OH)2+2H += Fe 2++2H 2O※⑨4Fe(OH)2+O 2+2H 2O = 4Fe(OH)3 ⑩FeCl 3+3NaOH = Fe(OH)3↓+3NaCl白色沉淀迅速变成灰绿色,最后变成红褐色 Fe 3++3OH -= Fe(OH)3↓⑾Fe(OH)3+3HCl = FeCl 3+3H 2O Fe 3++3H 2O Fe(OH)3胶体+3H +(净水) Fe(OH)3+3H += Fe 3++3H 2O ⑿2Fe(OH)3△Fe 2O 3+3H 2O⒀Fe 2O 3+6HCl = 2FeCl 3+3H 2O ※⒁FeCl 3+3KSCN = Fe(SCN)3+3KClFe 2O 3+6H += 2Fe 3++3H 2O Fe 3++3SCN -= Fe(SCN)3Fe 3O 4 Fe FeCl 2 Fe(OH)2 Fe(SCN)3 FeCl 3 Fe(OH)3 Fe O 3 ①② ③ ④⑤ ⑥ ⑦ ⑧ ⑨⑩ ⑾⑿ ⒁ ⒀①Si +O 2△SiO 2②SiO 2+2C 高温 Si +2CO ↑※③SiO 2+4HF = SiF 4↑+2H 2O (刻蚀玻璃)④Si +4HF = SiF 4↑+2H 2↑ ⑤SiO 2+CaO高温CaSiO 3※⑥SiO 2+2NaOH = Na 2SiO 3+H 2O SiO 2+CaCO 3高温CaSiO 3+CO 2↑SiO 2+2OH -= SiO 32-+H 2O ※⑦Na 2SiO 3+2HCl = H 2SiO 3↓+2NaCl SiO 2+Na 2CO 3高温Na 2SiO 3+CO 2↑ SiO 32-+2H += H 2SiO 3↓※⑦Na 2SiO 3+H 2O +CO 2=H 2SiO 3↓+Na 2CO 3或Na 2SiO 3+2H 2O +2CO 2=H 2SiO 3↓+2NaHCO 3SiO 32-+H 2O +CO 2=H 2SiO 3↓+CO 32-或SiO 32-+2H 2O +2CO 2=H 2SiO 3↓+2HCO 3-⑧H 2SiO 3+2NaOH = Na 2SiO 3+2H 2O ⑨H 2SiO 3 △H 2O +SiO 2H 2SiO 3+2OH -= SiO 32-+2H 2O 5、氯及其化合物的转化关系①2Fe +3Cl 2 点燃2FeCl 3 ②Cu +Cl 2 点燃CuCl 2 ③2FeCl 3+Cu = 2FeCl 2+CuCl 22Fe 3++Cu = 2Fe 2++Cu 2+④H 2+Cl 2 2HCl※⑤MnO 2+4HCl(浓) △MnCl 2+Cl 2↑+2H 2OMnO 2+4H ++2Cl - △ Mn 2++Cl 2↑+2H 2O ※⑥Cl 2+H 2O = HCl +HClO ※⑦2HClO 2HCl +O 2↑Cl 2+H 2O = H ++Cl -+HClO 2HClO 2H ++2Cl -+O 2↑※⑧Cl 2+2NaOH = NaCl +NaClO +H 2O ※⑨2Cl 2+2Ca(OH)2 = CaCl 2+Ca(ClO)2+2H 2OCl 2+2OH -= Cl -+ClO -+H 2O 工业制漂白粉※⑩Ca(ClO)2+H 2O +CO 2 = CaCO 3↓+2HClO 或Ca(ClO)2+2HCl = CaCl 2+2HClOCa 2++2ClO -+H 2O +CO 2= CaCO 3↓+2HClO 或ClO -+H += HClO 漂白粉的漂白原理向漂白粉溶液中通入过量的CO 2:Ca(ClO)2+2H 2O +2CO 2 = Ca(HCO 3)2+2HClOClO -+H 2O +CO 2 = HCO 3-+HClONa 2SiO 3 SiF 4 Si SiO 2 H 2SiO 3 CaSiO 3 ①②③ ④ ⑤⑥ ⑦ ⑧⑨ CuCl 2 HClO HCl Cl 2 FeCl 3NaClO Ca(ClO)2① ② ③ ④⑤ ⑥ ⑦ ⑧ ⑨ ⑩ 点燃或光照 光照光照①S +O 2 点燃SO 2②2H 2S +SO 2=3S +2H 2O※③SO 2+O 2 催化剂加热 2SO 3 ④SO 3+H 2O = H 2SO 4 ⑤SO 2+CaO△CaSO 3 或 SO 2+Ca(OH)2 = CaSO 3↓+H 2O⑥SO 3+CaO = CaSO 4 SO 2+Ca 2++2OH -=CaSO 3↓+H 2O SO 3+Ca(OH)2 = CaSO 4+H 2O ⑦2CaSO 3+O 2△2CaSO 4※⑧SO 2+Cl 2+2H 2O = H 2SO 4+2HCl ※⑨Cu +2H 2SO 4(浓) △CuSO 4+SO 2↑+2H 2OSO 2+Cl 2+2H 2O = 4H ++SO 42-+2Cl -Cu +2H 2SO 4(浓) △Cu 2++SO 42-+SO 2↑+2H 2O※⑩C +2H 2SO 4(浓)△CO 2↑+2SO 2↑+2H 2O7、氮及其化合物的转化关系 ※①N 2+O 22NO※②2NO +O 2 = 2NO 2※③3NO 2+H 2O = 2HNO 3+NO 3NO 2+H 2O =2H ++2NO 3-+NO以上三个反应为“雷雨发庄稼”原理 扩展反应有:4NO 2+O 2+2H 2O = 4HNO 3 4NO +3O 2+2H 2O = 4HNO 3 ※④Cu +4HNO 3(浓) = Cu(NO 3)2+2NO 2↑+2H 2O 上面两个反应主要用于气体溶于水时的计算Cu +4H ++2NO 3-=Cu 2++2NO 2↑+2H 2O 或 4HNO 3 4NO 2↑+ O 2↑+ 2H 2OC +4HNO 3(浓)△CO 2↑+2NO 2↑+2H 2O 浓硝酸见光易变黄的原因※⑤3Cu +8HNO 3(稀) = 3Cu(NO 3)2+2NO ↑+4H 2O ⑥N 2+3H 2催化剂 高温高压2NH 33Cu +8H ++2NO 3-=3Cu 2++2NO ↑+4H 2O 合成氨反应是人工固氮的主要途径 ⑦NH 3+HCl = NH 4Cl ⑧NH 4Cl△NH 3↑+HCl ↑NH 3+H += NH 4+(水溶液中) 补充:NH 4HCO 3 △NH 3↑+H 2O+CO 2↑氨气与酸均能反应生成铵盐,且与挥发性酸 铵盐受热都易分解,但并不是所有的铵盐 (如浓HCl 、浓HNO 3)相遇时空气中有白烟 都分解出氨气,如NH 4NO 3、(NH 4)2SO 4※⑧NH 4Cl +NaOH△NaCl +NH 3↑+H 2O NH 4++OH-△NH 3↑+H 2O所有的铵盐都能与碱作用放出氨气,可利用此反应鉴别铵离子。
高中化学易错点剖析与高考题逆袭(4)——有关元素化合物间反应先后顺序的图像题【易错点剖析】向一种混合物中逐渐加入另一种试剂,可能会发生多个化学反应,讨论产物与所加试剂的量之间的关系,这是高中最常见的题型。
解决这类题最简捷有效的办法,就是对中学常见的反应顺序进行归纳总结,做到胸有成竹。
在高中阶段学过的无机化学反应类型只有两种,一是复分解反应,二是氧化还原的反应。
其反应顺序遵循相同的原则:“性质强烈先反应、产物稳定先反应”。
现分别总结如下:1.复分解反应先后顺序:(1)向溶液中加入碱(OH-),与溶液中粒子反应一般顺序及现象为:顺序:①H+(酸碱中和)>②金属阳离子>③NH4+>④Al(OH)3等固体溶解。
现象:①无明显变化②产生沉淀③加热产生气体④沉淀减少。
(2)向溶液中加入酸(H+),与溶液中粒子反应一般顺序及现象为:顺序:①OH-(酸碱中和)>②AlO2->③SiO32->④CO32->⑤HCO3->⑥Al(OH)3等固体溶解。
现象:①无明显变化②产生沉淀③产生沉淀④无明显变化⑤产生气体⑥沉淀减少。
2.氧化还原反应先后顺序:(1)还原剂与常见氧化性粒子反应顺序:MnO4-/Cr2O72->ClO->(NO3-+H+)>Fe3+>Cu2+>H+。
(2)氧化剂与常见还原性粒子反应顺序:金属单质>S2- (H2S) >SO32-(SO2) >I->Fe2+>Br->Cl-。
【例1】向Ba(OH)2和NaOH等物质的量的混合溶液中逐渐通入CO2气体,可认为是与先反应。
答案:与Ba(OH)2先反应。
解析:理由是CO2与NaOH反应的产物是Na2CO3,还能继续与Ba(OH)2反应,Na2CO3属于“产物不稳定”。
CO2与Ba(OH)2反应的产物是BaCO3沉淀,不会再与NaO H反应,属于“产物稳定先反应”。
【例2】把CO2 与H2O(气)混合气体与Na2O2混合,可认为与CO2先反应。
答案:与CO2先反应。
解析:理由是Na2O2与H2O(气) 反应的产物是NaOH,还能继续与CO2反应,属于“产物不稳定”。
Na2O2与CO2反应的产物是Na2CO3,不会再与H2O(气)反应,属于“产物稳定先反应”。
【例3】向100mL某混合溶液中逐渐加入NaOH溶液,得到下列曲线图(纵坐标为沉淀的量,横坐标为加入NaOH 的量)则下列针对溶液中所含阳离子的判断不正确的是()A.溶液中的一定含有H+、Al3+、NH4+,可能含有Mg2+B.溶液中NH4+物质的量浓度为2mol/LC.溶液中Al3+、Mg2+的物质的量之比为1:1D.若溶液中含有Mg2+,则沉淀最大质量为10.7g解析:答案:C。
①由0~ 0.1段无沉淀生成便知存在H +,且能求出n(H +)= 0.1 mol 。
若图中没有无沉淀生成现象则无大量H +。
②由0.5~ 0.7段沉淀不变化便知存在NH 4+,且能求出n(NH 4+)=0.2 mol 。
若图中没有沉淀不变现象则无NH 4+。
③由0.7~ 0.8段沉淀减少便知原溶液中存在Al 3+,且能求出n(Al 3+)= 0.1 mol 。
若图中没有沉淀减少现象则无Al 3+。
④由0.8之后段仍有沉淀剩余便知原溶液中存在其它金属离子如Mg 2+,由0.7~ 0.8段溶解Al(OH)3耗0.1 mol NaOH ,求出0.1~0.5段生成Al(OH)3耗0.3 mol NaOH ,那么生成Mg(OH)2时耗(0.4-0.3)=0.1 mol NaOH ,即n(Mg 2+)= 0.05 mol 。
⑤沉淀最大质量由0.1 mol Al(OH)3和0.05 mol Mg(OH)2组成,数值为10.7g【经典题逆袭】14. 将足量CO 2通入KOH 和Ca(OH)2的混合稀溶液中,生成沉淀的物质的量(n )和通入CO 2体积(V )的关系正确的是( )13. 将0.03 mol Cl 2缓缓通入含0.02 mol H 2SO 3和0.02 mol HBr 的混合溶液中(忽略溶液体积的变化)。
溶液中c(H +)与通入的Cl 2的物质的量的关系图中,正确的是( )12 .标准状况下,往100mL 0.1mol/L 的FeBr 2溶液中通入一定体积的Cl 2,充分反应后,溶液中有50%的Br -被氧化。
则通入的氯气的体积是( )A 、0.448LB 、0.336LC 、0.224LD 、0.672L11. 向NaBr 、NaI 、Na 2SO 3混合液中,通入—定量氯气后,将溶液蒸干并充分灼烧,得到固体剩余物质的组成可能是( )A .NaCl Na 2SO 4B . NaBr Na 2SO 4C .NaCl Na 2SO 4 I 2D .NaCl NaI Na 2SO 4 10. 某溶液中可能含有OH -、CO32-、AlO 2-、SiO 32-、SO 42-、Na +、Fe 3+、Mg 2+、Al 3+等离子.当向该溶液中逐滴加入一定物质的量浓度的盐酸溶液时,发现生成沉淀的物质的量随盐酸溶液的体积变化的图象如图所示.下列说法正确的是( )A .原溶液中一定含有的阴离子是:OH -、SiO 32-、AlO 2-、CO 32-B .反应最后形成的溶液中的溶质为NaClC .原溶液中一定含有Na 2SO 4D.原溶液中含有CO32-与AlO2-的物质的量之比为1:19. 已知还原性:SO32->I-,某无色溶液中只可能含有I-、NH4+、Cu2+、SO32-、Na+、Cl-中的某些离子,向该溶液中加入适量溴水,溶液仍然无色,则下列关于溶液组成的判断正确的是( )①可能含有I-②肯定含有I-③可能含有SO32-④肯定含有SO32-⑤肯定不含Cu2+⑥可能含有Cu2+A.①③⑥B.②④⑤C.①④⑤D.①③⑤8.用石墨电极电解100 mL H2SO4与CuSO4的混合溶液,通电一段时间后,两极均收集到2.24 L气体(标准状况),则原混合溶液中Cu2+的物质的量浓度为()A.1 mol·L-1B.2 mol·L-1C.3 mol·L-1D.4 mol·L-17. 某稀硫酸和稀硝酸的混合溶液200mL,平均分成两份,向其中一份中逐渐加入铜粉,最多能溶解铜19.2g(已知硝酸只被还原为NO气体);向另一份中逐渐加入铁粉,产生气体的量随铁质量增加的变化如图所示.下列分析或结果错误的是()A.溶液中最终溶质为FeSO4B.OA段产生是NO,AB段反应为2Fe3++Fe═3Fe2+,BC段产生氢气C.混合液中N03-的物质的量为0.4molD.c(H2SO4)为5mol•L-16. FeCl3、CuCl2的混合溶液中加入铁粉,充分反应后仍有固体存在,下列判断不正确的是()A. 加入KSCN溶液一定不变红色B. 溶液中一定含Fe2+C. 溶液中一定含Cu2+D. 剩余固体中一定含铜5. 向FeI2、FeBr2的混合溶液中通入适量氯气,溶液中某些离子的物质的量变化如图所示。
则下列有关说法中不正确...的是()A. 线段BD表示Fe3+物质的量的变化B. 原混合溶液中FeBr2的物质的量为6 molC. 原溶液中:n(Fe2+)∶n(I-)∶n(Br-)=2∶1∶3D. 当通入2 mol Cl2时,溶液中已发生的离子反应可表示为2Fe2++2I-+2Cl2===2Fe3++I2+4Cl-量铝粉和铁粉的混合物与一定体积某浓度的稀硝酸充分反应,反应过程中无气体放出。
在反应结束后的溶液中,逐滴加入5mol·L-1的NaOH溶液,所加NaOH溶液的体积(mL)与产生的沉淀的物质的量关系如图所示。
则(1)B与A的差值为mol。
(2)C点对应的溶液体积为mL。
(3)原硝酸溶液中含硝酸的物质的量为mol。
(4)铝粉和铁粉的混合物中铝粉与铁粉的物质的量之比为。
(5)写出铝与该浓度硝酸反应的离子方程式:。
2.把由NaOH、AlCl3、MgCl2三种固体组成的混合物,溶于足量水中后有0.58 g白色沉淀生成,在所得的浑浊液中,逐滴加入0.5 mol/L盐酸,加入盐酸的体积(V)与生成沉淀的质量(W)关系如图所示:(1)混合物中NaOH的质量为,混合物中AlCl3的质量为,混合物中MgC l2的质量为。
(2)P点表示盐酸的体积是。
1. 已知:还原性:HSO-3>I-,氧化性IO-3>I2。
(1)在NaIO3溶液中滴加少量NaHSO3溶液,发生下列反应,配平反应方程式。
NaIO3NaHSO3I2Na2SO4H2SO4H2O (2)在NaIO3溶液中滴加过量NaHSO3溶液反应完全,推测反应后溶液中的还原产物为(填化学式)。
(3)在含5mol NaHSO3的溶液中逐滴加入NaIO3溶液。
加入NaIO3的物质的量和析出I2单质的物质的量的关系曲线如图所示。
写出反应过程中与AB段曲线对应的离子方程式:;当溶液中I-与I2的物质的量之比为5∶3时,加入的NaIO3为mol。
答案:14.D 13.B 12.C 11.A 10.A 9.C 8.A 7.D 6.C 5.B4.H2S、CO2、HCl SO2、Cl2、NH3H23.0.05 40 0.5 5∶3 8Al+30H++3NO3-===8Al3++3NH4++9H2O2.(1)1.8g 0.6675g0.95g (2)90 ml1.(1)4 10 2 7 3 2 (2)NaI (3)IO3-+5I-+6H+===3I2+3H2O 11/6。