1.1 物质的分类及转化 讲义【新教材】人教版(2019)高中化学必修一
- 格式:docx
- 大小:146.86 KB
- 文档页数:5
第一章物质及其变化一、物质的分类及转化1.同素异形体:由同一种元素形成的几种性质不同(物理性质不同,化学性质相似)的单质。
常见的实例:金刚石、石墨和C60;氧气和臭氧;红磷和白磷。
注:同素异形体之间的转化有单质参与,但不属于氧化还原反应!2.酸性氧化物与碱性氧化物的理解(1)酸性氧化物定义:与碱反应只生成一种对应价态的盐和水的氧化物。
①酸性氧化物不一定是非金属氧化物,如Mn2O7是酸性氧化物。
②非金属氧化物不一定都是酸性氧化物,如CO、NO、NO2。
(2)碱性氧化物定义:与酸反应只生成一种对应价态的盐和水的氧化物。
①碱性氧化物一定是金属氧化物。
(只有“碱金”这一组关系是一定的!)②金属氧化物不一定是碱性氧化物,如Mn2O7是酸性氧化物,Al2O3是两性氧化物,Na2O2是特殊氧化物。
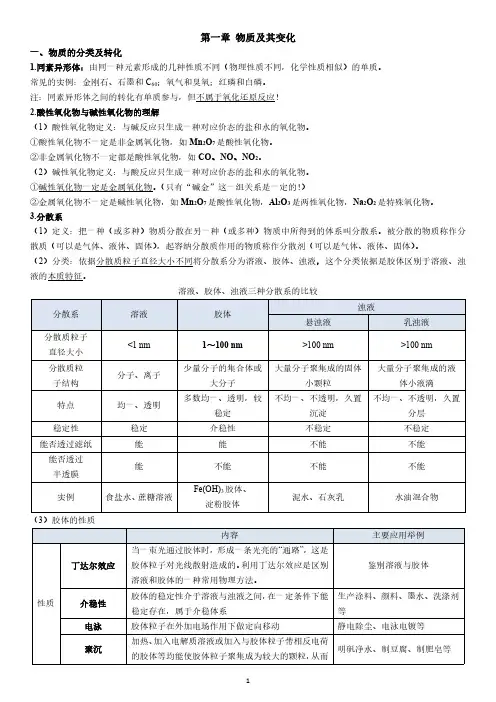
3.分散系(1)定义:把一种(或多种)物质分散在另一种(或多种)物质中所得到的体系叫分散系。
被分散的物质称作分散质(可以是气体、液体、固体),起容纳分散质作用的物质称作分散剂(可以是气体、液体、固体)。
(2)分类:依据分散质粒子直径大小不同将分散系分为溶液、胶体、浊液,这个分类依据是胶体区别于溶液、浊液的本质特征。
溶液、胶体、浊液三种分散系的比较(3)胶体的性质形成沉淀从分散剂中析出提纯渗析由于胶体粒子较大不能通过半透膜,而离子、小分子较小可通过半透膜,用此法将胶体提纯用于分离溶液和胶体(4)胶体部分易错归纳①胶体的本质是胶体粒子的直径介于1~100nm之间,而不是丁达尔效应。
②胶体本身并不带电,而是由于胶体粒子吸附溶液中的离子而带电。
④电泳现象是由于胶体粒子吸附溶液中的离子而带电,通电后胶体粒子定向移动,所以并非所有胶体都有电泳现象(如淀粉胶体)。
(5)Fe(OH)3胶体的制备在小烧杯中,加入40mL蒸馏水,加热至沸腾,向沸水中逐滴滴入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,立即停止加热,即可得到Fe(OH)3胶体,整个过程不能搅拌。










知识点A
B C
第1讲物质的分类高考大纲
知识网络图
1.1物质的分类
知识精讲
图书馆中图书的收藏、超市中货品的摆放、试题库中试题的整理、家庭中各种物品的归类······都是用到了分类的知识。
当物品的数目大、种类多的时候,分类的作用几乎是无可替代的,但是一定要注意:分类是要有一定的“标准”的,这个“标准”就是我们分类的根据。
一、化学方法的分类
(1)物质分类的多种角度
(2)分类的方式
①交叉分类法:按照多种标准对某事物进行分类的方法。
特点:物质类别间有相交叉的部分。
②树状分类法:对同类物质按照从属关系进行分类的方法。
特点:同层次中各类别间相互独立。
(3)常见无机物的分类
跟踪练习
【1】按照物质的树状分类和交叉分类,HNO3应属于
①酸②氢化物③氧化物④含氧酸⑤难挥发性酸
⑥强氧化性酸⑦一元酸⑧化合物⑨混合物
A.①②③④⑤⑥⑦⑧
B.①④⑥⑦⑧
C.①⑨
D.①④⑤⑥⑦
【答案】B
【2】将A组物质与B组物质用短线相连。
A B
Na2CO3钠盐
Na2SO4硫酸盐
NaCl 含氧酸盐
K2SO4无氧酸盐
KHCO3氧化物
Na2O 酸式盐
<答案> A B
Na2CO3钠盐
Na2SO4硫酸盐
NaCl 含氧酸盐
K2SO4无氧酸盐
KHCO3氧化物
Na2O 酸式盐。
第一章物质及其变化
第一节物质的分类及转化
一、物质分类
1、根据物质的组成和性质分类
任何物质都是有元素组成的,根据元素组成对物质进行分类是常用的方法。
(1)同素异形体:由一种元素形成的几种性质不同的单质。
如:金刚石和石墨、白磷(P4)和红磷、氧气和臭氧
【注】①同素异形体之间的转换是化学变化。
②同素异形体之间由于结构不同,物理性质有差异,但由于同种元素组成,化学性质相似或略有差
异。
③由一种元素组成的物质不一定是纯净物。
如氧气和臭氧。
2、分类方法
(1)树状分类:对同类事物进行再分类的方法。
单质:O2、Fe、He等
纯净物有机化合物:CH4、葡萄糖、酒精(乙醇)等
酸:电离出的阳离子全部是氢离子
化合物
碱:电离出的阴离子全部是氢氧根
无机化合物
物质盐:由金属阳离子或NH4+与酸根离子结合
氧化物:只含两种元素,其中一种是氧元素
溶液:NaCl溶液、稀硫酸等
混合物胶体:Fe(OH)3胶体、淀粉胶体等
浊液:泥水
【注】冰水混合物、胆矾、明矾、水银等并非混合物,均为纯净物。
①酸的分类:酸可依据电离出氢离子的个数,将酸分为一元酸、二元酸、多元酸。
也可按照酸分子中是否含氧元素,将酸分为含氧酸和无氧酸。
一元酸:HCl、HNO3、CH3COOH等含氧酸:HNO3、、H2SO4等
酸二元酸:H2CO3、H2SO4等酸
多元酸:H3PO4无氧酸:HCl、H2S等
②碱的分类:可依据电离出OH-的个数,将酸分为一元碱、二元碱、多元碱。
也可按照溶解性,将碱分为可溶性碱、难溶性碱。
一元碱:NaOH、NH3·H2O 可溶性碱:NaOH、Ba(OH)2等
碱二元碱:Mg(OH)2、Cu(OH)2 碱
多元碱:Fe(OH)3、Al(OH)3 难溶性碱:Mg(OH)2、Cu(OH)2 等
③盐的分类
正盐:既不能电离出H+,也不能电离出OH-的盐,如Na2CO3、CuSO4
盐酸式盐:酸根能电离出H+的盐,如NaHCO3、NaHSO4
碱式盐:能电离出OH-的盐,如Cu2(OH)2CO3
④氧化物的分类:依据氧化物的性质,可将氧化物分为酸性氧化物、碱性氧化物、两性氧化物及不成盐氧
化物。
酸性氧化物:与碱反应只生成盐和水。
如CO2、SO2、SiO2等
碱性氧化物:与碱反应只生成盐和水。
如Fe2O3、CaO等
氧化物
两性氧化物:既能与酸反应又能与碱反应。
如Al2O3
不成盐氧化物:既不与酸反应也不与碱反应。
如NO、CO等
【注】①NO2不属于酸性氧化物。
②Na2O2、Fe3O4不属于碱性氧化物。
Na2O2属于过氧化物,Fe3O4属于复杂氧化物。
【易错题】①酸性氧化物一定是非金属氧化物。
(×)如Mn2O7为酸性氧化物
①非金属氧化物一定是酸性氧化物(×)如NO、CO为不成盐氧化物
①金属氧化物一定是碱性氧化物(×)如Al2O3为两性氧化物
①碱性氧化物一定是金属氧化物(√)
②交叉分类:从不同角度对物质进行分类。
如Na2CO3,从其组成阴离子来看为碳酸盐,阳离子来看为
钠盐。
Na2CO3钠盐
Na2SO4钾盐
K2SO4硫酸盐
K2CO3碳酸盐
二、分散系及其分类
1.分散系
(1)定义:把一种(或多种)物质以粒子形式分散到另一种(或多种)物质中所形成的混合物。
分散质:被分散的物质,有三种状态:固、液、气
(2)分散系
分散剂:容纳分散质的物质,有三种状态:固、液、气
根据分散质和分散剂的状态不同,可形成9种分散系。
溶液:<1nm
(3)分散系分类:根据分散质粒子直径大小胶体:1-100nm
(本质区别)浊液:>100nm
2.胶体
(1)胶体的分类:按分散剂的状态不同分类,分散剂为气态,称为气溶胶,分散剂为液态,称为液溶胶,分散剂为固态,称为固溶胶。
气溶胶:烟、云、雾
液溶胶:Fe(OH)3胶体
固溶胶:有色玻璃
常见胶体:牛奶、豆浆、空气、血液、墨水、土壤、蛋白质溶液、淀粉溶液等。
(2)Fe(OH)3胶体的配制
试剂:蒸馏水、饱和FeCl3溶液
过程:向沸水中逐滴滴加饱和FeCl3溶液,加热直到溶液变为红褐色时,停止加热,即得到Fe(OH)3胶体。
方程式:FeCl3 + 3H2O Fe(OH)3(胶体)+3HCl
【注】不可用自来水配制,不能加热时间过长,防止胶体变成沉淀。
(3)胶体的性质
①丁达尔效应:当有一束光通过胶体时,可以看到一条光亮的“通路”。
利用了光的散射原理。
应用:可用于鉴别溶液和胶体。
实例:放电影、光线透过树叶间的缝隙射入密林等。
②聚沉:聚沉是一种物理现象,指向胶体中加入电解质溶液时,加入的阳离子(或阴离子)中和了胶体粒子所带电荷,使胶体粒子聚集成较大颗粒,从而形成沉淀从分散系里析出。
条件:加电解质溶液、加热、加带相反电荷的胶体粒子。
实例:盐卤点豆腐、江河入海口处形成的沙洲等。
③渗析:利用半透膜将溶液与胶体分离,半透膜允许小分子或粒子透过,胶粒不能透过。
渗析是分离胶体和溶液的方法。
【拓展】胶体的其它性质
①布朗运动:胶体粒子不停地作无规则运动。
并非胶体独有的的性质。
②电泳:胶粒在外加电场的作用下,能在分散剂里作定向移动,这种现象称为电泳。
如工厂静电除尘利用了胶体的电泳。
△。