PPT课件
23
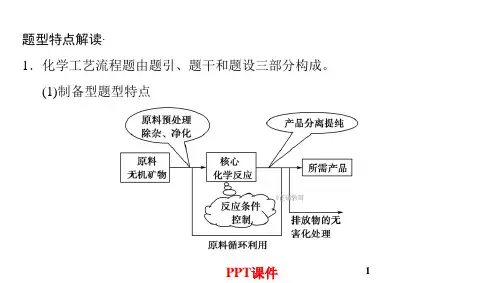
①明确目的:从废钒催化剂中回收 V2O5,即除杂质提纯 V2O5。 ②明确原料:明确废钒催化剂的主要成分和杂质。 ③明确流程:该过程涉及酸浸、氧化、中和、过滤、淋洗、煅烧等,应明确 其含义。 核心反应:硫酸酸浸、KClO3 氧化、高 转化为 VO+ 2 ,反应前后钒元素的化合价不变,发生非氧化 还原反应, VO2+变为 VO+ 2 是氧化还原反应。 ⑤信息理解应用:可逆反应,平衡移动。 ⑥考查细节:前面加入了 KClO3 和 KOH。 ⑦关注细节:NH4VO3“煅烧”生成 V2O5,钒元素的化合价没有发生变化。
(3)TiO2·xH2O 沉淀与双氧水、氨水反应 40 min 所得实验结果如下表所示:
温度/℃
30 35 40 45 50
TiO2·xH2O 转化率/% 92 95 97 93 88
分析40 ℃时TiO2·xH2O转化率最高⑥的原因__________________________。
(4)Li2 Ti5O15 中 Ti 的化合价为+4,其中过氧键的数目为________。
PPT课件
13
(2)“酸浸”后,钛主要以TiOCl24-⑤形式存在,写出相应反应的离子方程式
_________________________________________________________________
________________________________________________________________。
剂,其氧化产物为 CO2,反应的化学方程式为 2FePO4+Li2CO3+H2C2O4===== 2LiFePO4+3CO2↑+H2O。
PPT课件
19
【答案】 (1)100 ℃、2 h,90 ℃、5 h (2)FeTiO3+4H++4Cl-===Fe2++TiOCl24-+2H2O (3)低于 40 ℃,TiO2·xH2O 转化反应速率随温度升高而增加;超过 40 ℃,双 氧水分解与氨气逸出导致 TiO2·xH2O 转化反应速率下降 (4)4 (5)Fe3+恰好沉淀完全时,c(PO34-)=11..30××1100--252 mol·L-1=1.3×10-17 mol·L-1, c3(Mg2+)·c2(PO34-)值为 0.013×(1.3×10-17)2≈1.7×10-40<Ksp[Mg3(PO4)2],因此 不会生成 Mg3(PO4)2 沉淀