化学反应工程-第三章 非理想流动反应器
- 格式:ppt
- 大小:954.50 KB
- 文档页数:76


绪论.1、化学反应工程是一门研究()的科学.(化学反应的工程问题)2.()和()一起,构成了化学反应工程的核心。
〔三传;反应动力学〕3。
不论是设计、放大或控制,都需要对研究对象作出定量的描述,也就要用数学式来表达个参数间的关系,简称( )。
(数学模型)4.化学反应和反应器的分类方法很多,按反应系统涉及的相态分类,分为:()和( )。
5.化学反应和反应器的分类方法很多,按操作方法分为()操作、( )操作和()操作.6.化学反应和反应器的分类方法很多,按传热条件分为()、()和().选择1. ()“三传一反”是化学反应工程的基础,其中所谓的一反是指。
A 化学反应B 反应工程C 反应热力学D 反应动力学,2. ()“三传一反”是化学反应工程的基础,下列不属于三传的是。
A能量传递B质量传连C 热量传递D 动量传递3. ()按反应器的型式来分类,高径比大于30的为A。
管式反应器B槽式反应器C塔式反应器D釜式反应器三、判断1.物理过程不会改变化学反应过程的动力学规律,即化学反应速率与温度浓度之间的关系并不因为物理过程的存在而发生变化。
()2.流体流动、传质、传热过程不会影响实际反应的温度和参与反应的各组分浓度在时间、空间上的分布,最终影响反应结果。
( )四、简答1.利用数学模型解决化学反应工程问题的步骤?第一章均相单一反应动力学和理想反应器1.均相反应是指()。
2。
如果反应体系中多于一个反应物,在定义转化率时,关键组分A的选取原则是()。
3. 当计量方程中计算系数的代数和等于零时,这种反应称为( ),否则称为( ) .4. 化学反应速率式为,如用浓度表示的速率常数为,用压力表示的速率常数则=()。
5。
活化能的大小直接反映了()对温度的敏感程度。
6。
化学反应动力学方程有多种形式。
对于均相反应,方程多数可以写成()或().7。
对于反应器的开发根据()来选择合适的反应器,结合( )和()两方面特性来确定操作方式和优化操作条件。

(1)化学反应速率可以表为dtdC r A A ±=,前提是▁▁▁▁。
(2)固体催化剂的主要组成有▁▁▁▁▁▁,▁▁▁▁▁▁和▁▁▁▁▁▁(3)多孔性球形颗粒10克,半径1cm ,系由密度为4.0克/cm 3的材料制成。
则孔容积Vg=▁▁▁▁▁ ,孔隙率θ=▁▁▁ 假密度ρ=▁▁▁(4)气相反应A +3B →2C ,则δA = ▁▁▁ δΒ= ▁▁▁(5)F(0)= ▁▁▁,F(∞)=▁▁▁,⎰∞=0)(dt t E ▁▁▁,(6)Thiele 模数φ的定义是▁▁▁▁▁内扩散效率因子ζ和φ的关系(φ大于5)是:▁▁▁▁▁▁(7)气固相催化反应器主要分为▁▁▁▁▁和▁▁▁▁两大类。
其中,如果根据气体流动方向,又可以分为▁▁▁▁▁和▁▁▁▁▁(8)一级不可逆反应,D L =1.5×10-9m 2/s ,k L =10-4m/s ,则关于反应速率常数k ,当▁▁▁▁▁时相当于快反应,当▁▁▁▁▁时属于慢反应。
(9)快速的气液反应是指▁▁▁▁的反应,这时反应区主要在▁▁▁▁,工业上可选用▁▁▁▁▁反应器;缓慢气液反应是指▁▁▁▁▁▁的反应,这时反应区主要在▁▁▁▁,工业上可选用▁▁▁▁▁▁反应器。
瞬间反应是指▁▁▁▁▁的反应,适用的反应器有▁▁▁▁▁▁▁。
(10)环流反应器是 ▁▁▁▁▁▁▁▁的一种。
根据环流的方式不同,可以分为▁▁▁▁▁和▁▁▁▁▁两种;根据环流的动力不同,可以分为▁▁▁▁▁和▁▁▁▁▁两种。
(11)空间速度是指▁▁▁▁▁▁▁▁▁▁▁▁▁▁接触时间是指▁▁▁▁▁▁▁▁▁▁▁▁▁▁(12)测定逗留时间分布的实验通常有▁▁▁▁法和▁▁▁▁▁法第一章 绪论1. 化学反应工程是一门研究______________的科学。
(化学反应的工程问题)2. 化学反应工程是一门研究化学反应的工程问题的科学,既以_______作为研究对象,又以_______为研究对象的学科体系。
(化学反应、工程问题)3. _______是化学反应工程的基础。

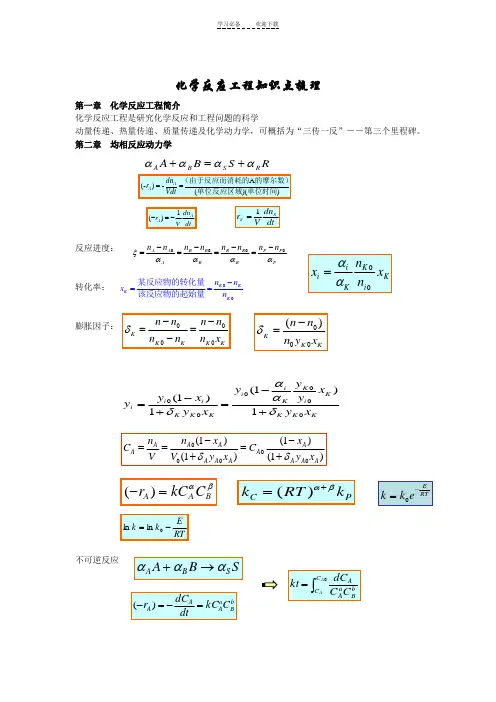
化学反应工程知识点梳理第一章化学反应工程简介化学反应工程是研究化学反应和工程问题的科学动量传递、热量传递、质量传递及化学动力学,可概括为“三传一反”--第三个里程碑。
第二章均相反应动力学反应进度:转化率:膨胀因子:不可逆反应A(-)-()()AAdnrVdt==(由于反应而消耗的的摩尔数)单位反应区域单位时间RSBARSBAαααα+=+1()AAdnrV dt-=-dtdnVr SS1=PPPRRRBBBAAAnnnnnnnnααααξ0-=-=-=-=K KKKn nxn-==某反应物的转化量该反应物的起始量KiKKiixnnxαα=0000KK K K Kn n n nn n n xδ--==-00()KK Kn nn y xδ-=KKKKiKKiiKKKiii xyxyyyxyxyy1)1(1)1(δααδ+-=+-=000(1)(1)(1)(1)A AA AA AA A A A A An xn xC CV V y x y xδδ--===++()A A Br kC Cαβ-=()C Pk RT kαβ+=ERTk k e-=RTEkk-=lnlnSBASBAααα→+bBaAAACkCdtdCr=-=-)(⎰=0AACC bBaAACCdCkt均相催化反应 CC 为催化剂浓度自催化反应A + C → 2C + R …串联反应总收率瞬时收率得率yield总选择性 目的产物P 所生成的摩尔数与副产物S 生成的摩尔数之比,用S0表示:平行反应串联反应()()AA C A dC r kC C dt-=-=CA A A C kCdt dCr =-=-)(A + B P R+S 00PP P A A n n n n -Φ=-/()/p P P A A A r dC dt dC P A r dC dt dC φ====---单位时间内生成的摩尔数单位时间内消耗的摩尔数00/)(A P P P n n n X -=000PP S S n n S n n -=-αA2A αS S (副)αA1A αP P (主),11A A r k C -=(),22A A r k C -=(),1,212()()AA A A A dC r r r k k C dt-=-+-=+=()()A A P A A p P P C k r dt dC r 11,1,1,)(αααα-=--==AA S S S C k dt dC r 22,αα-==tk k A A eC C )(021+-=A P S (均为一级反应)k 1k 2P A P P C k C k dt dC r 21-==PSS C k dt dC r 2==第三章 理想均相反应器 间歇反应器(BSTR)反应时间实际操作时间(operating time)= 反应时间(t) + 辅助时间auxiliary time (t') 反应体积V 是指反应物料在反应器中所占的体积 V = v0 (t + t')为装料系数(the volume charge coefficient),通常在0.4~0.85平推流反应器PFR 空时全混流反应器(CSTR)绝热操作恒容间歇反应器的设计式为:变温平推流反应器⎰⎰--=-=A A A C C A Ax A A A r dC r dx C t 0)()(00等容过程,液相反应 VV ϕ=实际实际的反应器体积为:0V v τ==反应器的容积进料的体积流量0R V dV t v ==⎰反应器中物料反应期的容积的体积流量000()()A A A AA A C C C x V v r r τ-===--0()A A A x V F r =-005000024R R R F v C M ==⨯00000000()(1)A A A A A A x x x A AA A A A E nx x x n n A ART A A dx dx dx t C C C r kC k e C x -===--⎰⎰⎰1001()A A x A A n xA t I x dx k C -=⎰20()()4A A A P A F dx r dV r D dl π=-=-20()4A A A dx D r dl F π-=00000()A x A A A A A dx V V F r v C C τ===-⎰化学反应工程研究的目的是实现工业化学反应过程的优化 全混流平推流多级CSTR 串联的优化对于一级不可逆反应应有PFR: 同间歇釜CSTR:全混流反应器的热衡算方程第四章 非理想流动 停留时间分布()⎰-==A x AAA B A B r dx C t F V 000BR : ()⎰-==Ax A AA P A P r dxCF V 000τPF R: ()000m m A A A A V x F C r τ-==-CST R: 112100010200...(1)(1)(1)Am Am A A A R A A A A A A Am x x x x x V v C kC x kC x kC x -⎛⎫---=+++ ⎪---⎝⎭0121110(1,2,.....1)(1)1Ai RAi Ai Ai v x V i m x k x x -+⎡⎤-∂=-==-⎢⎥∂--⎣⎦11111Ai Ai Ai Ai Ai Ai x xx x x x -++--=--221max 1max 02()k k k P P A C k X C k -==max max 1202211[(/)1]P P A C X C k k ==+1212ln(/)opt k k k k τ=-121opt k k τ=)()1())((0000Pm P P r A c v UAT T c v UA T c v H r V ρρρ+-+=∆--)()1(000P m P r c v UAT T c v UAT Q ρρ+-+= (){}E t P t residence time t t ∆=<<+停留时间分布函数 (){}=<F t P residence time t方差PFRCSTR最大层流流动 轴向扩散模型 0()()d t F t E t t=⎰22222()()()()()()t t t E t dtt t E t dt t E t dt tE t dtσ∞∞∞∞-==-=-⎰⎰⎰⎰0 t t () t t 0 t t E t <⎧⎪=∞=⎨⎪>⎩2220()()()0t t t E t dt t t σ∞=-=-=⎰0 t t () 1 t tF t <⎧=⎨≥⎩()11()t tt tF t e E t et---=-=222 1.0ttθσσ==22()()[2()]r r F t R R =-222/222()2()(1)212()(1)Z t uL E z z Pe tE Ee uL uL e Pe Peθσσ--==--=--。


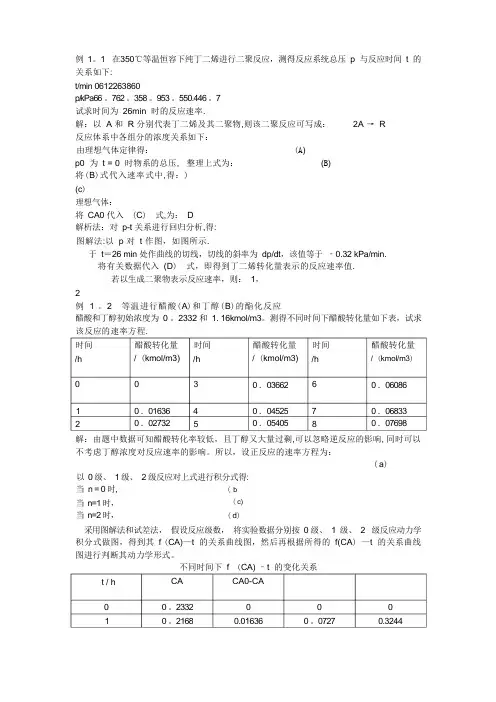
例 1。
1 在350℃等温恒容下纯丁二烯进行二聚反应,测得反应系统总压 p 与反应时间 t 的 关系如下:t/min 0612263860p/kPa66 。
762 。
358 。
953 。
550.446 。
7试求时间为 26min 时的反应速率.解:以 A 和 R 分别代表丁二烯及其二聚物,则该二聚反应可写成: 2A → R 反应体系中各组分的浓度关系如下:由理想气体定律得: (A ) p0 为 t = 0 时物系的总压, 整理上式为: (B ) 将(B )式代入速率式中,得:) (c )理想气体:将 CA0 代入 (C ) 式,为: D解析法:对 p-t 关系进行回归分析,得: 图解法:以 p 对 t 作图,如图所示.于 t =26 min 处作曲线的切线,切线的斜率为 dp/dt ,该值等于 ‐0.32 kPa/min. 将有关数据代入 (D ) 式,即得到丁二烯转化量表示的反应速率值.若以生成二聚物表示反应速率,则: 1, 2例 1 。
2 等温进行醋酸(A )和丁醇(B )的酯化反应醋酸和丁醇初始浓度为 0 。
2332 和 1. 16kmol/m3。
测得不同时间下醋酸转化量如下表,试求 该反应的速率方程.解:由题中数据可知醋酸转化率较低,且丁醇又大量过剩,可以忽略逆反应的影响, 同时可以 不考虑丁醇浓度对反应速率的影响。
所以,设正反应的速率方程为:(a )以 0 级、 1 级、 2 级反应对上式进行积分式得:当 n = 0 时,当 n=1 时,当 n=2 时,(b (c)(d )采用图解法和试差法, 假设反应级数, 将实验数据分别按 0 级、 1 级、 2 级反应动力学 积分式做图,得到其 f (CA)—t 的关系曲线图,然后再根据所得的 f(CA ) —t 的关系曲线 图进行判断其动力学形式。
不同时间下 f (CA) –t 的变化关系CA0-CA0 0.01636CA0 。
2332 0 。


