盐类的水解(讲义)
- 格式:doc
- 大小:106.00 KB
- 文档页数:6

《盐类的水解》讲义一、盐类水解的定义在溶液中,盐电离出来的离子跟水所电离出来的 H⁺或 OH⁻结合生成弱电解质的反应,叫做盐类的水解。
例如,氯化铵(NH₄Cl)在水溶液中,氯化铵电离出的铵根离子(NH₄⁺)会与水电离出的氢氧根离子(OH⁻)结合生成弱电解质一水合氨(NH₃·H₂O),从而使溶液呈现酸性。
二、盐类水解的实质盐类水解的实质是盐电离出的离子破坏了水的电离平衡,促进了水的电离。
水是一种弱电解质,存在着电离平衡:H₂O ⇌ H⁺+ OH⁻。
当盐溶解在水中时,盐电离出的某些离子(如弱酸根离子或弱碱阳离子)会与水电离出的 H⁺或 OH⁻结合,生成弱电解质,导致溶液中 H⁺和OH⁻的浓度不再相等,使溶液呈现出酸碱性。
以醋酸钠(CH₃COONa)为例,醋酸钠电离出的醋酸根离子(CH₃COO⁻)会与水电离出的 H⁺结合生成弱电解质醋酸(CH₃COOH),使得溶液中 OH⁻浓度大于 H⁺浓度,溶液呈碱性。
三、盐类水解的特点1、可逆性盐类水解是可逆反应,存在水解平衡。
例如,NH₄Cl 的水解反应:NH₄⁺+ H₂O ⇌ NH₃·H₂O + H⁺,在一定条件下达到平衡状态。
2、吸热性盐类水解是酸碱中和反应的逆反应,中和反应是放热反应,所以盐类水解是吸热反应。
升高温度,水解平衡会向右移动,水解程度增大。
3、微弱性盐类水解的程度一般都很小,通常不考虑水解产物对溶液酸碱性的影响。
但对于某些双水解反应,水解程度可能较大。
四、影响盐类水解的因素1、盐的本性组成盐的酸或碱越弱,水解程度越大。
例如,相同浓度的碳酸钠(Na₂CO₃)和醋酸钠(CH₃COONa)溶液,由于碳酸比醋酸更弱,所以碳酸钠的水解程度大于醋酸钠。
2、浓度盐的浓度越小,水解程度越大。
稀释溶液,水解平衡向右移动。
3、温度温度越高,水解程度越大。
4、溶液的酸碱度外加酸或碱会抑制或促进盐的水解。
例如,在氯化铵溶液中加入盐酸,会抑制氯化铵的水解;在醋酸钠溶液中加入氢氧化钠,会抑制醋酸钠的水解。

(1)一般来说,盐类水解的程度不大,应该用“”表示。
盐类水解一般不会产生沉淀和A AA A AA 气体,所以不用符号“↓”和“↑”表示水解产物。
如:CuCl 2、NH 4NO 3水解的离子方程式:Cu 2++2H 2O Cu(OH)2+2H +、NH +H 2O NH 3·H 2O +H +。
A AA A AA +4A AA A AA (2)多元弱酸盐的水解是分步进行的,水解离子方程式要分步表示。
如Na 2CO 3水解反应的离子方程式:CO +H 2O HCO +OH -、HCO +H 2O H 2CO 3+OH -。
2-3A AA A AA -3-3A AA A AA (3)多元弱碱阳离子的水解简化成一步完成,如FeCl 3溶液中:Fe 3++3H 2O Fe(OH)A AA A AA 3+3H+。
(4)能完全水解的离子组是由于水解相互促进的程度较大,书写时要用“===”“↑”“↓”等,如NaHCO 3与AlCl 3混合溶液反应的离子方程式:Al 3++3HCO ===Al(OH)3↓+3CO 2↑。
-3二、水解平衡常数(能水解的盐表示为MA)(1)表达式:若MA 为强碱弱酸盐K h =,如醋酸钠溶液c OH - ·c HAc A -CH 3COO -+H 2O CH 3COOH +OH -,K h =。
A AA A AA c CH3COOH ×c OH -c CH3COO -(2)K h 与K W 、K a 、K b 之间的关系①盐的水解平衡常数与对应的一元弱酸(或弱碱)的电离平衡常数的乘积等于K W ,则K h =或K h =。
K WK a K WK b ②多元弱酸强碱盐,如Na 2CO 3的K h 1=、K h 2=K W K a2K WK a1③一元弱酸一元弱碱盐,如醋酸铵:K h =。
K WK a ×K b 1.水溶液呈碱性的正盐是A .B .C .KOHD .3NaHCO 3CH COONa24H SO 2.宏观辩识与微观探析是化学的学科核心素养之一。

333 盐类的水解课件优秀课件一、教学内容本节课的教学内容来自于高中化学选修教材《有机化学》第五章第三节“盐类的水解”。
具体内容包括:1. 盐类水解的概念和类型;2. 盐类水解的规律和影响因素;3. 不同类型的盐类水解反应及其应用。
二、教学目标1. 让学生理解盐类水解的概念,掌握盐类水解的规律和影响因素;2. 培养学生运用盐类水解知识分析和解决实际问题的能力;3. 通过对盐类水解的学习,提高学生的科学素养和创新能力。
三、教学难点与重点1. 盐类水解的规律和影响因素;2. 不同类型的盐类水解反应及其应用;3. 盐类水解在实际生活中的应用。
四、教具与学具准备1. 教具:多媒体课件、黑板、粉笔;2. 学具:教材、笔记本、彩笔。
五、教学过程1. 情景引入:通过生活中的实例,如烹饪、制药等领域,引导学生思考盐类水解的应用,激发学生的学习兴趣。
2. 知识讲解:(1)介绍盐类水解的概念,解释盐类水解的类型;(2)讲解盐类水解的规律,如“谁强谁显性,谁弱谁水解”;(3)分析影响盐类水解的因素,如温度、浓度等。
3. 例题讲解:分析实际案例,让学生理解不同类型的盐类水解反应及其应用。
4. 随堂练习:为学生提供一些有关盐类水解的练习题,巩固所学知识。
5. 课堂讨论:组织学生就盐类水解在实际生活中的应用进行讨论,培养学生的创新能力和团队合作精神。
六、板书设计板书设计如下:盐类水解1. 概念:盐类在水中发生水解反应的现象2. 类型:酸碱盐水解、酸式盐水解、碱式盐水解3. 规律:“谁强谁显性,谁弱谁水解”4. 影响因素:温度、浓度等5. 应用:烹饪、制药等领域七、作业设计(1)烹饪中使用的醋和糖混合液;(2)制药过程中使用的碳酸氢钠。
2. 答案:(1)醋和糖混合液中,醋酸为弱酸,糖为非电解质,混合液呈酸性。
碳酸氢钠为弱碱,与醋酸发生水解反应,醋酸钠和二氧化碳,从而降低溶液酸性;(2)碳酸氢钠在制药过程中作为缓冲剂,可以调节溶液的pH值,同时其水解反应可以释放二氧化碳,用于制造气泡。



第30讲盐类水解目录考情分析网络构建考点一盐类水解原理【夯基·必备基础知识梳理】知识点1 盐类水解知识点2 盐类水解规律知识点3 盐类水解方程式的书写【提升·必考题型归纳】考向1 考查盐类的水解及溶液的酸碱性考向2 考查盐类水解规律及应用考点二盐类水解的影响因素及应用【夯基·必备基础知识梳理】知识点1 影响盐类水解的因素知识点2 盐类水解的应用知识点3 水解常数及应用【提升·必考题型归纳】考向1 考查盐类水解的影响因素考向2 考查盐类水解的应用考向3 考查水解常数的应用与计算考点三水溶液中粒子的数量关系【夯基·必备基础知识梳理】知识点1 电解质溶液中的三大守恒知识点2 电解质溶液中粒子浓度大小比较知识点3 水溶液中函数图像分析【提升·必考题型归纳】考向1 考查单一溶液中粒子浓度大小比较考向2 考查混合溶液中粒子浓度大小比较真题感悟考点一 盐类水解原理知识点1 盐类水解1.定义:在溶液中盐电离出来的离子跟水电离产生的H +或OH -结合生成弱电解质的反应。
2.条件:可溶性盐必须有弱酸根离子或弱碱阳离子 3.实质:盐电离→⎩⎪⎨⎪⎧⎭⎪⎬⎪⎫弱酸的阴离子→结合H +弱碱的阳离子→结合OH -→破坏了水的电离平衡→水的电离程度增大→溶液呈碱性、酸性或中性。
4.特点(1)可逆:水解反应是可逆反应;(2)吸热:水解反应是酸碱中和反应的逆反应; (3)微弱:水解反应程度很微弱。
知识点2 盐类水解规律1. 盐的分类与盐溶液的酸碱性“有弱才水解、无弱不水解、越弱越水解、都弱都水解、越热越水解、越稀越水解、谁强显谁性、同强是中性”。
知识点3 盐类水解方程式的书写1.一般要求水解记三点:①水写分子式,②中间用可逆(),③后无沉气出。
即盐类水解一般不会产生沉淀和气体,所以不用符号“↓”和“↑”表示水解产物。
如NH4Cl水解的离子方程式为NH+4+H2O NH3·H2O+H+。
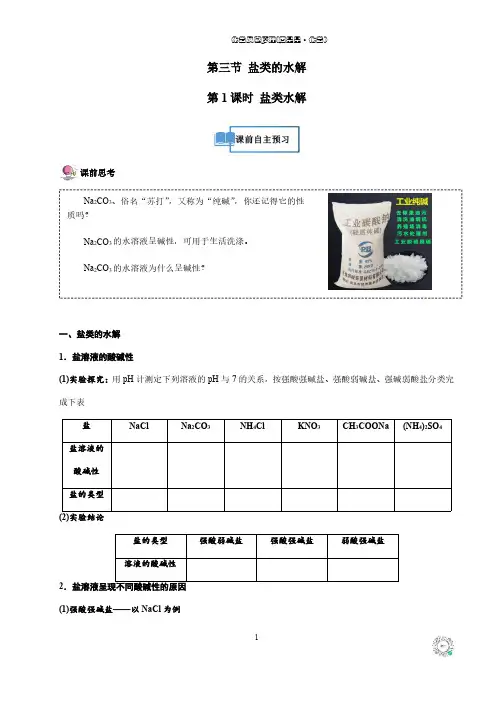
第三节盐类的水解第1课时盐类水解课前思考Na2CO3、俗名“苏打”,又称为“纯碱”,你还记得它的性质吗?Na2CO3的水溶液呈碱性,可用于生活洗涤。
Na2CO3的水溶液为什么呈碱性?一、盐类的水解1.盐溶液的酸碱性(1)实验探究:用pH计测定下列溶液的pH与7的关系,按强酸强碱盐、强酸弱碱盐、强碱弱酸盐分类完成下表盐NaCl Na2CO3NH4Cl KNO3CH3COONa(NH4)2SO4盐溶液的酸碱性盐的类型(2)实验结论盐的类型强酸弱碱盐强酸强碱盐弱酸强碱盐溶液的酸碱性2.盐溶液呈现不同酸碱性的原因(1)强酸强碱盐——以NaCl为例H2O H++OH-NaCl===Na++Cl-离子间能否相互作用生成弱电解质否c(H+)和c(OH-)的相对大小溶液中c(H+)=c(OH-),呈中性理论解释水的电离平衡不发生移动,溶液中c(H+)=c(OH-) (2)强酸弱碱盐——以NH4Cl为例溶液中存在的离子离子间能否相互作用生成弱电解质是c(H+)和c(OH-)的相对大小溶液中c(H+)>c(OH-),溶液呈酸性NH+4和OH-结合生成弱电解质NH3·H2O,使水的电离平衡向理论解释电离方向移动,使溶液中c(H+)>c(OH-)总反应离子方程式(3)强碱弱酸盐——以CH3COONa为例溶液中存在的离子离子间能否相互作用生成弱电解质是c(H+)和c(OH-)的相对大小溶液中c(H+)<c(OH-),溶液呈碱性CH3COO-和H+结合生成弱电解质CH3COOH,使水的电离平理论解释衡向电离方向移动,使溶液中c(H+)<c(OH-)总反应离子方程式3.盐类水解(1)概念:在水溶液中,盐电离出来的弱酸根阴离子或弱碱阳离子跟水电离出来的H+或OH-结合生成弱电解质的反应,叫做盐类的水解(2)实质:生成弱酸或弱碱,使水的电离平衡被破坏而建立起新的平衡盐电离―→结合H+―→结合OH 破坏了水的电离平衡水的电离程度增大c (H+)≠c (OH -)溶液呈碱性、酸性或中性(3)条件:盐中必须有弱酸根阴离子或弱碱根阳离子,即有弱才水解,强酸强碱盐不水解(4)盐类水解的特点(5)水解的规律:有弱才水解,无弱不水解;谁弱谁水解,谁强显谁性;越弱越水解,都弱双水解;同强显中性盐的类型强酸强碱盐强酸弱碱盐强碱弱酸盐实例是否水解水解的离子溶液的酸碱性溶液的pH (25℃)注意①“越弱越水解”指的是盐对应的酸(或碱)越弱,水解程度越大,溶液的碱性(或酸性)越强,若酸性HA>HB,那么相同浓度的NaA 和NaB 溶液,后者的碱性强如:CH 3COOH 的酸性比HClO 的酸性强,则相同浓度时,CH 3COO -的水解程度比ClO -小,后者的碱性强②同浓度的NaHCO 3和CH 3COONa 溶液相比,谁的碱性强?为什么?③同浓度的NH 4Cl 和Cu(NO 3)2溶液相比,谁的酸性强?为什么?【对点训练1】1.下列关于盐类水解反应说法正确的是()A.任何盐都可发生水解反应B.盐只能发生水解反应而不能发生其他反应C.盐水解反应肯定能破坏水的电离平衡且促进水的电离D.盐的水溶液为中性时,则盐一定不发生水解反应2.下列关于盐溶液呈酸碱性的说法错误的是()A.盐溶液呈酸碱性的原因是破坏了水的电离平衡B.NH4Cl溶液呈酸性是由于溶液中c(H+)>c(OH-)C.在CH3COONa溶液中,由水电离的c(OH-)≠c(H+)D.水电离出的H+(或OH-)与盐中的弱酸根离子(或弱碱阳离子)结合,造成盐溶液呈碱(或酸)性3.下列溶液中,因为电离产生的离子发生水解而显酸性的是()A.NaHCO3B.NaHSO3C.CuSO4D.Ca(NO3)24.下列物质的水溶液中,因水解显碱性的是()A.NaClO B.Na2SO4C.CuCl2D.KAl(SO4)25.下图表示的是某离子X与水的反应过程,离子X可能是()A.CO2-3B.HCO-3C.Na+D.NH+46.现有S2-、SO2-3、NH+4、Al3+、HPO2-4、Na+、SO2-4、AlO-2、Fe3+、HCO-3、Cl-等离子,请按要求填空:(1)在水溶液中,离子水解呈碱性的是_________________________(2)在水溶液中,离子水解呈酸性的是__________________________(3)既能在酸性较强的溶液里大量存在,又能在碱性较强的溶液里大量存在的离子有______________(4)既不能在酸性较强的溶液里大量存在,又不能在碱性较强的溶液里大量存在的离子有_______________二、盐类水解方程式的书写1.书写形式:盐中的离子+水弱酸+OH-,如:R-+H2O HR+OH-显碱性盐中的离子+水弱碱+H+,如:M++H2O MOH+H+显酸性2.书写要求:盐类水解程度一般很小,水解产物很少,通常不生成沉淀和气体,也不发生分解,因此书写水解的离子方程式时,一般用“”连接,产物不标“↑”或“↓”,也不把生成物(如NH 3·H2O、H2CO3等)写成其分解产物的形式。


盐类的水解 知识讲义(一)盐类的水解实验:把少量的醋酸钠、氯化铵、氯化钠的晶体分别投入三个盛有蒸馏水的试管,溶解,然后用pH 试纸加以检验。
现象:CH 3COONa pH>7 )()(-+<OH c H c NH 4Cl pH<7 )()(-+>OH c H c NaCl pH=7 )()(-+=OH c H c思考:醋酸钠、氯化铵都是盐,是强电解质,他们溶于水完全电离成离子,电离出的离子中既没有氢离子,也没有氢氧根离子,OH -与H +毫无疑问都来自于水的电离;也就是说,由水电离出来的H +和OH -的物质的量浓度总是相等的,为什么会出现不相等的情况呢?分析:醋酸钠电离出来的离子跟水发生了作用。
CH 3COONa === Na + + CH 3COO -+H2O OH - + H +CH 3COOHCH 3COO -能与水溶液中的氢离子结合生成难电离的醋酸分子,从而使水的电离向正反应方向移动,这时,)(3-COO CH c 下降,)(-OH c 升高、)(+H c 下降, 使得)()(-+<OH c H c ,溶液呈碱性。
化学方程式为:CH 3COONa + H 2O CH 3COOH +NaOH1. 盐类的水解:在溶液中由盐电离出的弱酸的阴离子或弱碱的阳离子跟水电离出的氢离子或氢氧根离子结合生成弱电解质弱酸或弱碱,破坏了水的电离平衡,使其平衡向右移动,引起氢离子或氢氧根离子浓度的变化。
醋酸钠与水反应的实质是:醋酸钠电离出的醋酸根离子和水电离出的氢离子结合生成弱电解质醋酸的过程。
氯化铵与水反应的实质是:氯化铵电离出的铵离子和水电离出的氢氧根离子结合生成弱电解质一水合氨的过程。
水解的结果:生成了酸和碱,因此盐的水解反应是酸碱中和反应的逆反应。
酸+碱盐+水2. 水解离子方程式的书写:① 盐类水解是可逆反应,要写“”符号② 一般水解程度很小,水解产物很少,通常不生成沉淀和气体,不用“↑”“↓”符号。

第三节 盐类的水解一、盐类的水解(一)盐的分类1、按组成分:正盐:电离时生成的阳离子是金属离子(或铵根),阴离子为酸根离子的盐酸式盐:电离时生成的阳离子除金属离子(或铵根)外还有氢离子,阴离子为酸根离子的盐。
碱式盐:电离时生成的阴离子除酸根离子外还有氢氧根离子,阳离子为金属离子(或NH 4+)的盐。
2、按溶解性:易溶盐(NaCl );微溶盐(CaSO 4);难溶盐(BaCO 3)3、按形成盐的酸碱的强弱不同:强酸强碱盐(KNO 3)、强酸弱碱盐(NH 4Cl )、强碱弱酸盐(NaF )、弱酸弱碱盐(CH 3COONH 4)(二)盐溶液呈现不同酸碱性的原因——盐类的水解1、定义:在溶液中,盐电离出来的离子与水电离出来的H +或OH -结合生成弱电解质的反应,叫做盐类的水解2、实质:22()()H O H O OH c H c OH H -+-+⎧⎫−−−→⇒→→≠⎨⎬⎭⎩弱碱阳离子弱碱盐电离出来的离子破坏水的电离平衡促进水的电离弱酸阴离子弱酸→溶液呈酸性或碱性表示为:盐+H 2O酸+碱3、特点:(1)极其微弱,为可逆反应,存在水解平衡(2)是中和反应的逆反应,水解反应是吸热反应4、规律:有弱就水解,无弱不水解;越弱越水解,都弱都水解;谁强显谁性,同强显中性 注:(1)组成盐的酸越弱,水解程度越大。
例如:水解程度:Na 2CO 3 >CH 3COONa ,因为酸性:H 2CO 3 <CH 3COOH(2)同浓度的正盐比其酸式盐水解程度大。
例如:0.1mol/L 的Na 2CO 3 >0.1mol/L 的NaHCO 3(3)弱酸酸式盐的酸碱性,看电离与水解程度大大小。
HCO 3-、HPO 42-、HS - 以水解为主→显碱性HSO 3-、H 2PO 4- 以电离为主→显酸性5、盐类水解方程式的书写 (1)一般原则:①必须写“”②不写“↑”“↓” ③H 2CO 3、H 2SO 3等不拆开④多元弱酸阴离子分步水解,分步书写,以第一步为主;多元弱碱阳离子水解方程式一步写完⑤遵守质量守恒、电荷守恒、客观事实(2)书写模式:盐的离子+ H2O弱酸(或弱碱)+OH-(或H+)举例:CH3COONa溶液:CH3COO-+ H2O CH3COOH+OH-NH4Cl溶液:NH4++ H2O NH3·H2O +H+Na2CO3溶液:CO32-+H2O HCO3-+ OH-(第一步水解)HCO3-+ H2O H2CO3+ OH-(第二步水解)FeCl3溶液:Fe3++3H2O Fe(OH)3+3H+(3)双水解——阴阳离子都水解①非彻底型:用“”连接例:CH3COONH4:CH3COO-+ NH4++H2O CH3COOH+NH3·H2O(CH3COONH4显中性)②彻底型:用“=”连接。

欢迎阅读盐类的水解平衡一、盐水解的实质盐电离出弱酸阴离子弱碱阳离子,即可与水电离出的H+或OH—结合成电解质分子,从而促进水进一步电离与中和反应的关系:盐+水酸+碱(两者至少有一为弱)由此可知,盐的水解为中和反应的逆反应,但一般认为中和反应程度大,大多认为是完全反应,但盐类的水解程度小得多,故为可逆反应,真正发生水解的离子仅占极小比例。
有弱才水解,无弱不水解越弱越水解,弱弱都水解谁强显谁性,等强显中性,具体为:1.正盐溶液①强酸弱碱盐呈酸性②强碱弱酸盐呈碱性③强酸强碱盐呈中性④弱酸碱盐不一定取决于弱酸弱碱相对强弱2.酸式盐①若只有电离而无水解,则呈酸性(如NaHSO4)②若既有电离又有水解,取决于两者相对大小电离程度>水解程度,呈酸性电离程度<水解程度,呈碱性强碱弱酸式盐的电离和水解:如H3PO4及其三种阴离子随溶液pH变化可相互转化:pH值增大H3PO4H2PO4—HPO42—PO43—pH减小③常见酸式盐溶液的酸碱性碱性:NaHCO3、NaHS、Na2HPO4、NaHS.酸性(很特殊,电离大于水解):NaHSO3、NaH2PO4、NaHSO4例1浓度为0.1mol/L的8种溶液:①HNO3②H2SO4③HCOOH ④Ba(OH)2⑤NaOH ⑥CH3COONa ⑦KCl ⑧NH4Cl溶液pH值由小到大的顺序是(填写编号)____________.二、影响水解的因素内因:盐的本性.外因:浓度、湿度、溶液碱性的变化(1)温度不变,浓度越小,水解程度越大.(2)浓度不变,湿度越高,水解程度越大.(3)改变溶液的pH值,可抑制或促进水解。
即向使条件改变影响减弱的方向移动。
三、分析盐溶液中微粒种类.例如Na2S和NaHS溶液溶液含有的微粒种类相同,它们是Na+、S2—、HS—、H2S、OH—、H+、H2O,但微粒浓度大小关系不同.比较盐溶液中离子浓度间的大小关系.(1)一种盐溶液中各种离子浓度相对大小①当盐中阴、阳离子等价时[不水解离子] >[水解的离子] >[水解后呈某性的离子(如H+或OH—)] >[显性对应离子如OH—或H+]实例:aCH3COONa. bNH4Cla.[Na+]>[CH3COO—] >[OH—]>[H+]b.[Cl—] >[NH4+]>[H+]>[OH—]②当盐中阴、阳离子不等价时。
第03讲盐类的水解目录01考情透视·目标导航.................................................................................................................. 02知识导图·思维引航.................................................................................................................. 03考点突破·考法探究...................................................................................................................考点一盐类的水解及其影响因素..............................................................................................知识点1盐类的水解.................................................................................................................知识点2盐类水解规律..............................................................................................................知识点3盐类水解离子方程式的书写.........................................................................................考向1盐类的水解规律..............................................................................................................考向2水解方程式.....................................................................................................................考点二盐类水解的影响因素及应用...........................................................................................知识点1盐类水解的影响因素....................................................................................................知识点2盐类水解的应用...........................................................................................................考向1盐类水解平衡移动及结果分析...................................................................................考向2盐类水解的应用...............................................................................................................考向3水解平衡原理解释问题的规范描述...................................................................................考点三溶液中粒子浓度大小关系...............................................................................................知识点1熟悉两大理论,构建思维基点....................................................................................知识点2把握三种守恒,明确等量关系....................................................................................考向1离子浓度大小比较.........................................................................................................考向2粒子浓度变化曲线......................................................................................................... 04真题练习·命题洞见....................................................................................................................考点一盐类的水解及其影响因素知识点1盐类的水解名师提醒】盐类的水解反应是中和反应的逆反应,所以水解程度比较微弱,且为吸热反应。
盐类的水解(讲义)
一、知识点睛
1.盐类的水解
(1)定义
在溶液中由盐电离产生的离子与水电离产生的H+或OH-结合生成
_____________的反应,叫做盐类的水解反应,简称盐类的水解。
(2)实质
盐电离出的弱酸酸根离子(或弱碱阳离子)与水电离出的H+(或OH-),
结合生成弱电解质,破坏了水的电离平衡,水的电离程度________,
溶液中______与______不再相等,溶液呈现一定的酸性或碱性。
(3)水解条件
①盐能溶于水或易溶于水;
②盐在水溶液中能电离出弱酸酸根离子或弱碱阳离子。
注:常见的弱碱阳离子:
Fe3+、Al3+、Fe2+、Cu2+、Zn2+、NH4+等。
常见的弱酸酸根离子:
CO32-、SO32-、CH3COO-、S2-、HS-、ClO-、F-、HCO3-、HSO3-、
PO43-、HPO42-、SiO32-等。
2.盐类的水解规律
简记为:有弱才水解,无弱不水解,越弱越水解,谁强显谁性。
3.水解反应表达式
(1)一元弱酸酸根离子水解或一元弱碱阳离子水解
CH3COO-的水解:__________________________
NH4+的水解:______________________________
(2)多元弱酸酸根离子水解(分步进行,以第一步为主)
CO32-的水解:______________________________
______________________________
(3)多元弱碱阳离子水解(分步进行,以总反应表示)
Fe3+的水解:_______________________________
注:①盐类的水解是酸碱中和反应的逆反应;
②大多数水解反应进行的程度很小,水解产物很
少,无明显沉淀或气体生成。
4.影响盐类水解的因素
(1)温度:温度越高,水解程度_______。
(2)浓度:浓度越小,水解程度_______。
(3)外加试剂
①加酸可以_______弱碱阳离子水解,可以_______弱酸酸根离子水
解;
②加碱可以_______弱碱阳离子水解,可以_______弱酸酸根离子水
解;
③加入与水解产物相同的离子,水解程度_______,加入能与水解产物
反应的物质,水解程度_______;
④弱酸酸根离子与弱碱阳离子混合,水解反应相互促
进,水解程度增大。
5.水解原理的应用
(1)热碱水去油污
加热促进CO32-水解。
(2)硫酸铝钾或硫酸铝做净水剂
Al3+水解生成的Al(OH)3胶体具有吸附作用。
(3)配制溶液
配制FeCl3、SnCl2等易水解的盐溶液时,为抑制Fe3+、Sn2+水解,加入
适量盐酸。
(4)泡沫灭火器
浓NaHCO3溶液和浓Al2(SO4)3溶液混合,水解反应相互促进,迅速产
生大量泡沫。
二、精讲精练
1.下列关于盐溶液呈酸性或碱性的说法错误的是()
A.盐溶液呈酸性或碱性的原因是破坏了水的电离平衡
B.NH4Cl溶液呈酸性是由于溶液中c(H+)>c(OH-)
C.在CH3COONa溶液中,由水电离的c(OH-)≠c(H+)
D.水电离出的H+或OH-与盐电离出的弱酸酸根离子或弱碱阳离子结合,造成盐溶液呈酸性或碱性
2.下列方程式中,属于水解反应的是()
A.NH3+H23•H2O
B.HCO3-+H22CO3+OH-
C.H2O+H23O++OH-
D.Cl2+H2++Cl-+HClO
3.氯化铵晶体溶于重水(D2O)中,溶液呈酸性,下列说法正确的是()
A.NH4+水解生成NH3•H2O和D+
B.NH4+水解生成NH3•HDO和H+
C.NH4+水解生成NH3•D2O和H+
D.NH4+水解生成NH3•HDO和D+
4.下列物质的水溶液,由于水解而呈酸性的是()
A.NaHCO3B.Na2SiO3C.NaHSO4D.NH4Cl
5.物质的量浓度相同的三种一元酸的钠盐NaX、NaY、NaZ溶液的pH分别为
7、8、9,则等物质的量浓度的这三种一元酸的酸性由强到弱的顺序是
()
A.HX、HY、HZ B.HZ、HY、HX
C.HX、HZ、HY D.HY、HX、HZ
6.浓度均相同的①NaHCO3②Na2CO3③NaCl ④NH4Cl⑤HCl五种溶液,
按pH值由小到大排列的顺序是()
A.①②③④⑤B.⑤④③①②
C.⑤④③②①D.②①④③⑤
7.下列水解离子方程式书写正确的是()
A.Br-+H2-
B.HS-+H22-+H3O+
C.Al3++3H23↓+3H+
D.PO43-+H242-+OH-
8.写出下列盐溶液水解的离子方程式:
(1)(NH4)2SO4溶液
(2)Na2SO3溶液
(3)Cu(NO3)2溶液
9.关于FeCl3溶液水解的说法错误的是()
A.水解达到平衡时加水稀释,平衡向右移动
B.浓度为5 mol•L-1和0.5 mol•L-1的两种FeCl3溶液,其他条件相同时,
Fe3+水解程度前者比后者小
C.有50℃和20℃的同浓度的FeCl3溶液,其他条件相同时,Fe3+的水解程度前者比后者小
D.为较好地保存FeCl3溶液,应加入少量HCl抑制Fe3+水解
10.在CH3COONa溶液里,加入下列物质使水解平衡向左移动,并且pH变大的
是()
A.加入少量NaCl固体B.加入少量NaOH固体
C.加水稀释D.加入少量CH3COOH
11.向浓度为0.1 mol•L-1的K2CO3溶液中分别加入下列物质,能使c(CO32-)
增大的是()
A.H2O B.CO2C.KHSO4固体D.KOH固体
12.为使K2S溶液中c(K+)/c(S2-)变小,可加入()
①适量HCl(g) ②适量NaOH(s) ③适量KOH(s)
④适量NaHS(s) ⑤适量的水
A.②④B.①②⑤C.②③D.③④⑤
13.25℃时,浓度相同的下列溶液中,NH4+浓度最小的是()
A.NH4Cl B.NH4HSO4
C.CH3COONH4D.(NH4)2SO4
14.下列与盐的水解有关的是()
①实验室配制AlCl3溶液时,先溶在盐酸中,而后加水稀释
②草木灰与铵态氮肥不能混合施用
③蒸干AlCl3溶液得不到无水AlCl3
④用MgO或MgCO3除去MgCl2溶液中的Fe3+
⑤实验室盛放Na2CO3、Na2SiO3等溶液的试剂瓶应用橡皮塞,而不能用玻璃
塞
⑥NH4Cl溶液和ZnCl2溶液可做焊接金属时的除锈剂
A.①④⑤B.②③⑤C.③④⑥D.全部
15.普通泡沫灭火器的铁桶里有一只小玻璃桶,铁桶里盛饱和NaHCO3溶液和发
泡剂,玻璃桶内盛Al2(SO4)3溶液,使用时,倒置灭火器,两种物质混合就会喷出大量泡沫。
(1)写出此反应的离子方程式_______________________。
(2)不能把硫酸铝溶液装入铁桶的原因是:_____________
_____________________________________________。
(3)Al2(SO4)3溶液和NaHCO3溶液的浓度都为1 mol•L-1,则Al2(SO4)3溶液和NaHCO3溶液的体积比理论上应为___________。
(4)若用同浓度的Na2CO3溶液代替NaHCO3溶液,效果不如NaHCO3溶液,是因为____________________
____________________________________________。
【参考答案】
一、知识点睛
1.(1)弱电解质
(2)增大H+浓度OH-浓度
3.(1)CH3COO- + H23COOH + OH-
NH4+ + H23·H2O + H+
(2)CO32- + H23- + OH-
HCO3- + H22CO3 + OH-
(3)Fe3+ + 3H23 + 3H+
4.(1)越大
(2)越大
(3)①抑制促进②促进抑制
③减小增大
二、精讲精练
1. C
2. B
3. D
4. D
5. A
6. B
7. D
8.(1)NH4+ + H23·H2O + H+
(2)SO32- + H23- + OH-
(3)Cu2+ + 2H22 + 2H+
9. C
10.B
11.D
12.A
13.C
14.D
15.(1)Al3+ + 3HCO3-=Al(OH)3↓+ 3CO2↑
(2)Al2(SO4)3水解呈酸性,产生的H+能腐蚀铁桶
(3)1:6
(4)CO32-的第二步水解才会产生CO2且第二步水解较弱,反应速率慢。