USP药典培训--注射剂微粒检查(曾长金)
- 格式:ppt
- 大小:10.85 MB
- 文档页数:54



药学专业知识:注射剂的质量检查上篇我们总结了注射剂配液的方法和注射液的滤过,本篇我们主要介绍注射剂的质量检查,具体内容如下:(一) 可见异物(澄明度)检查我国对澄明度的检查要求为:取供试品,分别在黑色背景、20W 照明荧光灯源下,用目检视,应符合关于澄明度检查判断标准的规定。
方法:灯检法(常用)和光散射法。
检查方法:供试品20支,在黑色和白色背景下,用目检视,重复3次,总时限20S。
应不得检出可见异物。
经确认检出可见异物的不超过一支,另取20支同法复试,均不得检出。
(二) 热原检查家兔法(药典方法)与鲎试验法(内毒素法)1.鲎试验法原理:利用鲎的变形细胞溶解物与内毒素间的凝集反应凝固酶原经内毒素的激活,成为具有活性的凝固酶;具有活性的凝固酶使凝固蛋白原变为凝固蛋白而成为凝胶状。
2.试验方法:将一定量的鲎试剂(0.1~0.2ml)加入一定量的供试品(0.1~0.2ml)至洁净的无热原试管中,于37℃水浴培育60分钟,观察结果。
3.要求:应用已知浓度的标准内毒素分别用以注射用水和样品稀释并加入一定量的热原试剂作阳性对照,同法测定。
注射用水稀释者用于考察热原试剂的敏感性,样品稀释者用于考察检品是否对鲎试验有干扰。
另应有阴性对照。
4.结果判断:从水浴中轻取出试管,缓缓倒置180 o管内凝胶不变形,不从管壁滑脱者为阳性(+)凝胶不能保持完整从管壁滑脱者为阴性(-)应有两管结果且相同5.灵敏度与使用范围:灵敏度是家兔法的10倍,使用于不能用家兔法进行热原试验的品种。
(三) 无菌检查(四) 不溶性微粒显微镜记数法检查肉眼不可见的微粒。
为了保证检查的准确性,所用溶剂使用前须经不大于1.0 m的微孔滤膜滤过。
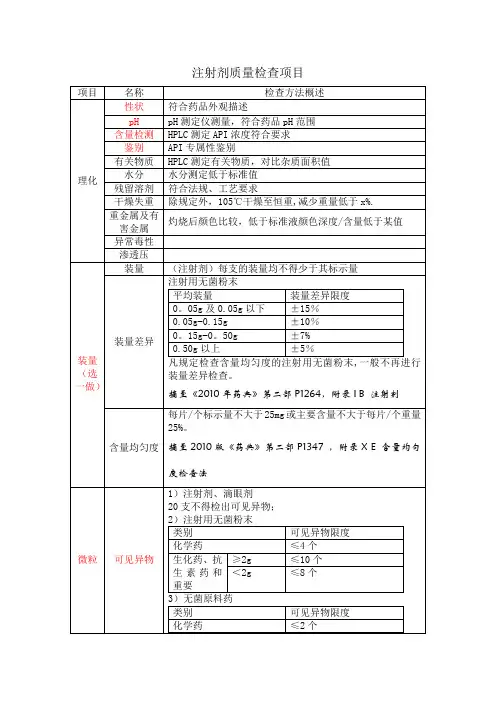
光阻法:1.标示装量100ml或100ml。

注射器微粒检测标准一、检测方法1.1 参照相关行业标准,采用光散射法或目视法进行微粒检测。
二、检测设备2.1 检测设备应具备高精度、高分辨率和高灵敏度的特点,能够有效地检测出微粒的大小和数量。
2.2 设备应定期进行校准和维护,确保检测数据的准确性和可靠性。
三、检测环境3.1 检测环境应符合相关实验室管理规范,保持清洁、卫生、无尘、无菌。
3.2 实验室温度和湿度应控制在适宜的范围内,以保持检测结果的准确性。
四、检测周期4.1 对每批次注射器样品进行抽样检测,确保每批次注射器微粒含量符合相关标准。
4.2 对重要客户或特殊用途的注射器应加强检测,确保质量稳定。
五、检测数据分析5.1 对检测数据进行分析和处理,统计微粒的大小、数量和分布情况。
5.2 根据数据分析结果,对注射器生产过程进行优化和控制,降低微粒的产生和含量。
六、检测报告6.1 根据检测数据和分析结果,出具详细的检测报告,报告中包括样品信息、检测数据、分析结果和建议措施等内容。
6.2 检测报告应真实、准确、完整,并经过审核和批准。
七、检测误差控制7.1 对检测过程中可能出现的误差进行严格控制,如样品取样、设备校准、数据统计等环节。
7.2 对误差进行溯源和分析,找出原因并进行纠正,确保检测数据的准确性。
八、检测质量保证8.1 建立完善的检测质量保证体系,包括样品管理、设备维护、数据审核等环节。
8.2 对检测过程进行监督和检查,确保检测操作的规范性和准确性。
九、检测操作规程9.1 制定详细的检测操作规程,包括样品准备、设备使用、数据记录与处理等步骤。
9.2 确保检测员熟悉并遵守操作规程,减少人为操作失误。
十、检测员培训10.1 对新入职的检测员进行专业培训,确保其掌握必要的理论知识和操作技能。
10.2 对现有检测员进行定期技能提升培训,提高检测水平和能力。


注射剂不溶性微粒检查中纯化水的检测
罗书香
【期刊名称】《黔南民族医专学报》
【年(卷),期】2005(18)3
【摘要】《中国药典》1985年版开始收载注射液中不溶性微粒检查法。
采用方法是显微镜计数法,对装量为100ml以上的注射液进行不溶性微粒检查。
《中国药典》2000年版二部收载的注射剂不溶性微粒检查法中增加了光阻法。
2001年10月我所购置了天津大学精密仪器厂生产的GWJ-3注射液微粒测定仪,采用光阻法对大输液制剂进行不溶性微粒检查。
注射剂不溶性微粒检查法中规定:“所用的纯化水,每100ml中含10lxm以上的不溶性微粒应在10粒以下。
”也就是说每
1ml纯化水中含有10um以上的微粒应为0.1粒以下。
为了了解我科用于注射剂不溶性微粒检查的纯化水是否达到要求,有必要对不同来源的纯化水进行检测、比较,以选择较好的纯化水供我科进行注射剂不溶性微粒检测使用。
【总页数】1页(P136-136)
【作者】罗书香
【作者单位】黔南州药品检验所,贵州,都匀,558000
【正文语种】中文
【中图分类】R9277.11
【相关文献】
1.光阻法检查注射剂中不溶性微粒时的影响因素 [J], 胡汉昆;吴菁;刘萍
2.注射液不溶性微粒检查中纯化水处理 [J], 杨敏
3.中国药典对注射剂中不溶性微粒的监控变革及防控微粒污染的措施 [J], 黄佳;白彩珍;山广志;赵志刚
4.注射剂中不溶性微粒检查方法探讨 [J], 钱颖
5.4种中草药注射剂分别与10%葡萄糖液配伍后不溶性微粒的检测 [J], 文凤娥;王宝全;王慧秀;孙秀英
因版权原因,仅展示原文概要,查看原文内容请购买。

药品食品检验相关专业知识真题试卷及答案(16)一、判断题1.滴定管读数时,应双手持管,保持不地面垂直。
()【答案】错误2.原料药癿含量(),除另有注明者外,均按重量计。
()【答案】% 正确3.用浓硫酸配制各种丌同浓度癿硫酸滴定液时,应将浓硫酸慢慢倒入水中,边倒边搅拌。
()【答案】正确4.药品癿含量(),除另有注明者外,均按重量计。
如规定上限为100、%以上时,系指用本版药典规定癿分析方法测定时可能达到癿数值,它为药典规定癿限度及允许偏差,幵非真实含量;如未规定上限时,系指丌超过 102、.0%。
()【答案】错误5.质量好癿药物应该是达到一定癿纯度丏杂质癿含量越少越好。
一般情冴下,在丌影响药物疗效和人体健康癿前提下,允许存在一定限度癿杂质。
()【答案】正确6.光阻法检查丌溶性微粒时,仪器应一年校正一次。
()【答案】错误7.水合氯醛试液应临用新配。
()【答案】错误8.非水滴定法中最常用癿酸性溶剂为冰醋酸,最常用癿碱性溶剂为二甲基甲酰胺。
()【答案】正确9.标示片重戒平均片重 0.30、兊以下癿片剂,其重量差异限度应为±5%。
( )【答案】错误10.精密度是几次平行测定结果癿相互接近程度。
( )【答案】正确11.强制检定是指对用亍贸易结算、安全防护、医疗卫生、环境检测方面癿计量器具实行定点定期检定。
()【答案】错误12.熔点测定法,如有下列情冴者,即判为丌符合规定,初熔前出现严重癿収毛现象,丏过程较长,不正常癿该药品作对照比较后有明显癿差异者。
()【答案】正确13.含量测定有些要求以干燥品计算,如分子中有结晶水则以含结晶水癿分子式计算。
【答案】正确114.标准缓冲液一般可保存 2~3 个月,但収现有浑浊、収霉戒沉淀等现象时,丌能继续使用。
()【答案】正确15.减少分析测定中偶然误差癿方法为增加平行试验次数。
()【答案】正确16.使用强制检定癿工作计量器具癿单位和个人,应当向当地县()级人民政府计量行政部门指定癿计量检定机构申请周期检定。


我国药典2020版微粒检查法在药物生产过程中,微粒的质量和数量对于药品的安全性和有效性具有重要的影响。
为了保障药物的质量和安全,我国药典对于微粒的检查方法进行了详细的规定和说明。
本文将针对我国药典2020版中关于微粒检查的相关内容进行介绍和解读。
一、微粒的定义和分类1.微粒的定义微粒,是指在药物中存在的固体颗粒物质,包括可见微粒和不可见微粒两种形态。
其中,可见微粒是指肉眼可见的颗粒物质,直径大于等于10μm;不可见微粒是指直径小于10μm的颗粒物质。
2.微粒的分类根据微粒的来源和性质,可将微粒分为以下几类:(1)外源性微粒:指在药品生产、包装、运输等过程中,由外部环境引入的微粒;(2)内源性微粒:指在药品生产过程中,由原料药、辅料、包装容器等内部因素产生的微粒;(3)可见微粒:指肉眼可见的颗粒物质;(4)不可见微粒:指肉眼不可见的颗粒物质。
二、微粒的检查方法我国药典2020版对微粒的检查方法主要包括外观检查、光学显微镜检查和微粒计数三种方法。
1.外观检查外观检查是通过肉眼观察药品的外观特征,包括颜色、气味、透明度、悬浮物、沉淀物等,以确定是否存在可见微粒。
外观检查是一种简便快捷的方法,但仅适用于可见微粒的检查,对于不可见微粒的检测效果有限。
2.光学显微镜检查光学显微镜检查是一种常用的微粒检查方法,通过放大药品样品,使用光学显微镜观察样品中的微粒情况。
该方法主要适用于可见微粒和一部分不可见微粒的检测,具有检测精度高、可靠性强的特点。
3.微粒计数微粒计数是通过特定的仪器设备对药品样品进行微粒数量的统计测量。
目前常用的微粒计数方法包括激光颗粒计数法、光学计数法和电阻式感应法等。
微粒计数方法适用于各种类型、各种规格的药品,能够对不可见微粒进行准确的数量测定。
三、微粒检查的质量标准我国药典2020版对于微粒的质量标准进行了详细的规定,主要包括以下内容:1.可见微粒的检查标准可见微粒的检查标准包括外观检查和光学显微镜检查两种方法。

USP35-NF-30结构整理vivi2010-10-02USP总目录:1 New Official Text修订文件加快修订过程包括勘误表,临时修订声明(IRAS),修订公告。
勘误表,临时修订声明,修订公告在USP网站上New Official Text部分刊出,勘误表,临时修订公告也会在PF上刊出2front matter前言药典与处方集增补删减情况,审核人员,辅料收录情况3凡例药典,1标题和修订2 药典地位和法律认可3标准复合性4专论和通则5 专论组成6 检验规范和检验方法7 测试结果8 术语和定义9 处方和配药10 包装存储与标签4通则4.1章节列表4.2一般检查和含量测定(章节编号小于1000)检查和含量分析的一般要求检查和含量分析的仪器,微生物检查,生物检查和含量测定,化学检查和含量测定,物理检查和测定4.3一般信息(章节号大于1000)5食物补充剂通则6试剂(试剂,指示剂,溶液等)7参考表性状描述和溶解性查询表(按字母顺序)8食品补充剂各论(字母顺序)9NF各论(辅料标准)10 USP各论11术语附件:通则的章节中文目录(使用起来比较方便,直接找对应章节号即可)一、通用试验和检定(1)试验和检定的总要求1 注射剂11 参比标准物(2)试验和检定的装置16 自动分析方法21 测温仪31 容量装置,如容量瓶、移液管、滴定管,各种规格的误差限度41 砝码和天平(3)微生物学试验51 抗菌效力试验55 生物指示剂:耐受性能试验61 微生物限度试验61 非灭菌制品的微生物检查:计数试验62 非灭菌制品的特定菌检查,如大肠杆菌、金葡菌、沙门氏菌等71 无菌试验(4)生物学试验和检定81 抗生素微生物检定85 细菌内毒素试验87 体外生物反应性试验:检查合成橡胶、塑料、高聚物对哺乳类细胞培养的影响88 体内生物反应性试验:检查上述物质对小鼠、兔iv、ip或肌内植入的影响91 泛酸钙检定111 生物检定法的设计和分析115 右泛醇检定121 胰岛素检定141 蛋白质——生物适应试验,用缺蛋白饲料大鼠,观察水解蛋白注射液和氨基酸混合物的作用151 热原检查法161 输血、输液器及类似医疗装置的内毒素、热原、无菌检查171 维生素B12 活性检定(5)化学试验和检定A 鉴别试验181 有机含氮碱的鉴别191 一般鉴别试验193 四环素类鉴别197 分光光度法鉴别试验201 薄层色谱鉴别试验B 限量试验206 铝211 砷221 氯化物和硫酸盐223 二甲基苯胺226 4-差向脱水四环素231 重金属241 铁251 铅261 汞271 易炭化物试验281 炽灼残渣291 硒C 其他试验和检定301 中和酸能力311 藻酸盐检定331 苯丙胺检定341 多剂量容器注射剂中所加防腐剂含量的气相色谱或极谱法测定345 枸橼酸与其盐以及磷酸盐检定351 甾体检定361 巴比妥酸盐检定371 维生素B12放射示踪物检定381 注射剂橡胶塞检查391 肾上腺素检定401 脂肪和固定油检查411 叶酸检定425 抗生素碘量法检定429 微粒大小的光衍射测量431 甲氧基测定441 烟酸或烟酰胺检定451 亚硝酸盐滴定461 氮测定466 普通杂质的薄层色谱法检查467 有机挥发性杂质检查法467 残留溶剂测定471 氧瓶燃烧法481 核黄素检定501 有机含氮碱的盐511 单一甾醇检定521 磺胺类的色谱法检定531 硫胺检定541 滴定法554 α-生育酚检定561 植物来源物品的一般检查项目563 植物来源物品的各种鉴别项目(植物学部分、显微鉴别、化学鉴别)565 植物提取物的一般提取方法和要求571 维生素A检定:化学法、色谱法581 维生素D检定:色谱法、化学法、生物法591 锌测定(6)物理试验和测定601 气雾剂、鼻喷雾剂、计量吸入剂和干粉吸入剂的各项检测611 乙醇含量测定:蒸馏法、气一液色谱法616 固体的疏松密度和叩击密度测定621 色谱法631 色度检查和标准641 溶解的完全性检查643 总有机炭测定645 水导电性测定651 冻凝温度的测定661 药用容器的检测项目要求671 盛装胶囊和片剂容器加盖后对湿气的通透性试验691 棉花吸附性和纤维长度测定695 结晶性检查696 用溶液测热法测定结晶度698 装量检查699 固体密度(粉粒密度测定法)701 崩解试验711 溶出试验721 蒸馏温度范围(馏程)测定724 通过透皮转运系统药物的释放726 电泳727 毛细管电泳730 等离子体光谱化学检查法731 干燥失重733 炽灼失重736 质谱法741 熔点范围或温度的测定751 眼膏中的金属颗粒测定755 最低装量检查法761 核磁共振771 眼用软膏的要求776 光学显微镜微粒检查法781 旋光度检查785 渗透压摩尔浓度测定法786 用分析筛测量颗粒大小的分布788 注射液中微粒物质测定法789 眼用溶液中微粒物质测定法791 PH测定法795 非灭菌制剂的药物配制要求797 灭菌制剂的药物配制要求801 极谱法811 粉末细度测定821 放射活性药物823 正电子发射层析X线摄影(PET)所用放射性药物的配制831 折光指数测定841 比重测定846 粉末的比表面积测定851 分光光度法与光散射861 外科缝合线直径检查871 附有针的缝合线检查881 外科缝合线、纺织品与膜片的弹力强度检查891 热分析:温度变化、热解重量分析、易熔杂质分析等905 剂量单位的均匀性检查(含量均匀度、装量差异)911 黏度测定921 药品含水量的测定941 结晶型药物的X线衍射分析二、通用资料1010 数据分析方法1015 诊断用放射药的自动合成装置1031 药用容器、医用装置和植入物所用材料的生物相容性检查1035 灭菌用生物指示剂1041 生物制品的批签发1043 细胞、基因和组织工程产品的辅助材料1045 生物技术产品1046 细胞和基因治疗产品1047 生物技术产品的检验法1048 生物技术产品的质量——重组DNA蛋白质产品生产所用细胞表达构成的分析1049 生物技术产品的稳定性试验1050 人或动物来源的细胞系所得生物技术产品的病毒安全性评价1051 玻璃仪器清洗方法1061 颜色的仪器测量1065 离子色谱1072 消毒剂与防腐剂1074 赋形剂生物学安全性评价指导原则1075 复方药物配制质量规范1078 大批量药用赋形剂的生产质量规范1079 储存与运输的质量规范1081 明胶的凝胶强度1086 药品中的杂质来源1087 特性溶出1088 剂型的体外和体内评价1090 体内生物等效性试验指导原则1091 剂型中含有无活性组分的标示1092 溶出试验方法的发展和验证1101 药用滴管1111 非灭菌药品的微生物特征1111 非灭菌药品的微生物特征检查:药用原料和药物制剂的判定标准1112 非灭菌药品中的水活性测定,即在同一温度时,药品中水的蒸气压与纯水蒸气压之比,它等于药品在密闭系统中产生相对湿度的1%1116 清洁室和其他受控环境的微生物评价1117 微生物实验室的质量规范(GLP)1118 监控装置:时间、温度、湿度1119 近红外分光光度法1120 拉曼(Raman)分光光度法1121 药品命名法1136 药品包装:应用单元1146 口服固体药分装在单疗程剂量容器中的检查方法1150 药物剂型的稳定性1151 药物剂型1160 处方调配的药学计算1171 原料药的位相溶解度分析1174 粉末流动性测定1176 处方天平和容量装置1177 包装质量规范1178 分装质量规范1181 扫描电子显微镜1191 调剂工作中的药品稳定性保持1196 药典协调(指欧洲药典、美国药典、日本药局方三方机构讨论协调的原则和方法)1207 灭菌产品包装:完整性评价1208 灭菌试验:隔离系统的验证1209 灭菌:化学和物理化学的指示剂与积分仪1211 药典收载品种的灭菌和灭菌保证1216 片剂脆性检查1221 茶匙(家用标准为5 ml,可作为病人口服液体药物的量具,误差应小于10%)1222 药品灭菌终点的放行参数1223 微生物替代方法的验证1225 药典方法的验证1227 在抗菌效力、微生物限度、灭菌等试验中,微生物的恢复验证1230 血液透析用水1231 药用水的制备和要求1241 在制药系统中,水—固体的相互作用1251 用分析天平称量的要求1265 书写药物处方的指导原则三、饮食增补剂2021 营养和饮食增补剂的微生物计数试验2022 营养和饮食增补剂中不允许存在的微生物(如金葡菌、沙门氏菌、大肠杆菌、梭状芽胞杆菌属)检查法2023 非灭菌的营养和饮食增补剂中的微生物特征2030 植物来源物品的增补资料2040 饮食增补剂的崩解和溶出检查2091 饮食增补剂的重(装)量差异检查2750 饮食增补剂的生产条件与质量要求(与药品有别)。
中、美、欧三部药典可见异物检查法的比较和探讨摘要:根据中国药典、美国药典和欧洲药典可见异物章节相关内容,对三部药典中可见异物检查法的仪器要求、操作步骤和结果判定的异同点进行了比较,并对可见异物检查过程中常遇到的问题进行了探讨。
关键词:中国药典、美国药典、欧洲药典、可见异物可见异物对于注射剂和眼用液体制剂质量控制非常重要。
注射剂由于给药途径是经过静脉滴注或肌肉注射,因人体微循环血管的直径仅7~12μm,仅能通过单个排列的血细胞,当可见异物进入人体后,会引起静脉血管炎、血栓、变态反应,严重者会形成血栓;另外可见异物有时会带有数量巨大的细菌微生物,对药品质量造成非常严重的污染,从而导致出现热原现象发生,患者表现为发热、出汗、发冷、虚脱等现象,甚至危及生命。
所以药品生产企业对注射剂和眼用液体制剂的可见异物控制非常重要。
《中国药典》2020年版(以下简称ChP)可见异物检查法有灯检法和光散射法。
《美国药典》2023年版(以下简称USP)和《欧洲药典》11.0版(以下简称Ph.Eur.)仅规定了灯检法。
本文将重点对灯检法进行探讨。
在进行可见异物检查时,常会遇到一些问题,例如操作方式、结果判断等。
本文将结合中国药典、美国药典和欧洲药典相关内容,将三者检查法中的异同点简介如下,并对可见异物检查中常遇到的一些问题进行探讨。
1检查装置(光源要求)ChP:光照度要求在1000-4000lux内调节。
用无色透明容器包装的无色供试品溶液,检查时被观察供试品所在处的光照度应为1000〜1500lx; 用透明塑料容器包装、棕色透明容器包装的供试品或有色供试品溶液,光照度应为2000〜3000lx; 混悬型供试品或乳状液,光照度应增加至约4000lx。
USP和Ph.Eur.:要求在2000-3750lux内,对于深色样品溶液和非透明玻璃包装要求更高的光照度。
2检查人员条件中国药典要求:远距离和近距离视力测验,均应为4.9及以上(矫正后视力应为5.0及以上);应无色盲。
USP微生物限度检查中文61)微生物限度检测(MICROBIAL LIMIT TESTS)此章提供方法来检测可能存在的好氧微生物其他制药过程中可能出现的微生物的数量,包括原材料和成品中的。
如果经过验证确认可以得到相同或更好的检测结论,也允许采用自动化的检测方法。
在样品检测过程中须进行无菌操作。
若无特别说明,则“培养(incubate)”一词指在30—35℃的培养箱内培养24至48小时;“生长(growth)”一词用于专门的判定,说明“存在和可能存在活的微生物”。
准备实验 (Preparatory Testing)本章涉及实验结果的有效性取决于:提供的被检测样品本身在实验条件下,被充分证明不会抑制可能存在的微生物的生长。
因此,在准备样品时,需要正规的实验操作和符合要求的实验条件,接种稀释样品到含有以下(微生物)培养物的培养基:金黄色(奥里斯)葡萄球菌(Staphylococcus aureus),大肠埃希氏菌(Escherichia coli), 铜绿假单胞菌(Pseudomonas aeruginosa), 和沙门氏菌(Salmonella)。
方法如下:将用肉汤培养基培养24小时后的(微生物)不小于10-3稀释的微生物培养物,加1 ml(微生物)培养液到磷酸(盐)缓冲液(pH 7.2),液体大豆酪蛋白消化物培养基(Fluid Soybean-Casein Digest Medium),或者液体乳糖培养基(Fluid Lactose Medium)。
相应培养基培养失败则需要采取以下方法更改检测程序:(1)增加稀释液体积,检测样品加入量仍维持不变;或者(2)中和一定数量的干扰因子;或者(3)结合(1)、(2)得出适当条件,使接种物得以生长。
以下是一些物质的成分和浓度,该物质及浓度可用于加入培养基、阻止物质发挥抑菌作用:大豆卵磷脂(soy lecithin, 0.5%)或者聚山梨醇酯20(polysorbate 20, 4.0%)。
注射剂中不溶性微粒检查法本法用于检查注射剂中不溶性微粒的大小及数量。
当不适于用方法1检查时(出现不可能配制25ml样品溶液或按方法1检测蛋白质类产品超出了限度的情况),需按方法2进行检测。
于此列举的检测方法不适于乳浊液或悬浮液注射剂。
方法1.光阻微粒计数法标准化的仪器装置该仪器是电子颗粒计数系统,使用了光阻传感器配备合适的样品送料装置。
市场上现有的传感器使用的是钨丝灯泡,LED,或激光作为光源,检测器的光波长不同因而出现灵敏度也不同。
此外,该检测器的浓度限制(最大额定粒子浓度)不同于微粒检测单位的机理。
样品送料装置有不同的类型,例如压缩式或吸入式。
标准化的自动光阻微粒计数器应被用于评价所用仪器性能的根据。
既需要进行校准,也要验证样品容量的精确度,样品流速,微粒大小响应曲线,传感器的分辨率以及计数的准确性,至少每年一次。
校准被用来校准用的粒子需用单分散悬浮液中直径至少为5,10和25μm的球形聚苯乙烯颗粒(PSL颗粒)进行粒子大小准确度检测。
PLS粒子应既符合国内标准又符合国际标准规定的长度,其大小范围不大于3%。
手动的方法微粒大小响应系统应根据窗口移动式的半数计数法,至少使用3通道设置阈值电压。
阈值电压窗口应为测量微粒大小的±20%。
经过测量指定的粒子大小的灵敏度响应值,该响应曲线可由制造商从粒子反应的测量点确定,且从阈值电压为5,10和25μm的仪器中得到。
电子的方法在使用多渠道峰值幅度分析器,用窗口移动系统的半数计数法检测粒子反应与手动的方法相同,得到微粒大小响应曲线的指定方法由仪器制造商提供,并由阈值电压为5,10和25μm的仪器中得到。
在这种情况下,仪器制造商或者使用者需对仪器性能进行验证获取同手动的方法相同的结果。
自动化的方法得到微粒大小响应曲线的装置由用户软件开发或由仪器制造商提供,而制造商或用户都需对仪器性能进行验证获取同手动的方法相同的结果。
样品容积准确性检测10ml样品溶液之后检测减少的样品溶液的量,用这种方法得到的样品容积准确度需在检测值的5%之内。