27-第九章-醇和酚醚和环氧化合物
- 格式:ppt
- 大小:1.11 MB
- 文档页数:41


第九章 醇 酚 醚醇、酚、醚都可看作水分子中氢原子被烃基取代的衍生物。
若水分子中的一个氢原子被脂肪烃基取代,则称为醇(R -OH );被芳香烃基取代,称为酚(Ar -OH );若两个氢原子都被烃基取代,所得的衍生物就是醚(R -O -R',Ar -O -Ar',Ar -O -R )。
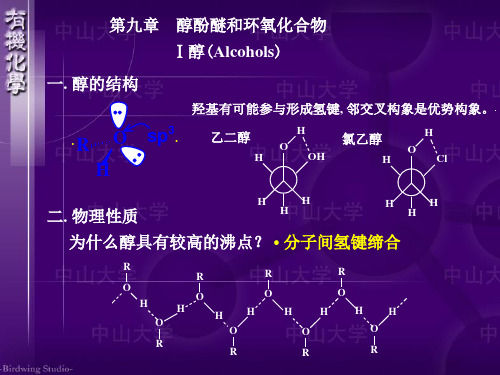
第一节 醇一、醇的结构、分类和命名 1.醇的结构醇分子中,羟基的氧原子及与羟基相连的碳原子都是sp 3杂化。
氧原子以一个sp 3杂化轨道与氢原子的1s 轨道相互重叠而成;C -O 键是碳原子的一个sp 3杂化轨道与氧原子的一个sp 3杂化轨道相互重叠而成的。
此外,氧原子还有两对未共用电子对分别占据其他两个杂化轨道。
甲醇的成键轨道如图9-1所示。
图9-1 甲醇的成键轨道示意图由于氧的电负性比碳和氢都大,使得碳氧键和氢氧键都具有较大的极性,醇为极性分子。
2.醇的分类按烃基的类型,醇可分为饱和醇、不饱和醇、脂环醇和芳香醇。
如: 正丁醇 烯丙醇 环戊醇 苄醇 (饱和醇) (不饱和醇) (脂环醇) (芳香醇) 按醇分子中所含羟基的数目可分为一元醇、二元醇和三元醇。
二元醇以上统称多元醇。
如:甲醇 乙二醇 丙三醇 (一元醇) (二元醇) (三元醇)羟基与一级碳原子相连接的称为一级醇(伯醇);与二级碳原子相连接的称二级醇(仲醇);与三级碳原子相连接的称三级醇(叔醇)。
如:一级醇(伯醇) 二级醇(仲醇) 三级醇(叔醇)饱和一元醇的通式为C n H 2n+1OH 。
3.醇的命名OHCHCH 2OHCH3CH 2CH 2CH 2OH CH 2CH 2OHOHOHCH 2CH 3OH CH 2OH CH 2CH CH 2R'OHRCH 2OH R CH R' R C R"(1) 习惯命名法 结构简单的醇采用习惯命名法,即在烃基后面加一“醇”字。
如:乙醇 异丙醇 叔丁醇(2) 系统命名法 系统命名法的命名原则如下:①选主链(母体) 选择连有羟基的最长的碳链为主链,支链为取代基;②编号 从靠近羟基的一端开始将主链的碳原子依次用阿拉伯数字编号,使羟基所连的碳原子位次最小;③命名 根据主链所含碳原子数称为“某醇”,将取代基的位次、名称及羟基位次写在“某醇”前。



醇、酚、醚一章勘误和思考题、习题参考答案勘误:1. P236 思考题9-5,第3小题,CH 2CH 3CH 3C CH 2CH 3CH 3CH 3C 将改成2. P236 倒数第二行,将烷基磺酸钠改成烷基硫酸钠。
3. P271 第一行,CH 3CH 2ONa CH 3CH 2Na 将改成。
4. P274 最后一行,不对称环氧化合物在酸性中的开环反应为S N 1反应,应先形成碳正离子。
反应历程改为:O C CH OCH 3CH 33CH 3CH 3OH CH CH 3CH 3HOCH 3CH 233OCH 3H C CH OHCH 3CH 35. P288 第19题化合物B(C 7H 5Br 3)应改成B(C 7H 5OBr 3)。
思考题参考答案:思考题9-1 不查表将下列化合物按沸点由高到低排序。
(1)1,2,3-丁三醇 > 1,2-丁二醇 > 正丁醇 > 丁烷(2)正辛醇 > 正己醇 > 3-己醇 > 二甲基正丙基甲醇 > 正己烷思考题9-2 将下列化合物按在水中的溶解度由大到小排序,并说明理由。
(3) >(2) >(1) >(4) >(5)理由:醇分子中羟基越多,与水形成的氢键越多,在水中的溶解度越大,醚也能与水形成氢键,因此溶解度比烃大。
思考题9-3 比较下列化合物与金属钠反应的活性,再将三种醇钠的碱性强弱排序。
CH 3CH 2CH 2CH 2OH CH 3CHCH 2CH 3CH 3C CH 3CH 3>>>(与金属钠反应的活性)CH 3C CH 3CH 3CH 3CHCH 2CH 3CH 3CH 2CH 2CH 2ONa (醇钠的碱性)>思考题9-4 将下列各组醇按与HBr 水溶液反应的相对活性排列成序。
CH 3CH 2OH CH 2OHO 2NCH 2OH >>(1)CH 2CH 2OHCH 2OH >>(2)CH 3思考题9-5 将下列各醇按脱水的活性大小排序。
第九章醇、酚、醚的结构与性质前言(1) 醇的结构与性质醇分子可以看成是水分子中氢原子被烃基取代的产物或烃分子中氢原子被羟基(﹣OH)取代的产物。
和水分子一样,醇分子中氧原子也是sp3杂化的,sp3杂化的氧原子分别与烃基和氢形成2个σ键,还有两对孤电子对,在两个sp3杂化轨道上,因此醇分子不是直线型,而是角型的,所以醇分子是极性分子。
由于醇中含有羟基,分子间可以形成氢键,因此低级醇的熔点和沸点比分子量相近的碳氢化合物的熔点和沸点高得多。
随着分子量的增加,羟基在醇分子中比例减小,羟基对醇的影响减小,从而使高级醇的物理性质与烷烃近似。
低分子量的醇可以与水形成氢键而互溶。
羟基是醇的官能团,醇的化学性质也是由羟基引起的,主要是羟基的活性;羟基被取代的反应;羟基的氧化反应以及β﹣H的活性等。
(2) 酚的结构与性质酚羟基与芳羟基直接相连,羟基氧原子是sp2杂化的,还有一对孤电子在未杂化的p轨道上,p电子云正好能与苯环的大π键电子云发生侧面重叠,形成p-π共轭效应,其结果p电子云向苯环转移,而羟基氧氢之间的电子云向氧原子转移,使氢容易以离子形式离去,具有部分双键的性质,难以被取代,当氧原子电子云向苯环转移,使苯环电子云密度升高,因此苯环上发生亲电取代反应速度加快。
(3) 醚的结构与性质醚可以看作是水的两个氢原子被烃基取代所得的化合物。
氧原子也是 sp 3 杂化的,因此醚不是直线型结构,而是角形结构,醚是极性分子。
与醇相比,醚分子间不能形成氢键,沸点比同组分醇的沸点低得多,如乙醚沸点是34.6℃ ,而丁醇的沸点为117.8℃ 。
但是醚比分子量相近的烷烃分子的沸点高。
醚分子中的氧可与水形成氢键,所以醚在水中有一定溶解度,乙醚在水中溶解度为 8g/100ml ,对于环状醚,由于成环缘故,氧原子外突,形成氢键的能力较强,因此四氢呋喃, 1,4 ﹣二氧六环与水能混溶。
醚是一类相当不活泼的化合物(环醚除外),醚链对于碱,氧化物,还原剂都是十分稳定。