第二讲晶体化学式计算案例
- 格式:ppt
- 大小:5.41 MB
- 文档页数:51

晶体化学式的计算晶胞:晶体结构中的最小重复单元晶胞中微粒数的计算方法——均摊法:如某个粒子为N个晶胞所共有,则该粒子有1N属于这个晶胞。
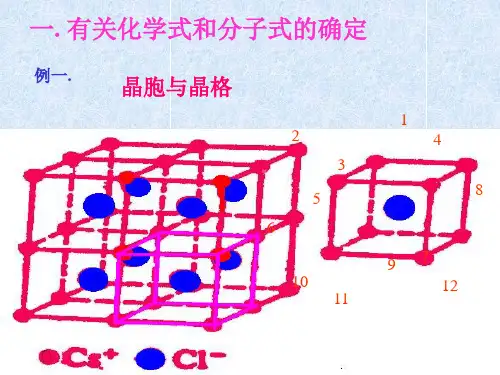
中学中常见的晶胞为立方晶胞,立方晶胞中微粒数的计算方法如下:例题:1、偏钛酸钡晶体中晶胞的结构如图所示,它的化学式是__________。
BaTiO3。
例题2、利用“卤化硼法”可合成含B和N两种元素的功能陶瓷,右图为其晶胞结构示意图,则每个晶胞中含有B原子的个数为,该功能陶瓷的化学式为。
2、BN练习:1、据报道,某种含有镁、镍和碳三种元素的晶体具有超导性,该新型超导晶体的一个晶胞的结构如右图所示,则该晶体的化学式为。
(4)MgNi3C2、立方(磷化硼)的晶胞结构如右图所示,晶胞中含B原子数目为。
磷化硼的化学式为 4 BP3、科学家把C60和K掺杂在一起制造出的化合物具有超导性能,其晶胞如右图所示。
该化合物中的K原子和C60分子的个数比为。
3:14、(1)Zn(a)与S(b)所形成化合物晶体的晶胞如图所示。
在1个晶胞中,a离子的数目为。
该化合物的化学式为。
ZnS(2) 以四氯化钛、碳化钙、叠氮酸盐作原料,可以生成碳氮化钛化合物。
其结构是用碳原子取代氮化钛晶胞(结构如图1)顶点的氮原子,这种碳氮化钛化合物的化学式为。
(3) 图2是由Q、Cu、O三种元素组成的一种高温超导体的晶胞结构,其中Cu为+2价,O为-2价。
Q的化合价为价。
+35、氯化铯型晶体的晶胞如图1,该晶体的化学式为6、铜的氢化物的晶体结构如图2所示,写出此氢化物在氯气中燃烧的化学方程式:。
7、铁铝合金的一种晶体属于面心立方结构,其晶胞可看成由8个小体心立方结构堆砌而成。
已知小立方体如下图所示,该合金的化学式为。
8、硼化镁晶体在39 K时呈超导性。
在硼化镁晶体中,镁原子和硼原子是分层排布的,图1是该晶体微观结构的透视图,图中的硼原子和镁原子投影在同一平面上。
则硼化镁的化学式为。
MgB29、氮化铝(其晶胞如图所示)可由氯化铝与氨经气相反应制得。



高中化学晶体结构计算题详解高中化学中,晶体结构计算题是一个重要的考点。
这类题目要求学生根据给定的晶体结构图或者晶体的化学式,计算出晶体中各种离子的个数以及离子的配位数。
这类题目对于学生来说可能有一定的难度,但只要掌握了一些基本的计算方法和技巧,就能够轻松解答。
首先,我们来看一个具体的例子。
假设有一种晶体,化学式为AB2C3,其中A为阳离子,B和C为阴离子。
题目要求计算出晶体中A、B、C离子的个数以及它们的配位数。
首先,我们需要知道晶体中各种离子的个数与它们的化学式有关。
在这个例子中,化学式为AB2C3,意味着每个A离子与2个B离子和3个C离子结合。
因此,我们可以得出以下结论:A离子个数 = B离子个数 / 2 = C离子个数 / 3接下来,我们需要计算出晶体中各种离子的配位数。
配位数是指一个离子周围被其他离子或原子包围的个数。
在晶体中,每个离子都会被周围的离子或原子包围,因此我们可以通过计算每个离子周围的离子或原子个数来得到配位数。
在这个例子中,A离子的配位数等于与之相连的B离子和C离子的个数之和。
同样地,B离子的配位数等于与之相连的A离子和C离子的个数之和,C离子的配位数等于与之相连的A离子和B离子的个数之和。
通过以上的分析,我们可以得出以下结论:A离子配位数 = B离子个数 + C离子个数B离子配位数 = A离子个数 + C离子个数C离子配位数 = A离子个数 + B离子个数通过这个例子,我们可以看出晶体结构计算题的一些考点。
首先,我们需要根据化学式确定各种离子的个数。
其次,我们需要计算出各个离子的配位数。
这些计算都需要基于化学式和晶体结构图进行推导和分析。
在解答这类题目时,我们还可以运用一些技巧来简化计算过程。
例如,如果化学式中的离子有共同的倍数关系,我们可以通过简单的比例计算来得到各个离子的个数。
另外,我们还可以通过观察晶体结构图中的对称性来推断离子的配位数。
总结起来,高中化学晶体结构计算题是一个重要的考点。

矿物晶体化学式计算方法一、有关晶体化学式的几个基本问题1. 化学通式与晶体化学式化学通式(chemical formula)是指简单意义上的、用以表达矿物化学成分的分子式,又可简单地称为矿物化学式、矿物分子式。
晶体化学式(crystal-chemical formula)是指能够反映矿物中各元素结构位置的化学分子式,即能反映矿物的晶体化学特征。
举例:(1)钾长石的化学通式为:KAlSi3O8或K2O⋅Al2O3⋅6SiO2,而其晶体化学式则必须表示为K[AlSi3O8];(2)磁铁矿的化学式可以写为:Fe3O4,但其晶体化学式为:FeO⋅Fe2O3。
(3)具Al2SiO5化学式的三种同质多像矿物:红柱石、蓝晶石和夕线石具有不同的晶体化学式:红柱石:Al V Al VI OSiO4蓝晶石:Al2VI OSiO4矽线石:Al VI SiAl IV O5此外,还要指出的是,晶体化学式是最简化学式的Z倍(Z为单位晶胞分子数)。
如:金红石TiO2,其Z=2,因此,金红石的晶体化学式应该为:Ti2O4,锐钛矿的Z=4,它的晶体化学式为Ti4O8,板钛矿的Z=8,它的晶体化学式为Ti8O16。
2. 矿物中的水自然界中的矿物很多是含水的,这些水在矿物中可以三种不同的形式存在:吸附水、结晶水和结构水。
吸附水:吸附水以机械吸附方式成中性水分子状态存在于矿物表面或其内部。
吸附水不参加矿物晶格,可以是薄膜水、毛细管水、胶体水等。
当温度高于110︒C时则逸散,它可以呈气态、液态和固态存在于矿物中。
吸附水不写入矿物分子式。
结晶水:结晶是成中性水分子参加矿物晶格并占据一定构造位置。
常作为配位体围绕某一离子形成络阴离子。
结晶水的数量与矿物的其它组份呈简单比例。
如石膏:Ca[SO4] ⋅2H2O。
结构水(或称化合水):常以H2O+表示,结构水呈H+、OH-、H3O+等离子形式参加矿物晶格。
占据一定构造位置,具有一定比例。
通常以OH-最常见。



晶体的计算编辑整理:尊敬的读者朋友们:这里是精品文档编辑中心,本文档内容是由我和我的同事精心编辑整理后发布的,发布之前我们对文中内容进行仔细校对,但是难免会有疏漏的地方,但是任然希望(晶体的计算)的内容能够给您的工作和学习带来便利。
同时也真诚的希望收到您的建议和反馈,这将是我们进步的源泉,前进的动力。
本文可编辑可修改,如果觉得对您有帮助请收藏以便随时查阅,最后祝您生活愉快业绩进步,以下为晶体的计算的全部内容。
微专题:晶体的计算一.晶体化学式的确定(1)均摊法确定化学式关键点:顶点和棱边的确定规律:1.某晶体的一部分如图所示,这种晶体中A、B、C三种粒子数之比是( )A。
3∶9∶4 B.1∶4∶2C。
2∶9∶4 D。
3∶8∶42. 右图是由Q、R、G三种元素组成的一种高温超导体的晶胞结构,其中R为+2价,G为-2价,则Q的化合价为_____。
(2)配位数法确定化学式配位数的定义:确定方法:3。
如图甲所示为二维平面晶体示意图,所表示的物质化学式为AX3的是________(填“a”或“b”)。
(3)其它类型4。
海底有大量的天然气水合物,可满足人类1000年的能源需要。
天然气水合物是一种晶体,晶体中平均每46个水分子构建成8个笼,每个笼可容纳1个CH4分子或1个游离H2O分子。
若晶体中每8个笼只有6个容纳了CH4分子,另外2个笼被游离H2O分子填充,则天然气水合物的平均组成可表示为( )A。
CH4·14H2O B。
CH4·8H2OC。
CH4.7H 2O D。
CH4·6H2O5.V2O5溶解在NaOH溶液中,可得到钒酸钠(Na3VO4),;也可以得到偏钒酸钠,其阴离子呈如图3所示的无限链状结构(V位于体心),则偏钒酸钠的化学式为_____________________________。
二.晶体密度的计算基本思路:解题关键:6.下图所示的CaF2晶体,已知,两个距离最近的Ca2+核间距离为a×10-8cm,计算CaF2晶体的密度为________________.7 设N A 为阿伏加德罗常数的值,晶体的密度为ρg/cm3,CuCl 的摩尔质量为M g/mol,计算晶胞中距离最近的两个Cl原子间的距离为___________pm。


晶体化学式计算范文晶体化学是固体化学中的一个重要分支,研究晶体的结构、性质和合成方法。
晶体是一种高度有序的固体,具有明确而规则的晶格结构。
晶体化学式的计算是了解晶体结构和晶体性质的关键一步。
首先,晶体是由一个或多个晶体结构单元(晶胞)重复排列而成的。
晶体结构单元是晶体中最小的可重复单元,具有晶胞内各原子或离子的坐标位置和周围环境的信息。
晶胞的形状和大小由晶体的晶系决定,晶系包括立方晶系、四方晶系、正交晶系、六方晶系等。
晶体化学式的计算需要知道晶体中各种元素的相对位置和数量,以及晶体中离子或原子的配位方式。
在晶体化学中,主要采用X射线衍射、电子衍射和中子衍射等技术来确定晶体的结构。
这些技术可以通过测量晶体衍射角度和强度来确定晶体的晶胞参数和晶格类型。
晶胞参数包括晶胞的边长、夹角和原子位置。
晶体中的原子或离子是按照一定的配位方式排列的。
配位是指每个原子或离子周围有多少个邻近原子或离子与其相连。
常见的配位方式包括线性配位、方向配位和面心配位等。
根据配位方式可以确定晶胞中每个原子或离子的相对位置和周围环境。
晶体化学式计算的过程中还要考虑晶体的化学组成,即晶体中存在哪些元素以及元素的相对比例。
在晶体结构中,元素以化学式的形式表示,化学式包括元素符号和相对比例。
例如,在NaCl晶体中,化学式为NaCl,表示每个Na原子周围有一个Cl原子。
晶体化学式的计算除了实验技术外,还可以通过计算机模拟方法得到。
分子动力学模拟、量子力学计算和晶体结构数据库是常用的计算方法。
分子动力学模拟可以模拟晶体中原子或离子的运动轨迹和能量变化,通过优化计算可以得到晶体的稳定结构。
量子力学计算可以计算晶体中原子或离子的电子态和电子密度分布,从而确定晶体的化学成分和结构。
晶体结构数据库收集了大量已知晶体的结构信息,可以通过查询和比对来确定晶体化学式。
总之,晶体化学式计算是了解晶体结构和性质的重要一步,需要采用实验技术和计算方法相结合的方式进行。
煌敦市安放阳光实验学校晶体求算三方法一、图像法【例1】下图是石英晶体的平面示意图,它实际上是以硅原子为中心的正四面体形的立体状结构,则其最小的一个环上共有多少个原子?【解析】此题的关键是将石英的平面图形构建成立体图形。
石的立体状结构中最小的一个环为椅式六元环或,将石结构中的碳原子换成硅原子即为晶体硅的结构。
根据石英的平面示意图知,每两个硅原子之间有一个氧原子,在椅式六元环中按此规律插入氧原子得。
因此,石英晶体中最小的一个环上共有12个原子。
二、规律法【例2】在氮化硅中添加氧化铝,用氧原子取代一氮,用铝原子取代一硅,通过常压烧结即成为一代无机非金属材料氮氧化硅铝,即赛伦,其化学式通式为:()4~2x N O Al Si y x x x 6=-。
(1)赛伦属于_________(填晶体类型),并且有__________________特性(至少写出三种)。
(2)化学通式中y 值为_________(用含x 的代数式或某一具体数值表示)。
【解析】本题考查材料的一些性质,这些在课本中没有涉及。
但只要知道43N Si 为原子晶体,再联想原子晶体的性质即可得到答案。
(1)43N Si 为原子晶体,由于-2O 与-3N 、+3Al 与+4Si 的半径大小相近,用氧原子取代一氮,用铝原子取代一硅后,晶体类型不发生变化,因此赛伦为原子晶体。
原子晶体具有热稳性好、强度大、硬度大、耐高温、耐磨损、耐腐蚀特性。
(2)由元素正负化合价代数和于零可知: ()()()()()03y 2x 3x 4x 6=-⨯+-⨯++⨯++⨯-,解得,x 8y -=。
三、比例法 【例3】正硅酸根离子和多硅酸根离子的结构如下图所示(图中o 表示氧原子,硅原子位于四个氧原子形成的四面体的中心)。
若多硅酸根中硅原子数为n ,则多硅酸根离子的化学式为_____________。
【解析】此题可以用数学归纳法来解答。
1n =时,O 原子的个数为4,所带电荷4-;2n =时,O 原子的个数为7,所带电荷为6-;3n =时,O 原子的个数为10,所带电荷为8-……则多硅酸根离子的化学式为()-++1n 21n 3n O Si 。
一、化学式的确定考题中常给出物质结构的部分图要求写出其化学式,再进行其他相关计算。
均摊法在晶胞中求化学式是常用技巧,除了常见给出的平行六面体晶胞,有些题目为了增加陌生度和难度会给出其他不常见结构,我们要找到其重复出现单元,从而求出化学式。
1. 分子簇结构中化学式的确定常考的晶胞是立方体,也有长方体或其他平行六面体,在三维坐标中有晶胞参数a 、b 、c 及面夹角α、β、γ;考题也会考一些分子簇结构。
【例题1】一种由钛(Ti )原子和碳原子构成的气态团簇分子,分子模型如图1所示,其中圆圈表示钛原子,黑点表示碳原子,则其化学式为【解析】注意仔细审题,该结构就是其分子结构,并不是晶胞,不能用均摊法来计算,分子中含有的原子直接数总数就是其化学式:Ti 14C 13;若按均摊则会错数成TiC ,从而掉进命题人的命题陷阱。
【答案】Ti 14C 13【对策】在使用均摊法计算晶胞中微粒个数时,要注意晶胞的形状,不同形状的晶胞,应先分析任意位置上的一个粒子被几个晶胞所共有。
原则:晶胞任意位置上的一个原子如果是被n 个晶胞所共有,那么,每个晶胞对这个原子分得的份额就是n1。
另外需要注意审题,如本题看清楚是否为晶胞,不能思维定式,均摊就会出错。
2. 二维平面形结构化学式求算考题也会常考一些非三维立体结构,如二维平面形结构,要求判断其化学式。
【例题2】(节选重组题)(1)在某硼化镁晶体中,镁原子和硼原子是分层排布的,图2是该晶体微观结构的透视图,图中的硼原子和镁原子投影在同一平面上。
则硼化镁的化学式为(2)已知图3所示晶体的硬度很可能比金刚石大,且原子间以单键结合,试根据图3确定该晶体的化学式为【解析】(1)可直接看图2,每个Mg 周围有6个B ,而每个B 周围有3个Mg ,所以其化学式为MB 2。
(2)由图3可知,每个A 形成3个键,连三个B ,每个B 形成4个单键,连4个A ,故化学式B 3A 4或A 4B 3。
【答案】(1)MgB 2或B 2Mg (2)B 3A 4或A 4B 3【对策】二维晶体结构图一般是三维晶体结构(晶胞一般是平行六面体)投影得到,故截取的二维晶胞是平行四边形才有平移性。