制药设备包衣机用户需求标准
- 格式:docx
- 大小:41.99 KB
- 文档页数:12

包衣锅用户需求1、工艺描述薄膜包衣机制备薄膜包衣片。
待包衣片通过前门进入包衣锅,所需量的包衣混悬液借助一个新的计量泵和流速计从包衣制备容器到包衣锅内。
空气处理系统将保持干燥的空气流动,以及预热和干燥的温度在设定参数范围内。
片子包衣后将会从包衣机以最小或无手工操作方式释放到桶中。
该系统的配套设备包括空气处理单元,集尘系统,喷雾溶液的制备和添加系统,CIP(全自动在位清洗)/ WIP(在线清洗)系统,HMI(人机界面)的控制系统。
薄膜包衣机的设计和构建要考虑到将来可以轻松实现升级,包括进出料部分。
2、清洗,灭菌和卫生方法包衣机应提供CIP能力,供应商提供通过的专门的CIP装置。
CIP装置用纯化水应有甲方提供,且温度为目前甲方系统所定范围(范围从xx 到yy°C)。
CIP装置有能力提供清洗溶液在可变的温度设定点范围内(20-80°C)来清洗包衣系统。
清洗溶液为纯化水,带有温和型的酸碱洗涤剂添加系统的配件。
CIP装置包括适当大小的罐子,泵,换热器,注入阀等,用来提供包衣机所需的清洗环路。
供应商应建议如果需要泵,安装在包衣机后,将废物清洗液泵到甲方废物处理系统。
包衣机应有能力通过配方型类型系统来传到CIP流程,该系统允许灵活选择预先定义的不同类型溶液或温度的清洗循环(纯化水、热水、热弱碱性洗涤剂等)。
设计必须考虑到能够完成包衣机内部和外部的清洁,洗涤和排污,溶液传输线和所有的交叉管道运转。
供应商建议如果在选择将溶液制备容器融入清洗系统,那么在包衣锅或相互交叉管道中应无死角存在。
自动CIP中应该避免操作者的干预、手工清洁需求最小化。
3、要求以下表格详述了特定生产系统的用户需求,其分为以下三类。
每一个用户需求根据表格中的说明加以证实或测试。
所有要求应满足SMART原则(明确性、可衡量性、可达成性、可行性、可追踪性)。
3.1质量性质质量性质(QP)是可衡量的会产生法规或符合性相关影响的性质,可能会是下面的其中一个:3.1.1Critical Aspects 关键部分生产系统的关键部分指生产工艺及系统中的典型职能、特点、能力、性能,以确保生产质量及患者安全。

高效包衣机用户需求标准批 准 执行 签 名下面的签名表示对本URS 内容已经审核完毕,且表明已经为执行作好了准备。
在批准后,任何针对本文件的内容进行改变或修正的活动,都必须起到完善本URS 的作用,所有的改变或修正均应执行变更处理,并经过批准后作为本URS 的附件,与本URS 一并执行。
目录1.目的2.范围3.责任4.项目描述5.生产工艺要求6.生产能力要求7.设备功能配置要求7.1.总体要求7.2.包衣机系统7.3.热风系统7.4.过滤器装置7.5.排风系统7.6.喷雾系统7.7.集尘机设备7.8.结构材料7.9.逻辑及自动控制7.10.过程控制8.GMP要求8.1.工艺参数控制要求8.2.清洁要求8.3操作维护要求8.4技术文件要求8.5.数据完整性8.6.批记录打印9.EHS要求10.计算机系统要求10.1.硬件选型要求10.2.软件系统要求11.项目实施用户需求11.1.进度表11.2.法律和法规要求12.供货、服务要求12.1.计划12.2.URS响应和DQ12.3.FAT工厂测试12.4.SAT现场测试12.5.IQ/OQ安装/运行确认13.交货13.1.货物的运输13.2.安装13.3.培训14.售后要求15.变更管理需求16.变更历史及原因17.附件18.分发部门1.目的本URS需求标准旨在从项目和设备的角度阐述用户的需求,包括了用户对该项目的质量要求(符合新版GMP),描述了用户对高效包衣机的工作过程及功能的期望。
主要包括相关法规符合度和用户的具体需求,这份文件是构建起该项目和设备文件体系的基础,同时也是在高效包衣机的设计、制造、采购、验收和确认等过程中为用户和设备生产商提供双方可接受的依据标准。
设备生产商应在规定的时间内完成并达到本用户需求的设计目标和可接受的质量标准。
在本URS中用户仅提出基本的技术要求和设备的基本要求,并未涵盖和限制卖方设备具有更高的设计与制造标准和更加完善的功能、更完善的配置和性能、更优异的部件和更高水平的控制系统。

BGB-75C型高效包衣机用户需求(URS)设备名称:BGB-75C型高效包衣机××××××制药有限公司2015年1月19 日审核批准注:本文件描述为BGB-75C型高效包衣机的工艺技术要求,请文件审核和批准人员仔细阅读每一页后,将意见和建议单独附页在本文件后,在本页签名即代表已审阅并批准本文件的每一页。
目录1、总则1.1 设计依据、制作和验收标准...........................................................错误!未定义书签。
1.2规格参数........................................................................................错误!未定义书签。
1.3名称和体积....................................................................................错误!未定义书签。
1.4其他要求........................................................................................错误!未定义书签。
1.5EHS要求2.服务要求2.1包装运输要求2.2安装3.验证和文件3.1验证错误!未定义书签。
3.2文件资料要求错误!未定义书签。
4.服务和培训 (8)2.目的本用户需求文件旨在从项目和系统的角度阐述用户的需求,总括了项目对设备的质量需求,描述了用户对该设备的工作过程以及功能的期望,包括相关法规符合度以及用户的具体需求,本URS是构建项目和系统文件体系的基础,同时也是系统设计和验证的可接受标准的依据,设备生产商应在规定的时间内完成并达到本用户需求的设计目标和可接受的质量标准,在本URS中用户仅提出基本的技术需求和设备的基本要求,并未涵盖卖方设备具备更高的设计和制作标准、更完善的配置和性能、更加优异的部件和配件以及更高水平的控制系统和逻辑,卖方应该在满足本URS的前提下提供更高制作标准、更加优异的性能、更高质量和服务的产品。

药房包药机技术规格及要求版本:20090831一、投标要求1、本项目为“医院药房包药机”整合项目,投标人必须对项目涉及的所有系统整合、HIS联接、设备供货、药盒定制、场地设计、安装调试等服务整体负责投标。
2、系统必须达到医院中心药房药品自动化分配和包装的要求。
系统能够通过医院信息管理系统实现住院患者单剂量药品的发放和包装。
3、招标书中所有设备及相关服务包含在总投标价中,请提供详细配置清单(含设备型号规格和数量)和服务列表,投标价格为到用户价。
4、下列“系统招标技术参数及配置要求”中的“投标响应参数”有参数的栏目投标商必须列出注明数据。
5、投标人对本招标用户需求书中带*号条款的响应如偏离将导致废标。
6、投标人对招标规格一般条款的响应每偏离一条,评标价增加1%,总偏离条数超过20条将导致废标。
7、投标人提供设备生产厂家授权书原件。
8、生产厂商需通过ISO9001国际质量体系9、产品通过欧盟CE认证。
二、系统的其他要求1.系统配备及信息处理完成调试运行后能够满足医院现有住院发药速度需求。
2.整体系统的信息处理功能基本要求:(一)要求医院HIS系统现有环境要求描述:1、信息将包药机所需的药品统一编码,即通过药品编码,或者编码+类型+剂量+单位+厂家等信息确定一种药品。
HIS患者处方做到电子化传输。
2、包药机厂商提供中间接口文件格式,HIS系统为中间接口文件提供数据。
3、药房改造场地需提供必要的网络连接设备,接入口、网线,交换机等。
(二)系统供货商需要完成的工作内容:1、根据医院提供药品情况编制入机药品表,药品机位表.2、设计制作整合/片剂包药机的协同工作软件;3、设计自动药房系统协同工作HIS系统的接口表结构、字段等.5、免费按照用户需求及药品尺寸提供所定制的包药机药盒的药膜。
6、入机药品测量、药品包装测量工作。
7、连接测试网进行机器测试。
8、系统上线前准备工作。
9、上线后培训工作。
三、系统招标技术参数及配置要求序号招标技术参数规格和要求1 整体规格要求*1.1 单台全自动包药机可以装储药品种类的数量(不含非机储药品数量), ≥?种1.2 必须通过HIS系统传送医嘱信息,包药机将单剂量自动包装同一药袋内.1.3 要求与HIS实现无缝隙连接,直接接收HIS传输过来的包药信息.*1.4 人工备用储药盘手工添加药槽(半片药、备用药) ≥40个,每台包药机配置2个人工备用储药盘上面的托盘。

gmp对制剂生产设备的要求GMP对制剂生产设备的要求包括以下几个方面:1. 设备能力和生产运行:制剂生产设备应具备与生产相适应的设备能力,能够实现最经济合理、安全的生产运行。
2. 制药工艺要求:设备应满足制药工艺所要求的完善功能及多种适应性。
3. 品质一致性:保证药品加工中品质的一致性是制剂生产设备的重要要求。
4. 操作和维修:设备应易于操作和维修,方便工作人员快速掌握设备的操作技巧,提高工作效率。
5. 清洗:设备应易于进行内外清洗,确保设备的清洁卫生,防止药品的交叉污染。
6. 接口配套:各种接口应符合协调配套要求,确保设备之间的连接顺畅,减少生产过程中的故障。
7. 安装和移动:设备应易安装、易移动,具备组合的可能,方便企业在不同生产场景下灵活调整设备布局。
8. 验证:设备应进行必要的验证,包括设备的型式、结构、功能等,以确保设备的性能和可靠性。
9. 可靠性、稳定性和易维修性:制药设备应采用优质材料和先进的加工技术,具备可靠性、稳定性和易维修性的特点。
这些特点可以确保设备在连续生产过程中不易出现故障,保证药品的质量和产量。
同时,设备的易维修性也至关重要,以便在设备出现故障时能够及时进行维修和更换。
10. 自动化、智能化和信息化:制药设备应具备自动化、智能化和信息化的特点,能够实时监测和控制药品的生产过程,确保药品质量的稳定和一致。
通过自动化和智能化技术,可以提高生产效率,减少人为操作失误,降低质量风险。
同时,信息化技术的应用可以帮助企业实现生产数据的实时采集、分析和追溯,提高生产管理的科学性和有效性。
11. 能源利用和环保性能:制药设备应具备高效的能源利用和环保性能。
采用节能技术和环保材料可以减少对环境的影响和能源的消耗,降低药品的生产成本。
同时,企业应关注设备的能效标准和环保法规要求,确保设备的合规性和可持续性。
12. 符合相关法规和标准:制药设备应符合相关法规和标准的要求,包括国际药品规范、国家药品管理法规、行业标准等。

制药机械 URS 的概念与要素1、制药机械URS 的概念 (2)1.1URS 与制药机械URS 的定义1.2制药机械URS 在验证中的关系1.3制药机械URS 建立的目的2、制药机械URS 的要素2.1制药机械URS 的前提2.2制药机械URS 的目的2.3制药机械URS 中技术参数与性能的要素2.3.1技术参数2.3.2产品性能 (3)2.3.2.1产品的结构和制造方面2.3.2.2电气和控制方面2.3.2.3环境和公用配套方面2.3.3其他方面2.3.4提供的文件2.4制药机械URS 中技术规格的要素2.4.1制药机械URS 中技术规格内容2.4.1.1总述方面2.4.1.2各部件的技术规格内容2.4.2制药机械URS 中技术描写 (4)2.4.3制药机械URS 中相关服务2.4.3.1工厂验收(FAT)2.4.3.2设备吊装2.4.3.3客户验收(SAT)和培训2.4.4费用分担2.4.5文件确认2.4.5.1设计安装确认2.4.5.2运行确认2.4.6提供文件 (5)2.4.7备品备件2.4.8打包2.4.9商务3、结语用户需要标准 URS(User Requirement Specification)这个词位在 FDA 的许多文件中常出现,而国内权威文献《药品生产验证指南(2003)》(国家食品药品监督管理局主编)对URS 也有较多的论述,可见 URS 在现代制药生产中的重要性。
然而,国内对URS 这一科学与现代的理念较为陌生,表现在大多的制药生产企业与制药机械制造商对 URS 不重视,尤其是制药生产企业在项目建设、生产工艺、设备采购、验证等过程中仍停留在较为原始的层面上,忽视了进行这些过程的最基础工作——URS。
本文将从 URS 的概念出现,阐述了制药生产中众多 URS 之一的制药机械 URS 的要素。
1、制药机械 URS 的概念1.1URS 与制药机械 URS 的定义(1)URS 是指用户需要标准或用户技术要求,其是使用方提出要求的标准,此标准将由项目功能标准(FS)与设计标准(DS)而实施。

高效包衣机ICS 11.120.30C 92JB中华人民共和国制药机械行业标准JB 20016-2004代替YY 0253-1997高效包衣机High efficiency coating machine2004-02-05发布 2004-06-01实施国家发展和改革委员会发布目次前言 ..................................................................... (3)1 范围 ..................................................................... (4)2 规范性引用文件 ..................................................................... ................................................4 3 分类和标记 ..................................................................... .......................................................4 4 要求 ..................................................................... (5)5 试验方法 ..................................................................... .. (6)6 检验规则 ..................................................................... .. (8)7 标志、使用说明书、包装和贮存 ..................................................................... (9)前言本标准是根据《药品生产质量管理规范》和GB/T 1.1- 2000, GB/T 1.2- 2002 标准化工作导则的要求,对YY 0253- 1997 《高效包衣机》进行的修订。

用户需求/URS吴旭XUXW@内容•URS的目的•URS的内容•实例分析URS 目的•URS清楚定义了用户希望从一个新设施,设备和系统所得到什么。
它定义了运行的功能,系统运行的数据和运行环境。
URS还定义了任何非功能的要求和限制,如时间和费用,所提供的交付要求。
重点应放在要求的功能而不是实施这些功能的方法。
•URS提供了文件化的证据说明已充分和适当地定义了用户的要求并为后面的验证文件的准备建立了基础。
URS也可作为招标选择供应商的基础,同样的也经常作为一个契约文件。
URS 的起草产品开发关键工艺参数工艺设计关键运行参数及指标设备的调研设备要求验证要求其它考虑Validation model 验证模型Performance Requirements 性能要求Installation Requirements 安装要求Operational Requirements 运行要求Workflow 工作流程Performance Qualification 性能确认Operational Qualification 运行确认System 系统Installation Qualification 安装确认Relations 两者间的关系Process Requirements And Product Specification 工艺要求和产品技术规格Process Validation 工艺验证DESIGNDOCS设计文件URS 用户需求说明Qualification 确认内容•项目背景•职责•范围•法规要求•工艺描述•功能要求•-关键功能•-自动化控制•安装要求-材质-安装条件•安全要求•额外要求-批记录的格式-培训•文件要求包衣机URS本用户需求规范包含一台包衣机。
供货范围包括,但不限于:包衣机需配置可观察视窗,并能确保从视窗能清楚的观察到其腔体,并能确认包衣片是否粘连设备包括•包衣机•进风系统•排风除尘系统•自控监控系统•内部观察照明•出料系统•雾化系统•在位清洗系统•仪表•取样系统法规要求总的来说,供应商的职责是应保证设备的设计和制造应该按照相关的中国的法规、标准和指南的最新版以及随后的修正案进行,包括但不限于:中国SFDA:药品生产质量管理规范,2010GAMP 5 良好自动化制造规范5GB 50058-1992 爆炸和火灾危险环境电力装置设计规范GB12476.3-2007 可燃性粉尘环境用电气设备.第3部分:存在或可能存在可燃性粉尘的场所分类JB 20016-2004 高效包衣机工艺描述药片(素芯)由可移式斜槽加料到滚筒内。
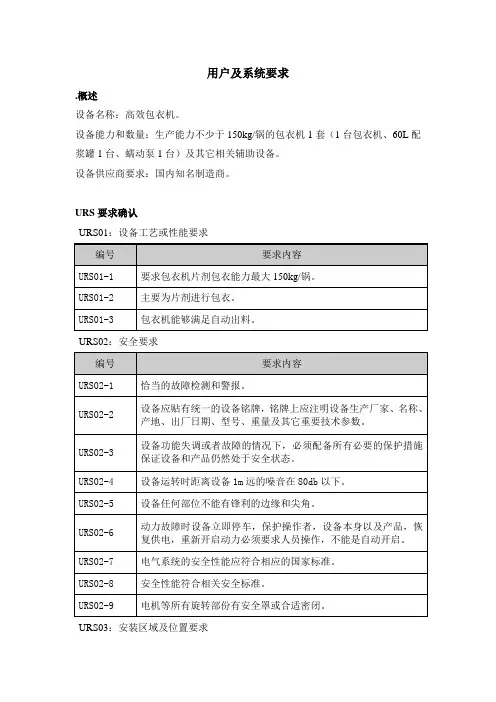
用户及系统要求
.概述
设备名称:高效包衣机。
设备能力和数量:生产能力不少于150kg/锅的包衣机1套(1台包衣机、60L配浆罐1台、蠕动泵1台)及其它相关辅助设备。
设备供应商要求:国内知名制造商。
URS要求确认
URS01:设备工艺或性能要求
URS02:安全要求
URS03:安装区域及位置要求
URS04:安装环境要求
URS05:电力要求
URS06:设施/公用系统要求
.URS07:外观及材质要求
URS08:技术要求
URS09:安装要求
URS10:控制与保护功能要求
.URS11:其他功能要求
URS12:控制系统要求
URS13:仪表要求
URS14:清洁要求
URS15:润滑剂要求
URS16:设备转运要求
URS17:验证/确认要求
URS20:质量保证和售后服务。

目录1、概述2、工作原理3、设备的性能4、设备的主要配置与结构5、设备的安装6、设备的润滑7、设备的维护、保养及注意事项8、易损件1、概述市健牌药业机械制造是专业制造制药设备的知名企业。
健牌JGB-E型高效包衣机广泛应用于中、西药片、药丸以及食品行业中进行糖衣、薄膜包衣的专用设备。
该组合设备的外表面、喷洒装置、包衣滚筒以及所有与药品接触的部件全部采用优质不锈钢材料精制而成,整个包衣工艺操作由微机可编程系统控制自动运行;触摸屏操作,动态显示(亦可手动控制)。
物料始终处于密闭、负压、洁净的空间完成,符合制药工业“GMP”要求。
是一种设计合理、结构紧凑、高效、节能、稳定可靠、操作简便的新型包衣设备。
2、工作原理健牌JGB-D型高效包衣机的工作原理(图1)。
被包衣的片芯在主机全密闭的滚筒经特制搅拌器作用,作连续复杂轨迹运动。
包衣介质通过蠕动泵与喷雾装置的作用,经微机PLC控制系统在设定的工艺流程与工艺参数进行自动化处理(亦可手动操作),将包衣介质均匀地喷洒在动的片芯表面。
与此同时,滚筒在负压状态下,经热风柜提供10万级净化热空气输入滚筒,渗透己喷洒包敷介质的片床间隙扩散干燥。
又在片筒底部出风口的最佳位置经排风力的作用排出机外。
整个包衣工艺流程是在微机的设定程序完成。
使片芯包衣膜得到快速、均匀干燥。
如此反复循环,片芯表面便形成一层坚固、光滑、致密的平整包衣薄膜。
3、设备的性能3.1 主要性能参数 350Ea.最大生产能力350 kg/次b.包衣滚筒调速围 2-14rpmc.主机电机功率 3kwd.加料口直径Ф480mme.包衣滚筒直径Ф1400mmf.滚筒网孔直径Ф3mmg.热风柜供风容积 5500m3/hh.热风调温围 <80℃i.热空气过滤洁净度 10万级j.热风柜电机功率 1.5kwk.排风柜排风容积 6500m³/h l.排风柜电机功率 7.5kw m.主机外型尺寸 1860×1650×2080mm n.主机重量 1050kg o.热风柜外型尺寸 1100×1500×2480mm p.热风柜重量 350kg q.排风柜外型尺寸 1080×1200×2200mm r.排风柜重量 700kg s.蠕动泵电机功率 0.4kwt.蠕动泵调速围 0-190rpmu.蠕动泵外型尺寸 450×400×900mmv.保温搅拌罐功率 8kww.保温搅拌罐容积 150Lx.保温搅拌罐调温围 <85℃y.保温搅拌罐外型尺寸 950×750×1150mm z.强电柜外形尺寸 600×220×810mm 控制柜外形尺寸 550×420×1300mm3.2 外部条件a.电源:三相五线 22kw.380V.44A单相三线8kw.220V.40Ab.洁净压缩空气:压力 >0.6Mpa耗气量 100 m3/hc.蒸汽:压力 0.4Mpa耗汽量 170kg/hd.水源压力 >0.15Mpae.风管法兰外径Φ265×Φ310mmf.电加热散热器功率 36 kw4、设备的主要配置与结构4.1 JGB-350D型高效包衣机主要由主机、净化热风柜、除尘排风柜、喷雾系统、微电控制系统、出料装置等组成。

片剂制剂车间设计生产设备选型片剂制剂车间是制药企业中非常重要的一个部分,它主要用于生产各种类型的片剂制剂。
在设计片剂制剂车间时,需要考虑多个因素,包括生产工艺、生产能力、设备选型、工作流程、符合GMP要求等。
本文将从这些方面进行详细阐述。
一、生产工艺1.1 原料准备:原料准备是片剂制剂车间的第一步,它包括原料的称重、筛分、混合等工序。
在选型设备时,应选择适合不同类型原料的称重设备、筛分设备和混合设备。
1.2 粉碎:粉碎是将原料粉碎成所需颗粒大小的过程。
常用的粉碎设备有颚式破碎机和冲击式破碎机等。
1.3 搅拌:搅拌是将粉末状原料和辅料均匀混合的过程。
搅拌机通常有V型搅拌机和双锥搅拌机等。
1.4 压片:压片是将混合物经过压力加工成固体片剂的过程。
压片机是片剂制剂车间中最重要的设备之一,常用的压片机有单向压片机和旋转压片机等。
1.5 包衣:包衣是将片剂表面包覆一层保护膜的过程,常用的包衣设备有流化床包衣机和旋转包衣机等。
1.6 包装:包装是将片剂装入适合的包装容器中,并进行封口、贴标签等工序。
常用的包装设备有胶囊充填机、板式包装机和瓶装线等。
二、生产能力2.1 产能需求:在设计片剂制剂车间时,需要根据企业的生产需求确定生产能力。
生产能力决定了车间所需设备的数量和规格。
2.2 设备配置:根据产能需求确定设备配置,合理布局各个设备之间的工作区域,确保生产流程顺畅。
同时还需要考虑设备的维护保养空间和操作人员通行区域。
三、设备选型3.1 设备性能:在选型设备时,需要考虑设备的性能指标,如工作效率、精度、稳定性等。
选择性能优良、质量可靠的设备可以提高生产效率和产品质量。
3.2 设备适应性:不同类型的片剂制剂可能需要不同的生产设备。
在选型设备时需要根据生产工艺要求选择适应性强的设备,能够满足不同类型片剂制剂的生产需求。
3.3 设备可靠性:片剂制剂车间是一个长时间连续运行的工作环境,因此设备的可靠性非常重要。
选择具有良好口碑、使用寿命长、故障率低的设备可以减少生产中断和维修成本。
种子包衣机标准
种子包衣机需要满足的标准主要包括以下几个方面:
1.包衣机应是符合JB/T 7730规定的合格产品,且应具有种衣剂加温装置及防
沉淀搅拌功能。
2.包衣种子需经干燥清选,净度不低于98%,水分不大于13%,其中大豆水分不
大于12%,温度不低于作业环境温度。
3.种衣剂必须是取得农药登记证和生产许可证的合格产品,且化学农药种衣剂粘
度不大于400mPa.s,生物种衣剂粘度不大子200mPa.s。
4.种衣剂需具有冷贮稳定性,在低温条件下贮放,其物理性状无明显变化,不影
响药效和包衣质量。
在室温条件下成膜时间2min~4min,低温条件下成膜时间不超过20min,其中大豆不超过10min。
5.经包衣后发芽试验,确认不降低发芽率之后,方可使用。
6.每台包衣机应配备1~2名经过培训的操作人员和适当数量的辅助人员。
以上信息仅供参考,具体标准建议查阅相关文献或咨询农业专家。
用户需求标准1、目的本文件适用于包衣机项目的用户需求说明,是用户根据生产需要提出的技术要求和质量服务要求。
目的是确定设备的设计、安装、操作、清洗和验证等需求。
URS内容也将在生产制造商合同中被引用。
2、供货范围/职责2.1相关规范2.1.1制药规范:该套设备应符合制药工业标准、中国GMP标准。
2.1.2其他规范:该套设备还应符合中国相关规范,例如:电器、安全、环保等。
2.2组成部分包衣生产线主要包括如下组成部分主机装卸料装置供液系统供风系统(含除湿)排风除尘系统(含消音器)配浆罐(气动)1个配电柜控制系统CIP系统主机与辅机间连接的管路和阀门保证安全操作的所有装置、计量设施、专用工具(操作和维修)、电气线路和设备2.3供应商职责2.3.1供应商对设备的设计、制造、组装、发货、运输、检测、验证、提供的文件和包装的完整性负责。
供应商对次级供应商提供的材料、设备和设计负责,对次级供应商的质量控制系统的有效执行负责。
以上所有内容均应符合GMP等的要求。
2.3.2供应商供应的设备和服务要完全符合本技术文件要求和相关行业标准,如果与本技术文件发生了任何偏差,应由供应商指出具体的偏差。
2.4质量体系2.4.1供应商必须对产品的设计和制造有一个明确的质量体系,包括工程/软件的应用。
供应商必须能够证明自身和次级供应商质量体系的运用是合理和连续的。
2.4.2供应商必须有用于验证的质量计划。
包括:开发和测试方法(例如V—模型)和每个元素文件的相关解释用于检测和测试的技术文件列表(原始数据)应与IQ、OQ、PQ的验证阶段相关交付的设备清单校验信息2.4.3供应商必须提供标准质量计划和相关文件模板。
2.4.4为保证文件的可追溯性,供应商必须提供一个变更控制的管理文件和相关的记录来控制在测试中出现的偏差。
3.产品方案及可利用条件(用户)3.1产品方案(仅供参考、1台填1列)3.2可利用条件3.2.1安装位置及可利用空间3.2.1.1该套设备将被安装在包衣室房间。
中药厂各车间所需设备价格与人员配置(共5篇)第一篇:中药厂各车间所需设备价格与人员配置一前处理 4人1清洗机⑷48000 2切药机⑷25000 3炒锅⑷68000 4煅锅⑷68000 二提取 2人1小型多功能低温回流提取浓缩机组⑸90000 2搅拌机⑶16000 3真空干燥箱⑼85000 4粗粉碎机⑶35000 5细粉碎机⑶95000 150型 6动筛⑶8000 7三维混合机⑶18000 三片剂车间5人 FL型沸腾制粒干燥机⑼ 120000 FL-200 160000 2 压片机⑺17冲150000 3 包衣机⑥240000 4 吸尘器⑺ 四胶囊车间1全自动硬胶囊充填机⑺150000 全自动铝朔包装机⑾78000 吸尘器⑺ 高效多功能全自动胶囊印字机⒀ 48000 五口服液车间 4人1反渗透纯水设备⑴ 32000 多校蒸馏水机⑻100500 纯蒸汽发生器⑻38000 4 洗瓶机⑶水洗型36000 超声波型140000 罐装机压盖机⑶850006不干胶贴签机⑶380007灭菌柜⑽60000 六包装车间 6人喷码机⑶28000 朔封机⑿3800 打包机⑿16000 三维包装机⒀ 68000 七化验室 2人干燥箱恒温箱⒂21102灭菌箱⒂21103水分测定仪⒂11800 片剂硬度测试仪⒁ 12000 片剂脆碎度测试仪⒁7500 智能崩解仪⒁5900 显微镜⒂ 36000 电子天平⒂7000 液相色谱仪⒂ 120000 超声波洗瓶机⒂ 4180 电热培养箱⒂ 2575第二篇:编辑部人员配置及各岗位职责、要求编辑部人员配置及岗位职责、要求一、主编: 1名岗位职责:1、策划、编辑、执行联盟发行的各类读物及网站的选题,编写文案与宣传文档。
2、根据联盟规划内容,不断完善联盟周刊、简报及网站的内容及质量。
3、主持并审核编辑人员的日常工作及稿件内容,负责编辑人员的管理、考核、培训及沟通。
4、针对市场热点,组织专题策划制作。
高效包衣机用户需求标准批准执行签名下面的签名表示对本URS内容已经审核完毕,且表明已经为执行作好了准备。
在批准后,任何针对本文件的内容进行改变或修正的活动,都必须起到完善本URS的作用,所有的改变或修正均应执行变更处理,并经过批准后作为本URS的附件,与本URS一并执行。
目录1. 目的2. 范围3. 责任4. 项目描述5. 生产工艺要求6. 生产能力要求7. 设备功能配置要求7.1. 总体要求7.2. 包衣机系统7.3. 热风系统7.4. 过滤器装置7.5. 排风系统7.6. 喷雾系统7.7. 集尘机设备7.8. 结构材料7.9. 逻辑及自动控制7.10. 过程控制8. GMP要求8.1. 工艺参数控制要求8.2. 清洁要求8.3 操作维护要求8.4 技术文件要求8.5. 数据完整性8.6 .批记录打印9. EHS要求10. 计算机系统要求10.1. 硬件选型要求10.2 .软件系统要求11. 项目实施用户需求11.1. 进度表11.2. 法律和法规要求12. 供货、服务要求12.1. 计划12.2. URS 响应和DQ12.3. FAT 工厂测试12.4.SAT 现场测试12.5.IQ/OQ 安装/运行确认13. 交货13.1. 货物的运输13.2. 安装13.3. 培训14. 售后要求15. 变更管理需求16. 变更历史及原因17. 附件18. 分发部门1. 目的本URS需求标准旨在从项目和设备的角度阐述用户的需求,包括了用户对该项目的质量要求(符合新版GMP),描述了用户对高效包衣机的工作过程及功能的期望。
主要包括相关法规符合度和用户的具体需求,这份文件是构建起该项目和设备文件体系的基础,同时也是在高效包衣机的设计、制造、采购、验收和确认等过程中为用户和设备生产商提供双方可接受的依据标准。
设备生产商应在规定的时间内完成并达到本用户需求的设计目标和可接受的质量标准。
在本URS中用户仅提出基本的技术要求和设备的基本要求,并未涵盖和限制卖方设备具有更高的设计与制造标准和更加完善的功能、更完善的配置和性能、更优异的部件和更高水平的控制系统。
bosch流化床包衣机技术参数Bosch流化床包衣机技术参数流化床包衣机是一种广泛应用于制药、食品、化工等行业的设备,用于对颗粒状物料进行包衣处理。
Bosch公司作为全球知名的工程技术和服务提供商,其推出的流化床包衣机技术备受关注。
下面将就Bosch流化床包衣机的技术参数进行详细介绍。
1. 包衣容量:Bosch流化床包衣机的包衣容量可根据不同需求进行调整。
一般而言,其包衣容量范围从几十升到几百升不等,以适应不同规模生产需求。
同时,Bosch公司还提供定制化服务,可以根据客户特定的包衣容量要求进行设计和制造。
2. 进料速度:流化床包衣机的进料速度是指物料进入包衣机的速度。
Bosch流化床包衣机的进料速度可根据物料特性和包衣工艺要求进行调节。
其具有高效的进料系统,可实现精确控制物料的进料速度,确保包衣过程的稳定性和均匀性。
3. 包衣效果:Bosch流化床包衣机采用先进的包衣技术,能够实现高质量的包衣效果。
其独特的流化床设计和喷雾系统可以确保物料表面均匀受到包衣剂的覆盖,从而实现理想的包衣效果。
同时,该机器还可以根据不同物料的特性进行调整,以满足不同包衣要求。
4. 包衣剂消耗:Bosch流化床包衣机的包衣剂消耗量较低,能够实现节约成本的效果。
其高效的包衣技术和喷雾系统可以最大限度地利用包衣剂,减少浪费。
此外,该机器还具有智能控制系统,可以根据实际需要调整包衣剂的用量,进一步降低成本。
5. 温度控制:Bosch流化床包衣机配备了先进的温度控制系统,可以精确控制包衣过程中的温度。
通过调整加热系统和风量控制系统,可以实现对流化床的温度均匀分布和精确控制。
这对于保证包衣过程的稳定性和产品质量至关重要。
6. 机器尺寸:Bosch流化床包衣机的机器尺寸较小巧,占地面积较小。
这使得该设备适用于空间有限的生产环境,并方便设备的摆放和维护。
同时,其结构紧凑,操作简便,易于清洁和维护。
7. 自动化程度:Bosch流化床包衣机具有高度的自动化程度,可以实现全自动的包衣过程。
Q/SMA高效包衣机High efficiency coating Machine淄博伊马新华制药设备有限公司发布Q/SMA0001-2014前言包衣机目前有行业标准JB20016-14,但是该标准并不完全适合档次较高无孔的包衣机,该标准主要涵盖的内容为有孔包衣机,其中关于糖包衣的内容,已明显落后于国外的技术,关于防爆方面的认识,仅停留在电机防爆上,在命名方面,标准中的命名方法不能涵盖无孔包衣机的各种功能,为保证产品质量。
特制定企业标准作为组织生产和检验的依据,企业承诺投入生产时检验手段能满足要求。
a)本标准引用了行业标准JB20016-2004中的下列内容●第四章中的4.1,4.2,4.3,4.5,4.6,4.7,4.8●第五章中的5.1,5.2,5.3,5.5,5.6,5.7,5.8●第六章中的6.1,6.2●第七章中的7.2,7.3,7.4本标准于2014年1月27日发布并实施,自发布之日起有效期三年,到期复审。
本标准由淄博伊马新华制药设备有限公司提出。
本标准起草单位:淄博伊马新华制药设备有限公司。
标准主要起草人:苗启义高效包衣机1 范围本标准规定了包衣机的分类和命名、要求、试验方法、检验规则和标志、使用说明书、包装和贮存。
本标准是根据《药品生产质量管理规范》和GB/T1.1-2000、GB/T1.2-2002标准化工作导则的要求,引用了GB20016-2004中的部分条款。
本标准适用于高效无孔包衣机、有孔包衣机。
2 规范性引用文件下列文件中的条款通过本标准中引用而成为本标准的条款。
凡是注日期的引用文件,其随后所有的修改单(不包括勘误的内容)或修订版均不适用于本标准,然而,鼓励根据本标准达成协议的各方研究是否可使用这些文件的最新版本。
凡是不注日期的引用文件,其最新版本适用于本标准。
GB/T 191 包装储运图示标志GB5226.1-2002 机械安全机械电气设备第1部分:通用技术条件GB/T 6388 运输包装收发货标志GB/T 9969.1 工业产品使用说明书总则GB/T 10111 利用随机数子进行随机抽样的方法GB/T 13306 标牌GB/T 13384 机电产品包装通用技术条件GB/T 16769 金属切削机床噪声声压级测量方法YY/T 0216 制药机械产品型号编制方法GB/T4237 不锈钢热扎钢板YBB00012002 低密度聚乙烯输液瓶(试行)YBB00022002 聚丙烯输液瓶(试行)中华人民共和国药典(2000版)国家药典委员会药品生产质量管理规范(1998修订版)(国家药品监督管理局)3 产品型式、分类与命名3.1 产品型式产品型式分为:无孔包衣机、有孔包衣机。
用户需求标准
1、目的
本文件适用于包衣机项目的用户需求说明,是用户根据生产需要提出的技术要求和质量服务要求。
目的是确定设备的设计、安装、操作、清洗和验证等需求。
URS内容也将在生产制造商合同中被引用。
2、供货范围/职责
2.1相关规范
2.1.1制药规范:该套设备应符合制药工业标准、中国GMP标准。
2.1.2其他规范:该套设备还应符合中国相关规范,例如:电器、安全、环保等。
2.2组成部分
包衣生产线主要包括如下组成部分
主机
装卸料装置
供液系统
供风系统(含除湿)
排风除尘系统(含消音器)
配浆罐(气动)1个
配电柜
控制系统
CIP系统
主机与辅机间连接的管路和阀门
保证安全操作的所有装置、计量设施、专用工具(操作和维修)、电气线路和设备
2.3供应商职责
2.3.1供应商对设备的设计、制造、组装、发货、运输、检测、验证、提供的文件和包装的完整性负责。
供应商对次级供应商提供的材料、设备和设计负责,对次级供应商的质量控制系统的有效执行负责。
以上所有内容均应符合GMP等的要求。
2.3.2供应商供应的设备和服务要完全符合本技术文件要求和相关行业标准,如果与本技术文件发生了任何偏差,应由供应商指出具体的偏差。
2.4质量体系
2.4.1供应商必须对产品的设计和制造有一个明确的质量体系,包括工程/软件的应用。
供应商必须能够证明自身和次级供应商质量体系的运用是合理和连续的。
2.4.2供应商必须有用于验证的质量计划。
包括:
开发和测试方法(例如V—模型)和每个元素文件的相关解释
用于检测和测试的技术文件列表(原始数据)应与IQ、OQ、PQ的验证阶段相关交付的设备清单
校验信息
2.4.3供应商必须提供标准质量计划和相关文件模板。
2.4.4为保证文件的可追溯性,供应商必须提供一个变更控制的管理文件和相关的记录来控制在测试中出现的偏差。
3.产品方案及可利用条件(用户)
3.1产品方案(仅供参考、1台填1列)
3.2可利用条件
3.2.1安装位置及可利用空间
3.2.1.1该套设备将被安装在包衣室房间。
房间示意图如下:
辅机布局:(俯视图)
3.2.1.2房间环境
3.2.2公用工程列表(用户列出可提供的公用工程名称、规格,供应商需在技术描述或标书中逐一列出用量、用途,如有其它公用工程项目需要在表格空白处U3.2.2-9后写明)
4.技术要求
4.1GMP相关与否定义
GMP相关的是、不是、——定义如下:
是:所描述功能在产品的生产和控制中与质量相关,所述功能用于生产、记录、分析或存档相关的数据,或所述功能被用来控制GMP的相关体系。
GMP相关项目须在今后的验证中体现。
不是:对GMP的要求无重大影响、无须在验证过程中体现。
只有与GEP(良好工程规范)相关的每一部分内容,都应由有资格的人员进行检查、测试和记录。
执行。
4.2工艺过程
4.3工艺技术参数
4.4技术功能描述
4.5材质要求
4.6清洁
电器、仪表、自控5.1电器
5.2仪表
5.3自控
6、HSE
供货商应根据中国GMP(2010版)标准、良好的工程规范(GEP)、欧洲指标和FDA的相关规定,并按中国GMP(2010版)来考虑所有的安全因素。
用于设备的设计材料、制造、文件、官方测试等所有内容都要符合国际规定和ISA准则。