清华大学化学系仪器分析电化学
- 格式:ppt
- 大小:700.00 KB
- 文档页数:64
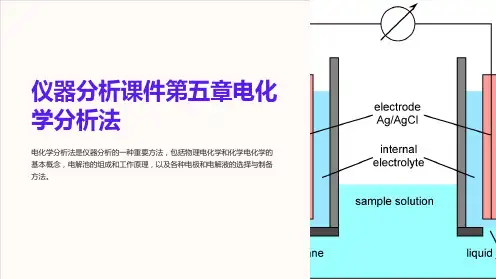

仪器分析大实验电化学测试的实验报告极化
极化是电化学测试中常见的现象,它在电极上形成了一个电势障碍,阻碍了电流的流动。
极化通常分为两种:
1. 浓度极化:当电极表面周围的溶液中反应物浓度不足时,由于反应速率缓慢,导致电极上的反应物浓度降低,电极与溶液接触面积减小,从而导致电极的活性降低,电极内外所产生的电势差增加,出现浓度极化现象。
2. 电化学极化:由于反应速率较快,电流密度增大,导致电极表面氧化还原反应进行不完全,氧化物和还原物在电极上积聚,从而导致电极的活性降低,出现电化学极化现象。
为了解决极化问题,可以采取以下措施:
1. 增加溶液中反应物浓度,消除浓度极化现象。
2. 增加电极的表面积,提高反应速率,消除电化学极化现象。
3. 使用交错电极、倒置电极、振荡电极等特殊设计的电极,消除极化现象。
在电化学测试中,极化现象的存在会对测试结果的准确性产生一定影响,需要合理设计实验方案,选择合适的电极,采取相应的措施以消除或减小极化现象的影响。

仪器分析复习题(电化学)一、问答题1、单扫描极谱法和循环伏安法在原理上有何异同点?1、答:循环伏安法和单扫描极谱法都是利用产生的伏——安曲线进行分析的一种方法,测量池均为电解池,循环伏安法和单扫描极谱法一般都采用的是三电极系统。
循环伏安法以固体电极为工作电极,如玻碳电极,悬汞电极,汞膜电极等,单扫描极谱法以滴汞电极为工作电极,它们一般都以饱和甘汞电极为参比电极,鸽电极为对电极。
单扫描极谱法在分析中采用锯齿波形加压的方法,在每一滴汞上,前5秒静止富集,后2秒加极化电压,在一滴汞上测得一个峰形伏——安曲线,获得一个数据,分辨率(△EM30〜50mV)和灵敏度(1 X 10_7mol/L)相对较高,分析时间短,峰电流ip二k z C;峰电位为4)pc=4)1/2 -1.11RT/nFo循环伏安法在分析中施加的是三角波电压,它同时可以得到阳极波(或阳极支) 和阴极波(或阴极支〉,它们的峰电位分别为:4>pa= 01/2 +1.11RT/nF和4>pc二-1.11RT/nF;峰电流为土ip二kC;循环伏安法更多的用于电极反应机理的研究和氧化还原波可逆性的判断。
它们的工作电都是极化电极,具有小的电极表面积和大的电流密度。
2、产生浓差极化的条件是什么?2、答:当电流通过电极与溶液界面时,如果电极电位对其平衡值发生了偏差,这种现象称为极化现象。
当电解进行时,由于电极表面附近的一部分金属离子在电极上发生反应、沉积,而溶液中的金属离子又来不及扩散到电极表面附近,因而造成电极表面附近的金属离子浓度远低于整体浓度,电极电位又取决于电极表面附近的金属离子浓度,所以电解时的电极电位就不等于它的平衡电位,两者之间存在偏差,这种现象称为浓差极化。
3、什么是pA(pH)的实用定义3、答:在电位分析法中,离子选择性电极的定量基础是能斯特方程式,既:E ISE=K±RT/nF In a ; +表示阳离子,一表示阴离子;常数项K包括内参比电极电位,膜内相间电位,不对称电位,测量时还有外参比电极电位,液接电位等,这些变量是无法准确测量的,因此,不能用测的得E ISE去直接计算活度a值,而必须与标准溶液比较才能消除K 的影响,得到准确的分析结果,为此,pH值通常定义为与试液(pHx)和标准溶液(pHs)之间电动势差(ZkE)有关的函数关系如:pHx = pHs+ (Ex — Es)F/RTIn10 ;同样适用于其它离子选择性电极的测量,如:pAx = pAs±Z(Ex~Es)F/RTIn10;被称为pA(pH)的实用定义。







福州大学实验报告课程名称: 仪器分析实验 实验类型:电化学实验实验项目名称:离子选择电极法测定含氟牙膏中氟的含量学生姓名: 陈静康 年级专业:2009级化学类3班 学号:040902328同组学生姓名:孙画 方菁 豆洁 张诗群 张鹏 指导老师: 王建老师实验地点:化学化工学院实验中心北楼 实验日期: 2012 年 4 月 19 日一 目的要求1.掌握用标准曲线法测定未知物浓度。
2.学会使用离子计和离子选择性电极。
二 原理氟离子选择电极的电极膜由LaF 3单晶制成,电极电位(25o C )为:F a b log 0592.0-=ϕ测量电池为:氟离子选择电极│试液(c=x )‖SCE测定时试液中应加入离子强度调节剂TISAB 。
标准曲线法,配制一系列标准溶液,以电位值φ对logC 作图,然后由测得的未知试液的电位值φ,在标准曲线上查得其浓度。
三 仪器与试剂仪器:数字离子酸度计;磁力搅拌器;电极:氟离子选择电极和饱和甘汞电极。
试剂:1.0×10-1mol/L F —标准贮备液:准确称取NaF(120o C 烘1h)4.199g 溶于1000mL 容量瓶中,用蒸馏水稀释至刻度,摇匀。
贮存于聚乙烯瓶中待用;1.000×10-2—1.00×10-5mol/L F —标准溶液用上述贮备液配制;配制离子强度调节剂(TISAB):称取NaCl 58克,柠檬酸钠10克,溶解于800毫升蒸馏水中,再加入冰醋酸57毫升,用固体氢氧化钠(或40%氢氧化钠溶液)调节到pH=5,最后稀释到1升。
样品(日用牙膏)。
四实验步骤1.氟离子选择电极的准备将氟离子选择电极泡在1×10-4mol/L 氟离子溶液中约30min,然后用蒸馏水清洗数次直至测得的电位值约为-300mV(此值各支电极不同)。
若氟离子选择电极暂不使用,宜于干放。
2.绘制标准曲线在5只100mL容量瓶中分别配制内含5mL离子强度调节剂的 1.000×10-2—1.00×10-5mol/L 氟离子标准溶液。

分析化学中的仪器分析与分析方法化学领域中的仪器分析与分析方法是实验室研究中的关键部分。
化学分析需要准确度高的方法,并在许多领域中发挥着关键作用。
这篇文章将讨论一些最常用的化学分析仪器和方法,以及它们在实验室中的重要性。
一、核磁共振(NMR)技术核磁共振技术是化学研究中最常用的分析工具之一。
通过检测样本中的原子核吸收电磁辐射的能量,核磁共振技术可以确定化合物的结构和化学组成。
这种技术在溶液和固体样品中都可用,并且可以用于生物和无机分子的分析。
在实验室中,核磁共振技术通常用于化学合成过程的分析,例如用于测量反应物和产物的比例、鉴定化合物等。
它还可以用于研究一系列小分子之间的相互作用,以及跨膜蛋白结构的确定。
二、质谱技术质谱技术是一种将样品分离,并将其分子以原子或分子的形式检测的技术。
它可以用于鉴定、定量和分析样品中的单个分子或多个分子。
质谱技术也可用于了解溶液或气体样品中的各种相互作用。
质谱技术在许多化学研究领域中都能派上用场。
例如,在生物化学中,质谱技术可以用于鉴定蛋白质和核酸等分子;在分析化学中,质谱技术可以用于定量分析,例如血液中各种代谢产物的浓度;在有机化学领域中,质谱技术则可以用于鉴定具体的结构和化学组成。
三、液相色谱(HPLC)液相色谱或高效液相色谱(HPLC)是分析化学中最常用的技术之一。
在HPLC中,将待测化合物与移动相混合,使它们在高压下通过一个涂有固定相的柱子。
物质以不同的速率运动,由此实现了物质的分离和纯化。
HPLC技术可用于测定化合物纯度和测量样品中成分的含量。
在制药行业中,HPLC技术被广泛应用于纯化和测量药品的含量,特别是氨基酸、核苷酸和多肽等复杂分子的分析。
四、红外光谱(IR)技术红外光谱技术是从样品中检测其吸收的红外光波长,以确定物质分子中化学键的类型和存在方式的分析方法。
它在研究分子结构和成分方面提供了有价值的信息,并具有非常高的灵敏度和特异性。
在化学研究中,红外光谱技术通常用于测定农药和其他环境污染物的存在和分布,以及材料科学研究领域的表征和分析。
清华大学化学专业《仪器分析》期末考试试题(D卷)姓名_________________学号________________班级________________________一、判断题(正确的在后面括号内打“√”,错误的打“×",每小题2分,共10分)1.提高分离电压是增加毛细管电泳分离效率的主要途径,只要提高分离电压任何难分离物质对都可获得分离。
这也是毛细管电泳应用广泛的主要原因。
()2.在核磁共振波谱分析中,测定13C比测定1H的灵敏度高,但13C谱的分辨率低()3.压力变宽引起中心频率偏移,温度变宽不引起中心频率偏移()4.恒阴极电位中,电解分析完成的时间取决于溶液的起始浓度()5.原子光谱分析中,共振线是指由第一激发态回到基态所产生的谱线,通常也是最灵敏线、最后线。
()二、选择题(每小题2分,共20分)1.在色谱分析中,调整保留时间实际反映了___________之间的相互作用。
A.组分与流动相B。
组分与固定相 C.组分与组分 D.流动相与固定相2.在长1m的色谱柱上测得两组分的分离度为0。
75,若要使两组分完全分离,则柱长应为______ A。
0。
5m B.1。
5m C。
2m D. 4m3.分子外层电子吸收辐射能跃迁到激发态,再通过无辐射弛豫方式转入最低三重态,然后跃迁回到基态各个振动能级,产生光辐射,这种发光现象称为________.A.分子磷光B。
分子荧光 C.化学发光 D.生物发光4。
玻璃电极的膜电位_________。
A.随溶液中氢离子活度的增高向负方向移动B。
随溶液中氢离子活度的增高向正方向移动C. 随溶液中氢氧根离子活度的增高向正方向移动D.随溶液pH的增高向正方向移动5.严重限制经典极谱分析检测下限的因素是________________.A.电解电流B。
扩散电流 C.极限电流 D.充电电流6.与直流极谱相比,单扫描极谱大大降低的干扰电流是________.A。