第一节 离子键和离子晶体gai
- 格式:ppt
- 大小:2.04 MB
- 文档页数:75


3.2 离子键 离子晶体一、离子键1.离子键的形成前面我们已经学过,金属元素的电负性小,其原子易失去价电子形成阳离子;非金属元素的电负性较大,其原子易得到电子形成阴离子,当这两种原子相互接近到一定程度时,容易发生电子得失而形成阴、阳离子,阴、阳离子通过静电作用形成稳定化合物。
这种阴、阳离子通过静电作用形成的化学键叫离子键。
阴、阳离子是形成离子键必不可少的粒子,缺一不可。
如MgCl 2中含有Mg 2+、Cl -,KAl(SO 4)2·12H 2O 中含有K +、Al 3+、SO 2-4及H 2O 分子。
可见,离子化合物中含阴、阳离子至少各1种,且不一定不含分子。
2.离子键的实质离子键的实质是静电作用,它包括阴、阳离子之间的引力和它们的核与核、电子与电子之间的斥力两个方面,当引力和斥力之间达到平衡时,就形成了稳定的离子化合物,它就不再显电性,即显电中性。
离子键的强弱与阴、阳离子所带电荷及核间距有关。
据库仑定律可知2r q q k F -+⋅⋅=(k 为系数)。
3.离子键的特征没有方向性和饱和性。
为什么这样说呢?那是因为在通常情况下,阴、阳离子可看成球形对称,它们的电荷分布也是球形对称的,它们在空间的各个方向上的静电作用相同,所以在各个方向上都可以与带相反电荷的离子发生静电作用,且在静电作用能达到的范围内,只要空间条件允许、一个离子可以同时吸引多个带相反电荷的离子。
因此,离子键没有方向性和饱和性。
二、离子晶体1.离子键:(1)定义:阴、阳离子之间强烈的电性作用。
(2)特征:无饱和性和方向性。
(3)本质:电性作用。
(4)存在:离子晶体中。
2.离子晶体:(1)定义:阴、阳离子通过离子键结合,在空间呈现有规律的排列所形成的晶体。
注意:离子晶体的构成粒子是阴、阳离子,所以在离子晶体中,无分子存在,也无原子存在。
如NaCl 、CsCl 只表示晶体中阴阳离子个数比,不表示分子式。
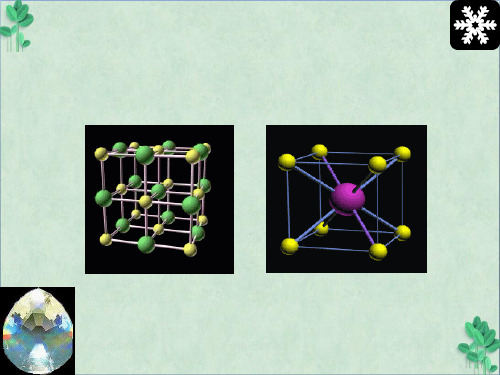
(2)常见的AB 型离子晶体有NaCl 型、CsCl 型、ZnS 型等。



第二单元离子键离子晶体第1课时离子键离子晶体目标导航1.能结合实例描述离子键的成键特征及其本质。
2.能解释和预测同类型离子化合物的某些性质。
3.会描述常见类型的离子化合物的晶体结构。
4.能运用模型和有关理论解释不同类型离子化合物的晶胞构成。
知识精讲知识点01 离子键1.离子键和离子化合物(1)概念:阴、阳离子之间通过静电作用形成的化学键叫离子键,由离子键形成的化合物叫离子化合物。
(2)离子键的成键微粒是阳离子和阴离子。
阴离子可以是单核离子或多核离子,如Cl-、O2-、H-、O22-、OH-、SO42-等。
阳离子可以是金属离子(如K+、Ag+、Fe3+)或铵根离子(NH4+)。
有的离子化合物只含有离子键,有的离子化合物中既含有离子键又含有共价键。
2.离子键的形成及特征(1)离子键的形成:①阴、阳离子之间的静电引力使阴、阳离子相互吸引,阴、阳离子的核外电子之间、原子核之间的静电斥力使阴、阳离子相互排斥。
②当阴、阳离子之间的静电引力和静电斥力达到平衡时,阴、阳离子保持一定的平衡间距,形成稳定的离子键,整个体系达到能量最低状态。
(2)离子键的特征:离子键没有方向性和饱和性。
阴、阳离子在各个方向上都可以与相反电荷的离子发生静电作用,即没有方向性;在静电作用能够达到的范围内,只要空间允许,一个离子可以同时吸引多个带相反电荷的离子,即没有饱和性。
【即学即练1】(1)下列化合物中,属于离子化合物的有_______,其中,既含有离子键又含有共价键的有_______。
①HCl ②NaCl ③Na2O ④NaOH(2)写出下列离子化合物的电子式:NaOH_____________ K2O_____________ NH4Cl____________答案:(1)②③④④(2)知识点02 离子晶体1.概念及结构特点(1)概念:由阴、阳离子按一定方式有规则地排列形成的晶体。
(2)结构特点①构成微粒:阴离子和阳离子,离子晶体中不存在单个分子,其化学式表示的是离子的个数比。